โครงสร้างอะตอมตอนที่ 10 การจัดอิเล็กตรอนของอะตอม(ต่อจากตอนที่9)
ตัวอย่าง การจัดอิเล็กตรอนของ 11Na+ ในระดับพลังงานต่าง ๆ เป็นดังนี้
11Na+ มีอิเล็กตรอน 10
ตัว จัดอิเล็กตรอนใน subshells
ตามลำดับดังนี้
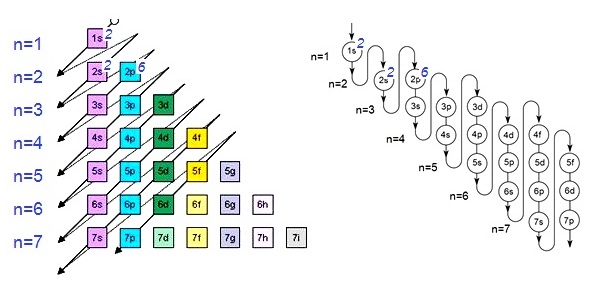 1. แสดงในรูป subshell หรือ subenergy level 11Na ; 1s2 2s2 2p6 1. แสดงในรูป subshell หรือ subenergy level 11Na ; 1s2 2s2 2p6
2. แสดงในรูป
shell หรือ energy level
11Na
2 8 (มีเวเลนซ์อิเล็กตรอน
= 8 )
3. แสดงในรูป orbitals ดังนี้
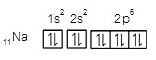
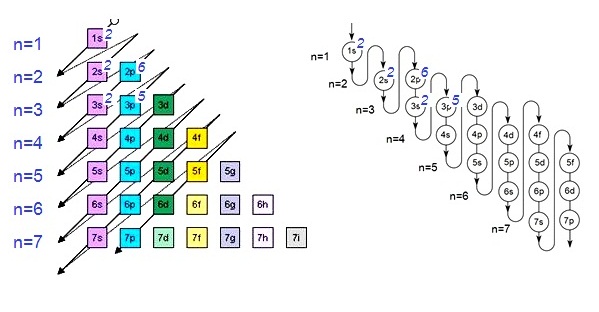
ตัวอย่าง การจัดอิเล็กตรอนของ 17Cl ในระดับพลังงานต่าง ๆ เป็นดังนี้
17Cl มีอิเล็กตรอน 17
ตัว จัดอิเล็กตรอนใน subshells ตามลำดับ ดังนี้
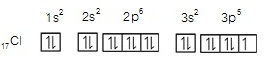
1. แสดงในรูป subshell หรือ subenergy level 17Cl ; 1s2 2s2 2p6
3s2 3p5
2. แสดงในรูป
shell หรือ energy level
17Cl 2 8 7 (มีเวเลนซ์อิเล็กตรอน = 7 )
3. แสดงในรูป orbitals ดังนี้
;
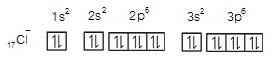
ตัวอย่าง การจัดอิเล็กตรอนของ 17Cl- ในระดับพลังงานต่าง ๆ เป็นดังนี้
17Cl- มีอิเล็กตรอน 18
ตัว จัดอิเล็กตรอนใน subshells
ตามลำดับ ดังนี้

1. แสดงในรูป subshell หรือ subenergy level 17Cl- ; 1s2 2s2 2p6
3s2 3p6
2. แสดงในรูป
shell หรือ energy level
17Cl- 2 8 8 (มีเวเลนซ์อิเล็กตรอน = 8 )
3. แสดงในรูป orbitals ดังนี้
;
การเขียนแสดงการจัดอิเล็กตรอนแบบย่อ
(abbreviated) หรือแบบ NGC (Noble Gas Configuration)
นอกจากวิธีเขียนแสดงการจัดอิเล็กตรอนดังที่กล่าวมาแล้ว ยังมีวิธีเขียนแสดงการจัดอิเล็กตรอนได้อีกวิธีหนึ่งเรียกว่า
หรือ NGC คือใช้สัญลักษณ์ของ Nobel gas (แก๊สมีตระกูล) ชนิดใดชนิดหนึ่งแทนส่วนที่มีการจัดอิเล็กตรอนเหมือน Nobel Gas ชนิดนั้น Nobel Gas คือธาตุหมู่ 8A
ได้แก่ 2He 10Ne 18Ar 39Kr 54Xe 86Rn บางครั้งเรียกว่าแก๊สเฉื่อย , Inert gas เพราะเกิดปฏิกิริยายาก การจัดอิเล็กตรอนของ Nobel Gas มีดังนี้

ตัวอย่าง
การจัดอิเล็กตรอนของ 3Li ; 1s2 2s1 แสดงด้วย NGC ; 3Li [He] 2s1
การจัดอิเล็กตรอนของ 11Na
; 1s2
2s2 2p6
3s1 แสดงด้วย
NGC ; 11Na
; [Ne] 3s1
การจัดอิเล็กตรอนของ 19K ; 1s2 2s2 2p6 3s2 3p6 4s1 แสดงด้วย NGC ; 19K ; [Ar]
4s1
(คลิ้ก ชมแสดงการจัดอิเล็กตรอนแบบ
NGC)
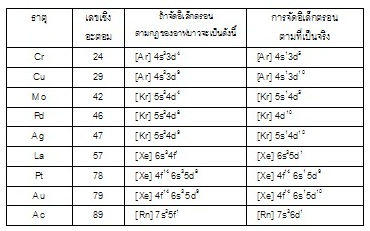
ธาตุที่จัดอิเล็กตรอนไม่เป็นไปตามกฎ
ดังได้ทราบมาในตอนต้นแล้วว่า อาฟบาว
เพาลี และฮุนด์ เป็นผู้พบหลักการจัดอิเล็กตรอนของธาตุต่าง
ๆ
การจัดอิเล็กตรอนของธาตุส่วนใหญ่จะเป็นไปตามกฎของนักวิทยาศาสตร์ทั้ง 3
กฎดังกล่าวมาแล้ว แต่มีธาตุ 9
ธาตุที่จัดอิเล็กตรอนไม่เป็นไปตามกฎของอาฟบาว
คือ อิเล็กตรอนใน subshell
ที่พลังงานต่ำกว่ายังไม่เต็ม
แต่มีการจัดอิเล็กตรอนเอาไว้ใน
subshell
ที่พลังงานสูงกว่า (แต่เป็นไปตามกฎของเพาลี และฮุนด์) ได้แก่
การจัดอิเล็กตรอนของอะตอมปกติกับไอออน
ไอออนจะมีจำนวนอิเล็กตรอนไม่เท่ากับอะตอมในภาวะปกติ ให้สังเกตว่าถ้าเป็นไอออนบวก (cation) จะมีอิเล็กตรอนจะน้อยกว่าอะตอมในภาวะปกติ แต่ถ้าเป็นไอออนลบ (anion) จะมีอิเล็กตรอนจะมากกว่าอะตอมในภาวะปกติ จำนวนอิเล็กตรอนจะลดลงหรือเพิ่มขึ้นเท่าไร ดูได้จากจำนวนของประจุไฟฟ้าของไอออนนั้น ๆ เช่น Al3+ จำนวนอิเล็กตรอนจะน้อยกว่า Al ในภาวะปกติอยู่ 3
ตัว P3- จำนวนอิเล็กตรอนจะมากกว่า P ในภาวะปกติอยู่ 3 ตัว
การจัดอิเล็กตรอนของไอออนมีหลักการเช่นเดียวกับการจัดอิเล็กตรอนของอะตอมในภาวะปกติ ต่างกันที่จำนวนอิเล็กตรอนมีไม่เท่ากัน
ใช้แผนผังสำหรับการจัดอิเล็กตรอนได้เช่นกัน พิจารณาเปรียบเทียบจากตัวอย่างต่อไปนี้

(แบบฝึกหัด อยู่ตอนที่ 11)
รูปภาพที่เกี่ยวข้อง

Size : 53.28 KBs
Upload : 2015-04-06 20:27:54
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|