อัตราเร็วของปฏิกิริยา ตอนที่ 3 อธิบายการเกิดปฏิกิริยาเคมีและปัจจัยที่มีผลต่ออัตราเร็วของปฏิกิริยา
อัตราเร็วของการเกิดปฏิกิริยาเคมี (Rate of chemical
reaction , R,r)
ตอนที่ 3
อธิบายการเกดปฏิกิริยาเคมีและปัจจัยที่มีผลต่ออัตราเร็วของปฏิกิริยา
การเกิดปฏิกิริยาเคมีต่าง ๆ
อธิบายได้ด้วยทฤษฎีต่อไปนี้
1.
ทฤษฎีการชน (The Collision Theory) อธิบายว่าการเกิดปฏิกิริยาเคมีต้องประกอบด้วยปัจจัย 3
ข้อ คือ
1.1 มีการชนกัน (collide) ของอนุภาคของสารที่เป็นคู่ปฏิกิริยา
1.2 การชนต้องมีพลังงานมากพอ (enough
energy) ที่จะทำให้เกิดการสลายพันธะเคมีที่มีอยู่ในสารตั้งต้นได้
(ต่อไปจะเรียกพลังงานงานนี้ว่าพลังงานก่อกัมมันต์หรือพลังงานกระตุ้น
, activation energy)
1.3 ทิศทางในการาชนต้องเหมาะสม (correct orientation) หมายถึง
เป็นทิศทางที่จะทำให้เมื่อเกิดการสลายพันธะในสารตั้งต้นแล้ว อนุภาคจะสามารถสร้างพันธะใหม่ทำให้เกิดผลิตภัณฑ์
เรียกว่าการชนเป็นผลสำเร็จ (ถ้าทิศทางไม่เหมาะสม แม้จะสลายพันธะในสารตั้งต้นได้ แต่ในที่สุดก็สร้างพันธะกลับไปอย่างเดิมจึงไม่ได้ผลิตภัณฑ์ หรือไม่เกิดปฏิกิริยา เรียกว่าการชนไม่เป็นผลสสำเร็จ)
การชนที่ประกอบด้วยปัจจัยทั้ง 3 ข้อดังกล่าวนี้เรียกว่า การชนที่เป็นผลสำเร็จ อัตราเร็วของปฏิกิริยาจะมากหรือน้อย ขึ้นอยู่กับปริมาณของการชนที่เป็นผลสำเร็จที่เกิดขึ้นใน 1
หน่วยเวลา ดังรูป

แบบจำลองแสดงการเกิดปฏิกิริยาเคมีตาม
ทฤษฎีการชน
2.
ทฤษฎีแอกติเวเตดคอมเพลกซ์หรือทฤษฎีสภาวะทรานซิชัน (The
Activated Complex Theory or The Transition State Theory) เป็นทฤษฎีที่ดัดแปลงมาจากทฤษฎีการชน โดยทฤษฎีนี้จะกล่าวถึงการชนอย่างมีประสิทธิภาพในลักษณะหรือทิศทางที่เหมาะสม
แสดงขั้นตอนระหว่างปฏิกิริยา จะเกิดเป็นสารประกอบชั่วคราว ที่เรียกว่า
สารเชิงซ้อนกัมมันต์ (Activated Complex) หรือสารเชิงซ้อนถูกกระตุ้น สารชนิดนี้เป็นเสมือนหัวเลี้ยวหัวต่อที่สารตั้งต้นจะเปลี่ยนเป็นผลิตภัณฑ์ พันธะเคมีของสารตั้งต้นจะค่อย ๆ อ่อนลงและหมดไป
ในขณะที่เริ่มมีการสร้างพันธะใหม่ระหว่างคู่อะตอมที่เหมาะสม จนในที่สุดพันธะเก่าจะถูกทำลายลงอย่างสิ้นเชิง
และจะมีพันธะใหม่ถูกสร้างขึ้นมาแทนที่ ดังแบบจำลองแสดงการเกิดปฏิกิริยาเคมีตามทฤษฎีนี้เป็นดังแผนภาพ
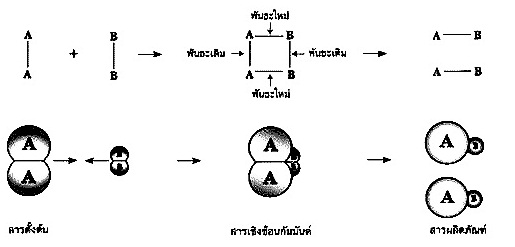
แบบจำลองการเกิดปฏิกิริยาเคมีตาม
ทฤษฎีแอกติเวเตดคอมเพลกซ์
(คลิ้ก ชมทิศทางการชนที่เหมาะสมและไม่เหมาะสม)
ปัจจัยที่มีผลต่ออัตราเร็วของการเกิดปฏิกิริยา
อัตราเร็วของปฏิกิริยาจะมากหรือน้อยขึ้นอยู่กับสาเหตุสำคัญ 2 ประการคือ
ประการแรกอยู่ที่ธรรมชาติของสารแต่ละชนิดว่าเกิดปฏิกิริยาง่ายหรือยาก ประการที่สองอยู่ที่ปัจจัยแวดล้อมต่าง ๆ
ที่จะช่วยส่งเสริมให้อัตราเร็วของปฏิกิริยาเพิ่มขึ้น หรือจะขัดขวางให้ปฏิกิริยาเกิดได้ช้าลง ดังจะกล่าวต่อไปนี้
1.
ธรรมชาติของสารตั้งต้น สารตั้งต้นแต่ละชนิดจะมีความสามารถเกิดปฏิกิริยาเคมีที่แตกต่างกัน
เช่น โลหะแมกนีเซียมทำปฏิกิริยากับสารละลายกรดได้เร็วกว่าเหล็ก
2.
ความเข้มข้นของสารตั้งต้น ปฏิกิริยาส่วนมากจะเกิดได้เร็วขึ้น
ถ้าสารตั้งต้นที่มีความเข้มข้นมากขึ้น
เพราะการเพิ่มความเข้มข้นเป็นการเพิ่มจำนวนอนุภาค ทำให้อนุภาคอยู่ใกล้กันมากขึ้นจึงมีโอกาสชนกันได้มากขึ้นด้วย หรือความถี่ในการชนสูงขึ้น ย่อมทำให้การชนที่เป็นผลสำเร็จมีมากขึ้นด้วย อัตราการเร็วในการเกิดปฏิกิริยาจึงเพิ่มขึ้นด้วย
ดังรูป
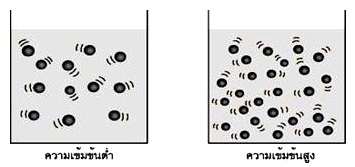
(คลิ้ก ชมผลของความเข้มข้นต่ออัตราเร็วของปฏิกิริยา)
3.
อุณหภูมิ หรือ พลังงานความร้อน การเพิ่มอุณหภูมิจะเป็นการเพิ่มพลังงานจลน์ให้แก่อนุภาคของสาร ทำให้อนุภาคของสารเคลื่อนที่ได้เร็วขึ้นและมีพลังงานจลน์มากขึ้น
การเคลื่อนที่เร็วขึ้นทำให้ความถี่ในการชนเพิ่มขึ้น
ขณะเดียวกันการมีพลังงานมากขึ้นทำให้การชนแต่ละครั้งมีความรุนแรงขึ้นเช่นกัน ทั้ง 2
กรณีมีส่วนทำให้อัตราเร็วของปฏิกิริยาเพิ่มขึ้น แต่สิ่งที่มีผลต่ออัตราเร็วของปฏิกิริยามากกว่าคือพลังงานในการชนที่เพิ่มขึ้น
เพราะมีการทดลองพิสูจน์พบว่าการเพิ่มอุณหภูมิขึ้นระดับหนึ่ง ที่ทำให้ความถี่ในการชนเพิ่มขึ้นเพียงเล็กน้อย
แต่พบว่าบางครั้งอัตราเร็วของปฏิกิริยาเพิ่มขึ้นหลายเท่า ถ้าพลังงานในการชนมากถึงระดับพลังงานก่อกัมมันต์
(Ea) ของปฏิกิริยา
ก็จะทำให้ปฏิกิริยาเกิดขึ้นได้
ในทางกลับกันถ้าลดอุณหภูมิจะทำให้อนุภาคของสารเคลื่อนที่ช้าลงและมีพลังงานลดลง ความถี่ในการชนจึงลดลงเช่นกัน แต่ที่มีผลต่ออัตราเร็วของปฏิกิริยาเป็นอย่างมากก็คือพลังงานในการชนที่ลดลง การเก็บอาหารในตู้เย็นจะเก็บเอาไว้ได้นานกว่าเก็บที่อุณหภูมิห้องเนื่องจาก ในตู้เย็นมีอุณหภูมิต่ำ ทำให้อนุภาคที่จะมีพลังงานสูงถึงระดับค่า Ea มีน้อย
อัตราเร็วในการเกิดปฏิกิริยาจึงต่ำ
ทำให้เก็บอาหารเอาไว้ได้นานขึ้น
สำหรับเนื้อสัตว์แช่แข็งเช่นกุ้งจะใช้อุณหภูมิ -18 oC เป็นมาตรฐาน
กล่าวโดยสรุปก็คือผลของอุณหภูมิที่มีต่ออัตราเร็วของปฏิกิริยา เกิดจากการทำให้อนุภาคมีพลังงานถึงระดับ Ea
มากขึ้นหรือลดลงมากกว่าผลของความถี่ในการชน
พิจารณาจากกราฟต่อไปนี้
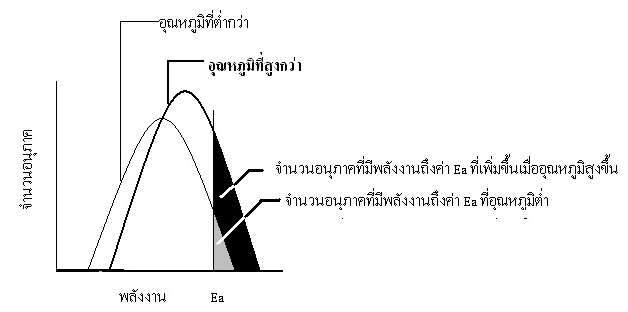
มีสิ่งที่เข้าใจผิดกันอยุ่เสมอก็คือ บางครั้งกล่าวว่าถ้าเป็นปฏิกิยาดูดความร้อน
การเพิ่มอุณหภูมิจึงจะทำให้อัตราเร็วของปฏิกิริยาเพิ่มขึ้น
แต่ถ้าเป็นปฏิกิริยาคายความร้อนต้องลดอุณหภูมิจึงจะทำให้อัตราเร็วของปฏิกิริยาเพิ่มขึ้น
ขอให้ทำความเข้าใจใหม่ว่า ทั้งปฏิกิริยาดูดความร้อนและคายความร้อน ถ้าเพิ่มอุณหภูมิอัตราเร็วของปฏิกิริยาก็จะเพิ่มขึ้น
ถ้าลดอุณหภูมิอัตราเร็วของปฏิกิริยาก็จะลดลง
4. ตัวเร่งปฏิกิริยา (catalyst) ปฏิกิริยาที่เกิดขึ้นได้ยากเป็นเพราะมีค่า Ea สูง
เช่น
การแยกสลายแป้งให้เป็นน้ำตาลโดยไม่ใช้เอนไซม์จะเกิดได้ยากและช้ามาก แต่ถ้าเติมเอนไซม์ลงไปปฏิกิริยาก็จะเกิดขึ้นได้อย่างรวดเร็ว
ทั้งนี้เป็นเพราะเอนไซม์ไปช่วยให้มีการเกิดปฏิกิริยาแบบใหม่ที่มีค่า Ea ต่ำลง
โดยตัวของเอนไซม์ก็อาจมีส่วนร่วมในการเกิดปฏิกิริยาไปด้วย
แต่ในที่สุดก็จะแยกตัวออกมาอยู่ในรูปเอนไซม์ตามเดิมไม่ได้ไปรวมตัวอยู่ในผลิตภัณฑ์ เอนไซม์ไม่ได้ทำให้เกิดผลิตภัณฑ์มากขึ้น
ปริมาณของผลิตภัณฑ์จะได้เท่ากับการเกิดปฏิกิริยานั้น ๆ
โดยไม่มีเอนไซม์
แต่ช่วยลดเวลาเนื่องจากอัตราเร็วสูงขึ้น
พิจารณาจากกราฟต่อไปนี้
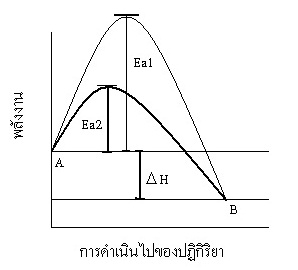
Ea1
=
พลังงานก่อกัมมันต์เมื่อไม่มีตัวเร่ง Ea2
= พลังงานก่อกัมมันต์เมื่อมีตัวเร่ง = พลังงานของปฏิกิริยา
** ตัวเร่งทำให้ค่า
Ea ลดลง แต่ ไม่เปลี่ยนแปลง
(คลิ้ก ชมผลของตัวเร่งที่มีต่อค่า Ea)
(คลิ้ก ชมผลของตัวเร่งต่อปฏิกิริยาดูดความร้อน) (คลิ้ก
ชมผลของตัวเร่งต่อปฏิกิริยาคายความร้อน)
5.
ตัวหน่วงปฏิกิริยาหรือตัวขัดขวาง (Inhibitor) เป็นสารที่มีผลต่ออัตราเร็วของปฏิกิริยาตรงกันข้ามกับสารตัวเร่ง คือทำให้เกิดปฏิกิริยายกขึ้นหรือมีค่า Ea สูงขึ้น
แต่ยังคงได้ผลิตภัณฑ์เท่าเดิมแต่ต้องใช้เวลามากกว่าเดิม เช่น
สารกันบูดในอาหาร ที่ช่วยยับยั้งปฏิกิริยาที่ทำให้เกิดการเน่าเสียของอาหาร เป็นต้น
6.
พื้นที่ผิวของสารตั้งต้น (surface)
กรณีนี้เกิดขึ้นเฉพาะปฏิกิริยาที่เกิดขึ้นกับสารตั้งต้นที่ไม่รวมตัวกันเป็นเนื้อเดียว หรือเรียกว่าปฏิกิริยาเนื้อผสม (Heterogeneous
reaction) เช่น
ของแข็งกับของเหลว
ของแข็งกับก๊าซ
ในกรณีนี้การเพิ่มพื้นที่ผิวของสารจะช่วยให้เกิดปฏิกิริยาเคมีเร็วขึ้น
เนื่องจากพื้นที่ผิวที่เพิ่มขึ้นจะทำโอกาสในการชนมีมากขึ้น วิธีทำให้ของแข็งมีพื้นที่ผิวมากขึ้นคือทำให้ของแข็งชิ้นใหญ่แยกออกเป็นชิ้นเล็ก
ๆ หลาย ๆ ชิ้น เช่น
การเคี้ยวอาหารให้ละเอียดก่อนกลืน จะช่วยทำให้อาหารมีขนาดเล็กลง พื้นที่ผิวเพิ่มมากขึ้น
จึงทำให้น้ำย่อยในระบบทางเดินอาหารสามารถเข้าย่อยอาหารได้ง่ายขึ้น เป็นต้น
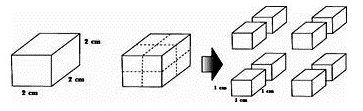
การเพิ่มพื้นที่ผิวของของแข็งโดยทำให้เป็นชิ้นเล็ก ๆ
7. ความดัน
(pressure) จะมีผลต่ออัตราเร็วของปฏิกิริยาของก๊าซเท่านั้น
แต่ต้องเป็นการเพิ่มความดันโดยการลดปริมาตรของก๊าซเท่านั้น
เนื่องจากการเพิ่มความดันจนปริมาตรลดลงจะทำให้โมเลกุลของแก๊สเข้าอยู่มาอยู่ใกล้ชิดกันมากขึ้น
จึงมีโอกาสชนกันและเกิดปฏิกิริยาเคมีมากขึ้น ซึ่งลักษณะนี้คล้ายกับการเพิ่มความเข้มข้นให้กับสารละลายนั่นเอง

(คลิ้ก
ทำการทดลองเสมือนจริง)
แบบฝึกหัด
1.
The rate of a reaction can be increased by four factors (list
them below):
(จงบอกชนิดของปัจจัยที่ทำให้อัตราเร็วของปฏิกิริยาเพิ่มขึ้นมา 4 ข้อ)
2. For each scenario
below, state which factor is being changed to alter the reaction rate.
(การกระทำที่กล่าวถึงในแต่ละข้อและผลของการกระทำที่มีต่ออัตราเร็วของปฏิกิริยาดังที่กล่าว เกิดจากปัจจัยใด)
(a) Firewood is
chopped into small pieces to make lighting a fire easier.
(ทำไม้ฟืนให้เป็นชิ้นเล็ก ๆ พบว่าติดไฟได้ง่ายขึ้น)
(b) A black powder called
manganese dioxide causes hydrogen peroxide to
decompose faster
than normal. The powder is not used up during the reaction.
(แมงกานีสไดออกไซด์ทำให้ไฮโดรเจนเปอร์ออกไซด์สลายตัวได้เร็วขึ้น โดยสารดังกล่าวไม่ได้หมดเปลืองไปในการทำ
ปฏิกิริยา)
(c) Food left in the
fridge lasts longer than food left out. (เมื่อเก็บอาหารเอาไว้ในตู้เย็นจะอยู่ได้นานกว่าเอาไว้
ข้างนอก)
(d) Coal dust can
cause explosions.
(ฝุ่นละอองของถ่านหินอาจเป็นเหตุให้เกิดการระเบิดได้)
(e) A 1cm piece of
magnesium ribbon takes longer to react and disappear in 20mL of 2 mol L-1 HCl
mixed with 20mL
water, than it does in 40mL of 2 mol L-1 HCl. (แผ่นแมกนีเซียมความยาว 1 cm ทำ
ปฏิกิริยากับสารละลาย HCl
ความเข้มข้น 2 mol L-1 ที่ผสมน้ำลงไป 20 mL
ต้องใช้เวลานานกว่าเมื่อทำปฏิกิริยา
กับสารละลาย HCl ความเข้มข้น
2 mol L-1 จำนวน
40 mL โดยไม่เติมน้ำ)
3. Explain what is meant by
the ACTIVATION ENERGY of a reaction. (พลังงานก่อกัมมันต์
คืออะไรจงอธิบาย)
4. Label the Activation
Energy (EA) on the energy profiles below.
(จงเขียนแสดงตำแหน่งของพลังงานก่อกัมมันต์ลงในแผนผังพลังงาน)
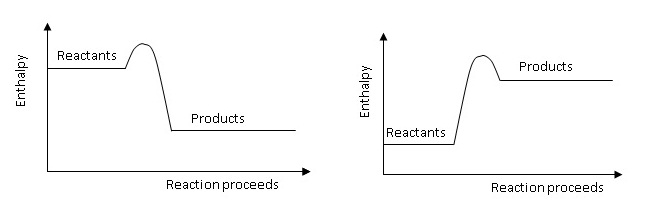
5. Use the collision theory to explain
the following observations: (จงใช้ทฤษฎีการชนอธิบายเหตุการณ์ในแต่ละข้อ)
(a) A piece of magnesium metal
burns faster in a jar of pure oxygen that in air.
(โลหะแมกนีเซียมเผาไหม้ในขวดซึ่งบรรจุก๊าซออกซิเจนบริสุทธิ์ได้เร็วกว่าการเผาไหม้ในอากาศ)
(b) In 2 mol L-1
HCl, iron wool produces hydrogen gas faster than an iron nail of the same mass.
(ฝอยเหล็กกับชิ้นเหล็กน้ำหนักเท่ากัน
เมื่อทำปฏิกิริยากับสารละลาย HCl ความเข้มข้น 2 mol L-1 พบว่าฝอยเหล็ก
เกิดปฏิกิริยาได้เร็วกว่า)
(c) Hydrogen peroxide
takes longer to decompose when it is left in the fridge.
(ไฮโดรเจนเปอร์ออกไซด์เมื่อเก็บไว้ในตู้เย็นจะสลายตัวช้า)
(d) A mixture of
petrol and oxygen does not combust until a spark is added.
(เชื้อเพลิงที่ผสมอยู่กับออกซิเจนยังไม่ติดไฟ จนกว่าจะได้รับประกายไฟ)
(e) Marble chips (calcium carbonate) react slowly
with ethanoic acid, whereas powdered calcium carbonate
reacts vigorously
with the same acid.
(หินปูนเป็นก้อน ๆ ทำปฏิกิริยากับกรดเอทาโนอิกได้ช้า แต่เมื่อบดเป็นผงแล้วให้
ทำปฏิกิริยากับกรดชนิดเดิมจะเกิดปฏิกิริยาได้เร็วกว่า)
6. Why does an increase in reactant concentration cause
an increase in reaction rate?
(เหตุใดการเพิ่มความเข้มข้นของสารตั้งต้นจึงทำให้อัตราเร็วของปฏิกิริยาเพิ่มขึ้น)
7. Explain why the rate of reaction increases when the
temperature is increased.
(เหตุใดอัตราเร็วของปฏิกิริยาจึงเพิ่มขึ้นเมื่อเพิ่มอุณหภูมิ)
8. What is an activated complex? (สารเชิงซ้อนกัมมันต์คืออะไร)
9. How does the activation energy of an uncatalyzed
reaction compare with that of the catalyzed reaction?
(ระหว่างปฏิกิริยาที่มีตัวเร่ง กับปฏิกิริยาที่ไม่มีตัวเร่ง จะมีพลังงานก่อกัมมันต์ต่างกันอย่างไร)
10. What is the effect of a catalyst on the net energy
change (H) of a reaction?
(ตัวเร่งมีผลต่อพลังงานของปฏิกิริยาอย่างไร)
11. For the reaction A + B è
C, the activation energy of
the forward reaction is 5 kJ and the total energy
change, H, is –20 kJ. Draw a potential energy graph representing this
reaction. What is the activation
energy (in kJ) of the reverse reaction?
(จากปฏิกิริยา A + B è C มีพลังงานก่อกัมมันต์
= 5 kJ
มีพลังงานของปฏิกิริยา ;H = –20 kJ จงเขียนกราฟแสดง
การเปลี่ยนแปลงพลังงานของปฏิกิริยา
และพิจารณาด้วยว่าปฏิกิริยาย้อนกลับมีค่าพลังงานก่อกัมมันต์เท่าไร)
รูปภาพที่เกี่ยวข้อง

Size : 36.63 KBs
Upload : 2014-08-09 05:39:39
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|