ของแข็ง ของเหลว แก๊ส (ตอนที่ 10 ) แก๊สสมบูรณ์แบบ (Perfect gas) หรือแก๊สในอุดมคติหรือแก๊สสมมติ (Ideal gas)
แก๊สสมบูรณ์แบบ (Perfect gas) หรือแก๊สในอุดมคติหรือแก๊สสมมติ (Ideal gas)
ถ้าแก๊สมีสมบัติต่าง ๆ ดังที่กล่าวไว้ในทฤษฏีจลน์ของแก๊สทุกข้อ ก็หมายความว่ามีสมบัติเป็นแก๊สอย่างแท้จริง มีความเป็นแก๊สอย่างสมบูรณ์แบบทุกประการ แต่ความจริงแล้วไม่มีแก๊สชนิดใดที่จะมีสมบัติครบถ้วนอย่างนั้น แก๊สที่จะมีสมบัติดังที่ทฤษฎีจลน์ของแก๊สกล่าวไว้จึงไม่มีอยู่จริง แก๊สที่จะมีสมบัติอย่างนั้นจึงเป็นแก๊สในอุดมคติ (Ideal gas) เท่านั้น
แก๊สจริง (Real gas) คือแก๊สทุกชนิดทั้งที่มีอยู่ในโลกและนอกโลก แก๊สเหล่านี้มีสมบัติต่าง ๆ เทียบเคียงกับสมบัติตามทฤษฎีจลน์ของแก๊สได้แต่ไม่ทั้งหมด เรียกว่ามีสมบัติเบี่ยงเบนไปจากทฤษฎีจลน์ของแก๊สมากบ้างน้อยบ้าง แต่อย่างไรก็ตามถ้าแก๊สจริงอยู่ในภาวะที่อุณหภูมิสูงความดันต่ำ ก็จะมีสมบัติเป็นไปตามตามทฤษฎีจลน์ของแก๊สได้มากขึ้น หรือมีสมบัติใกล้เคียงกับความเป็นแก๊สสมบูรณ์แบบมากขึ้น
ถ้าอนุโลมว่าแก๊สจริงมีสมบัติเป็นแก๊สสมบูรณ์แบบ แก๊สทุกชนิดก็จะมีสมบัติเหมือนกันทุกประการ ฉะนั้นแก๊สใด ๆ จำนวน 1.00 โมล ที่ STP จะมีสมบัติเหมือนกันได้แก่
n = 1 mol
P = 1 atm
T = 273 K
V = 22.4 dm3
หาอัตราส่วนระหว่าง PV : nT ดังนี้
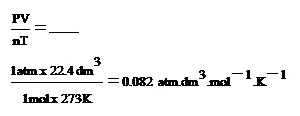
** ค่า 0.082 เป็นค่าคงที่ของแก๊ส ใช้สัญลักษณ์เป็นตัว R เมื่อเขียนลงในสมการจะเป็นดังนี้

สมการ PV = nRT เรียกว่าสมการแก๊สสมบูรณ์แบบ (Perfect gas law equation) หรือสมการแก๊สสมมติ (Ideal gas law equation) ใช้คำนวณสมบัติของแก๊สแทนกฎของบอยล์ ชาร์ลและกฎอื่น ๆ ของแก๊สได้แต่ต้องใช้หน่วยให้ถูกต้อง ได้แก่
P ต้องใช้หน่วย atm
V ต้องใช้หน่วย dm3
T ต้องใช้หน่วย เคลวิน , K
R เป็นค่าคงที่ของแก๊ส = 0.082 atm.dm3.mol-1.K-1
*** วิชาฟิสิกส์ใช้ R = 8.314 J.mol-1.K-1
(คลิ้ก ชมการอธิบายสมการแก๊สสมบูรณ์แบบ) (คลิ้ก ชมการแสดงการใช้สมการแก๊สสมบูรณ์แบบ)
ตัวอย่าง ใช้ Mg จำนวน 1.00 โมล ทำปฏิกิริยากับสารละลายกรด HCl ซึ่งมากเกินพอ เกิดปฏิกิริยาดังสมการ : Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
- ถ้าทดลองที่ภาวะ STP จะได้ H2 กี่ dm3
- ถ้าทดลองที่อุณหภูมิ 27 oC ความดัน 0.80 atm จะได้ H2 กี่ dm3
วิธีทำ จากสมการ ; จำนวนโมลของ H2 ที่ได้ = จำนวนโมลของ Mg ที่ใช้
= 1.00 โมล
- ถ้าทดลองที่ภาวะ STP ปริมาตรของ H2 จะได้ = 1.00 x 22.4 = 22.4 dm3 ตอบ
- ถ้าทดลองที่อุณหภูมิ 27 oC ความดัน 0.80 atm จะได้ H2 กี่ dm3 คิดได้จากสมการแก๊สสมมติ

แบบฝึกหัด
1. A 10.3 L cylinder contains 756.2 grams of Cl2 at 21.2oC. How many grams of chlorine must be
released to reduce the pressure to 22.4 atm assuming ideal gas behavior? (Atomic weight: Cl =
35.45). (ans.c) (กระบอกสูบมีปริมาตร 10.3 L บรรจุแก๊ส Cl2 เอาไว้ 756.2 กรัม อุณหภูมิ 21.2oC ถ้า
ต้องการทำให้ความดันลดลงเหลือ 22.4 atm จะต้องปล่อยแก๊ส Cl2 ออกไปกี่กรัม สมมติว่าแก๊สคลอรีนมี
สมบัติเป็น ideal gas)
a) 69.5 b) 21.2 c) 79.0 d) 44.2 e) 15.2
2. The pressure of argon in an incandescent light bulb is 0.49 atm at 25oC. If a 150 watt bulb has a
volume of 182 cm3, how many grams of argon are in the bulb? (Atomic weight: Ar = 39.95).
(ans.c) (ความดันของแก๊สอาร์กอนในหลอดไฟฟ้าเท่ากับ 0.49 atm ที่อุณหภูมิ 25oC ถ้าปริมาตรของ
หลอดไฟคือ 182 cm3 แก๊สอาร์กอนในหลอดไฟดังกล่าวหนักกี่กรัม)
a) 0.060 b) 0.082 c) 0.15 d) 0.18 e) 0.10
3. How many nanograms of helium exist in a 250 mL container at 1.5 x 10-8 torr and 1200oC?(Atomic
weight: He = 4.00). (ans.c) (แก๊สฮีเลียม 250 mL ความดัน 1.5 x 10-8 torr อุณหภูมิ 1200oC แก๊ส
จำนวนนี้มีมวลกี่นาโนกรัม)
a) 3.3 x 10-3 b) 2.2 x 10-4 c) 1.6 x 10-4 d) 1.6 x 10-1 e) 2.2 x 10-2
4. A 25 L cylinder contains 128 g of nitrogen gas at 10oC. How many grams of nitrogen must be
added to increase the pressure to 5.00 atm assuming ideal gas behavior? (Atomic weight: N =
14.01).(ans.a) (กระบอกสูบมีปริมาตร 25 L บรรจุแก๊สไนโตรเจน 128 กรัม อุณหภูมิ 10oC ถ้าต้องการทำ
ให้ความดันเพิ่มขึ้นเป็น 5.00 atm จะต้องเติมแก๊สไนโตรเจนเข้าไปกี่กรัม)
a) 22.7 b) 12.5 c) 25.4 d) 18.9 e) 15.9
5. A 65.0 L gas cylinder at 5.1 atm and 20oC contains only nitrogen gas. What is the mass (in
grams) of the nitrogen in the tank? (Atomic weight: N = 14.01).(ans.a) (กระบอกมีปริมาตร 65.0 L
บรรจุแก๊สไนโตรเจน มีความดัน 5.1 atm อุณหภูมิ 20oC อยากทราบว่าแก๊สดังกล่าวนี้หนักกี่กรัม)
a) 3.9 x 102 b) 1.8 x 102 c) 2.5 x 102 d) 3.4 x 102 e) 2.2 x 102
6. The energy provided by 1 gallon of gasoline could be obtained from 655 g of CH4. What volume
(L) of methane would be required at 25oC and 745 torr? (Atomic weights: C = 12.01, O = 16.00, H
= 1.008). (น้ำมันแก๊สโซลีน 1 แกลลอน สามารถผลิตได้จากแก๊ส CH4 655 g แก๊ส CH4 ดังกล่าวนี้มี
ปริมาตรกี่ลิตร ที่อุณหภูมิ 25oC ความดัน 745 torr )
a) 9.24 x 102 b) 1.21 x 103 c) 1.02 x 103 d) 1.21 x 104 e) 8.62 x 102
7. A barge on the Ohio river contains 625 tons of liquid chlorine under pressure. What volume (m3)
would the chlorine occupy at 730 torr and 20oC? (Atomic weight: Cl = 35.45). (เรือลำหนึ่งบรรจุแก๊ส
คลอรีนเหลว 625 ตัน ถ้าแก๊สคลอรีนจำนวนนี้อยู่ที่ความดัน 730 torr อุณหภูมิ 20oC จะมีปริมาตรกี่ m3 )
a) 5.00 x 104 b) 1.00 x 105 c) 2.00 x 105 d) 2.00 x 103 e) 1.00 x 103
8. A balloon is filled with 48.3 g of helium at 31oC and 2.12 atm. What is the volume of the balloon in
liters? (Atomic weight: He = 4.00). (บัลลูนลูกหนึ่งบรรจุแก๊สฮีเลียม 48.3 กรัม ที่อุณหภูมิ 31oC ความ
ดัน 2.12 atm บัลลูนมีปริมาตรกี่ลิตร)
a) 271 b) 142 c) 129 d) 301 e) 176
9. A 40.0 gram sample of helium is introduced into a 2.24 L cylinder which is heated until the
pressure is 200 atm. What is the temperature (in oC) of the gas? (Atomic weight: He = 4.00). (แก๊ส
He หนัก 40.0 กรัม บรรจุในกระบอกมีปริมาตร 2.24 L เมื่อให้ความร้อนจนมีความดัน 200 atm
อยากทราบว่าอุณหภูมิของแก๊สเป็นกี่องศาเซลเซียส)
a) 221 b) 452 c) 323 d) 546 e) 273
10. A 162 L drum used for crude oil is steam cleaned. Assuming ideal gas behavior, calculate the
number of moles of water required to fill the barrel at 1.00 atm if the steam is at 110oC. (Atomic
weights: H = 1.008, O = 16.00). (ans.c) (ถังสำหรับบรรจุน้ำมันดิบขนาด 162 ลิตร ต้องการล้างถังนี้
ด้วยไอน้ำ ที่ความดัน 1.00 atm อุณหภูมิ 110 oC จะต้องใช้น้ำกี่โมล)
a) 4.75 b) 7.23 c) 5.15 d) 4.22 e) 6.42
11. A pressure of 0.10 torr is obtained using a vacuum pump. Calculate the number of moles in 1.0
mL of gas at this pressure at 20oC. (ans.c) (ปั๊มสุญญากาศมีความดัน 0.10 torr อุณหภูมิ 20oC
อยากทราบว่าแก๊ส 1.0 mL มีจำนวนโมลของแก๊สกี่โมล)
a) 5.1 x 10-6 b) 3.3 x 10-8 c) 5.5 x 10-9 d) 5.1 x 10-9 e) 5.5 x 10-6
12. The Goodyear blimp has 5.12 x 106 liters of helium at 25oC and 1.00 atm. How many moles of
helium are in the blimp?(Atomic weight: He = 4.00). (ans.c) (เรือเหาะมีปริมาตร 5.12 x 106 liters
บรรจุแก๊สฮีเลียมเอาไว้ที่อุณหภูมิ 25oC ความดัน 1.00 atm จงหาจำนวนโมลของแก๊สฮีเลียม)
a) 2.09 x 102 b) 2.58 x 105 c) 2.09 x 105 d) 2.58 x 102 e) 3.32 x 104
13. The Goodyear blimp has 5.1 x 106 liters of helium at 25oC and 1.00 atm. How many molecules of
helium are in the blimp? (Atomic weight: He = 4.00). (ans.b) ((เรือเหาะมีปริมาตร 5.12 x 106 liters
บรรจุแก๊สฮีเลียมเอาไว้ที่อุณหภูมิ 25oC ความดัน 1.00 atm จงหาจำนวนโมเลกุลของแก๊สฮีเลียม)
a) 2.6 x 1027 b) 1.3 x 1029 c) 2.9 x 1029 d) 2.6 x 1028 e) 1.3 x 1028
14. An oxygen sample has a volume of 4.50 L at 27oC and 800.0 torr. How many oxygen molecules
does it contain? (Atomic weight: O = 16.00). (ans.b) (แก๊สออกซิเจนตัวอย่างมีปริมาตร 4.50 ลิตร
อุณหภูมิ 27 oC จงหาจำนวนโมเลกุลของแก๊สออกซิเจนจำนวนนี้)
a) 2.32 x 1024 b) 1.16 x 1023 c) 5.8 x 1023 d) 5.8 x 1022 e) 1.16 x 1022
15. How many molecules of helium exist in a 250 mL container at 1.5 x 10-8 torr and 1200oC?
(Atomic weight: He = 4.00). (ans.b) (จงหาจำนวนโมเลกุลของแก๊สฮีเลียมซึ่งมีปริมาตร 250 mL ความ
ดัน 1.5 x 10-8 torr อุณหภูมิ 1200oC)
a) 2.5 x 1012 b) 2.5 x 1010 c) 1.9 x 1013 d) 2.3 x 1013 e) 3.0 x 1010
16. Calculate the density, g/L, of Freon-12, CF2Cl2 at STP. (Atomic weights: C = 12.01, F = 19.00,
Cl = 35.45). (ans.c) (จงหาความหนาแน่นของแก๊สฟรีออน-12 ( g/L ) CF2Cl2 ที่ STP.
a) 4.98 b) 3.80 c) 5.39 d) 6.14 e) 4.35
17. What is the density (g/L) of nitrogen at STP? (Atomic weight: N = 14.01). (ans.c) (แก๊สไนโตรเจนที่
STP มีความหนาแน่นกี่กรัม/ลิตร)
a) 0.800 b) 0.312 c) 1.25 d) 1.60 e) 0.625
18. What is the density (g/L) of pure oxygen gas at STP? (Atomic weight: O = 16). (ans.c) (แก๊ส
ออกซิเจนบริสุทธิ์ ที่ STP มีความหนาแน่นกี่กรัม/ลิตร)
a) 1.52 b) 1.12 c) 1.43 d) 1.34 e) 1.24
19. What is the density in g/L of BrF3 at 425 torr and 77oC? (Atomic weights: Br = 79.90, F = 19.00).
(ans.c) (แก๊ส BrF3 ที่ความดัน 425 torr อุณหภูมิ 77oC มีความหนาแน่นกี่กรัม/ลิตร)
a) 2.24 b) 1.92 c) 2.66 d) 1.72 e) 1.33
20. Calculate the density (g/L) of Freon-12, CF2Cl2 at 30.0oC and 0.954 atm.
(Atomic weights: C = 12.01, F = 19.00, Cl = 35.45). (ans.c) (แก๊สฟรีออน-12 มีสูตรโมเลกุล CF2Cl2
อุณหภูมิ 30.0oC ความดัน 0.954 atm มีความหนาแน่นกี่กรัม/ลิตร)
a) 6.14 b) 7.58 c) 4.64 d) 3.80 e) 5.22
21. What is the density (g/L) of carbon dioxide at 30.3oC and 744 mm Hg?
(Atomic weights: C = 12.01, O = 16.00). (ans.c) (แก๊สคาร์บอนไดออกไซด์ที่อุณหภูมิ 30.3oC ความ
ดัน 744 mm Hg มีความหนาแน่นกี่กรัม/ลิตร)
a) 1.61 b) 1.42 c) 1.73 d) 1.28 e) 1.85
22. A scientist in a mountain kingdom decides to define 20oC and 700 mm Hg as standard
conditions. What is the molar volume (L) that students will learn in the kingdom? (ans.c)
(ถ้านักวิทยาศาสตร์ในอาณาจักรแห่งหุบเขา กำหนดให้ภาวะมาตรฐานของแก๊สอยู่ที่อุณหภูมิ 20 oC
ความดัน700 mm Hg อยากทราบว่าปริมาตรต่อโมลของแก๊สเป็นกี่ลิตรต่อโมล)
a) 24.3 b) 22.4 c) 26.1 d) 25.4 e) 20.6
23. The pressure on the surface of Venus is 90.0 atm and the temperature is 475oC. What is the
molar volume (L) that Venusian chemistry students will learn? (ans.c) (ความดันบนพื้นผิวดาวพุธคือ
90.0 atm และมีอุณหภูมิ 475oC อยากทราบว่านักเรียนที่เรียนเคมีบนดาวพุธ ต้องใช้ปริมาตร/โมลของ
แก๊สเป็นกี่ลิตร)
a) 22.4 b) 0.942 c) 0.682 d) 8.18 e) 0.248
24. The surface atmospheric pressure on Mars is 4.6 mm Hg. At high noon the surface temperature
is about 20oC. What is the molar volume (L) that Martian chemistry students will learn? (ans.c)
(ถ้าความดันบรรยากาศที่พื้นผิวของดาวอังคารคือ 4.6 mm Hg และมีอุณหภูมิ 20oC อยากทราบว่า
นักเรียนที่เรียนเคมีอยู่บนดาวอังคารจะคิดปริมาตรต่อโมลของแก๊สได้กี่ลิตร)
a) 3.70 x 103 b) 24.0 c) 3.97 x 103 d) 22.4 e) 2.40 x 103
25. Four identical 1.0 L flasks contain the following gases each at 0oC and 1 atm pressure. Which
gas has the most molecules? (Atomic weights: H = 1.008,Cl = 35.45, N = 14.01, C = 12.01).
(ans.c) (แก๊สในแต่ข้อต่อไปนี้เมื่อมีปริมาตร 1.0 ลิตร อุณหภูมิ 0 oC ความดัน 1 atm เท่ากัน ชนิดใดมี
จำนวนโมเลกุลมากที่สุด)
a) Cl2 b) NH3 c) all gases are the same d) CH4 e) HCl
26. Five identical 1.0 L flasks contain the following gases each at 0oC and 1 atm pressure. Which
gas has the lowest density?(Atomic weights: H = 1.008, Cl = 35.45, N = 14.01, C = 12.01).
(ans.c) (แก๊สแต่ละชนิดต่อไปนี้เมื่อมีปริมาตร 1.0 ลิตร อุณหภูมิ 0oC ความดัน 1 atm ชนิดใดจะมีความ
หนาแน่นต่ำสุด)
a) NH3 b) Cl2 c) CH4 d) C2H4 e) HCl
27. A molecular element weighing 3.24 x 10-2 g at 550oC in a 56.0 mL bulb has a pressure of 239.2
mm Hg. What is the molecular weight of the gas? (ans.a) (แก๊สชนิดหนึ่งมีน้ำหนัก 3.24 x 10-2 g ที่
อุณหภูมิ 550oC มีปริมาตร 56.0 mL และมีความดัน 239.2 mm Hg จงหามวลโมเลกุลของแก๊สนี้)
a) 124 b) 136 c) 104 d) 92 e) 116
28. The density of a gaseous element at 310oC and 775 mm Hg is 2.64 g/L. What is the molecular
weight of the element? (ans.a) (แก๊สชนิดหนึ่งมีความหนาแน่น 2.64 g/L ที่อุณหภูมิ 310oC ความดัน
775 mm Hg แก๊สดังกล่าวนี้มีมวลโมเลกุลเท่าไร)
a) 124 b) 84 c) 114 d) 93 e) 106
29. At 900oC and 25 torr, the density of a certain element in the gaseous state is 1.33 x 10-2 g/L.
Using the atomic weights given in parenthesis, determine the identity of the element. (ans.a)
(แก๊สชนิดใดตามที่กำหนดให้ต่อไปนี้ มีความหนาแน่น 1.33 x 10-2 g/L ที่อุณหภูมิ At 900 oC ความดัน
25 torr จงใช้มวลอะตอมตามที่กำหนดให้ในวงเล็บมาคิด)
a) K(39) b) Na(23) c) Rb(85.5) d) Hg(201) e) Ne(20)
30. A 1.00 g sample of SFx has a volume of 416 mL at 745 mm Hg and 75oC. What is the value of x?
(Atomic weights: S = 32.06, F = 19.00). (ans.e) (แก๊ส SFx จำนวน 1.00 กรัม มีปริมาตร 416 mL มี
ความดัน 745 mm Hg และ 75 oC อยากทราบว่า x มีค่าเท่าไร
a) 4 b) 1 c) 3 d) 6 e) 2
31. Carbon forms a number of fluorocarbons several of which are listed below. For which compound
would a 0.400 g sample occupy 159 cm3 at 75oC and 0.640 atm? (Atomic weights: C = 12.01, F
= 19.00). (ans.e) (สารประกอบฟลูออโรคาร์บอนมีหลายชนิดดังแสดงในแต่ละข้อ อยากทราบว่าชนิดใด
เมื่อนำมา 0.40 กรัม จะมีปริมาตร 159 cm3 ที่อุณหภูมิ 75oCและความดัน 0.640 atm)
a) CF4 b) C3F6 c) C2F4 d) C2F6 e) C3F4
รูปภาพที่เกี่ยวข้อง

Size : 3.40 KBs
Upload : 2014-02-13 22:23:22
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|