ของแข็ง ของเหลว แก๊ส (ตอนที่ 4 ) สมบัติของแก๊ส
สมบัติของแก๊ส
เมื่อสารมีสถานะเป็นแก๊สจะมีแรงยึดเหนี่ยวระหว่างอนุภาคน้อยมาก อนุภาคจึงฟุ้งกระจายจนเต็มภาชนะที่บรรจุตลอดเวลา ไม่ว่าจะมีขนาดเท่าไร ปริมาตรและรูปร่างของแก๊สจึงไม่แน่นอน
เปลี่ยนแปลงไปตามรูปทรงของภาชนะที่บรรจุ ไม่ว่าภาชนะจะมีปริมาตรเท่าไรแก๊สที่บรรจุเอาไว้ในภาชนะดังกล่าว จะมีปริมาตรเท่ากับความจุของภาชนะใบนั้นเสมอ สมบัติเบื้องต้นของแก๊สที่เห็นได้ชัดเจนได้แก่
- ถ้าแก๊สมีจำนวนโมลและอุณหภูมิคงที่ เมื่อเพิ่มความดันปริมาตรของแก๊สจะลดลง
- ถ้าแก๊สมีจำนวนโมลและความดันคงที่ เมื่อเพิ่มอุณหภูมิปริมาตรของแก๊สจะเพิ่มขึ้น
- ถ้าแก๊สมีจำนวนโมลและปริมาตรคงที่ เมื่อเพิ่มอุณหภูมิความดันของแก๊สจะเพิ่มขึ้น
- ถ้าแก๊สมีอุณหภูมิและความดันคงที่ เมื่อเพิ่มจำนวนโมลของแก๊สจะทำให้ปริมาตรของแก๊สเพิ่มขึ้น
(คลิ้ก ชมสมบัติเบื้องต้นของแก๊ส)
ทฤษฎีจลน์ของแก๊ส ( The Kinetic Theory of Gases )
การที่แก๊สมีสมบัติต่าง ๆ ดังที่ทราบมานั้น สิ่งที่ใช้ในการอธิบายว่าเหตุใดแก๊สจึงมีสมบัติเหล่านั้นก็คือ ทฤษฎีจลน์ของแก๊ส ดังนี้
1. แก๊สประกอบด้วยโมเลกุลที่มีขนาดเล็กมากจำนวนมาก อยู่ห่างกันมาก เมื่อเปรียบเทียบระหว่างขนาดของอนุภาคกับระยะห่างระหว่างอนุภาคแล้วเสมือนหนึ่งอนุภาคของแก๊สเป็นสิ่ง
ว่างเปล่า (A gas is composed of a large number of tiny particles which are so small that their sizes are negligible compared to the average distances between them, ie, most
of the volume of a gas is just empty space. )
2. แต่ละโมเลกุลของแก๊สเคลื่อนที่เป็นแนวตรงอยู่ตลอดเวลา ไม่จำกัดทิศทาง ด้วยอัตราเร็วคงที่ จนกว่าจะชนกันเอง หรือชนผนังภาชนะที่บรรจุ จะมีการถ่ายเทพลังงานจลน์ แต่จะไม่มีการ
สูญเสียพลังงานจลน์รวม เพราะเป็นการชนแบบยืดหยุ่น (elastic collision) )
(Gas particles are in constant, random, straight-line motion, colliding with each other and the walls of the container. All collisions are elastic, there is no net loss or gain of
kinetic energy at each collision. )
3. แต่ละโมเลกุลของแก๊สเคลื่อนที่ได้อย่างอิสระโดยไม่มีแรงกระทำต่อกัน (ไม่ดึงดูดกันและไม่ผลักกัน) ทฤษฎีจลน์ของแก๊สอาศัยสมมิฐานดังกล่าวมานี้ (Gas particles move independently
of each other, there are no forces of attraction or repulsion between them. The kinetic theory of gases is based on the following assumptions: )
4. ในสภาวะหนึ่ง ๆ โมเลกุลของแก๊สแต่ละโมเลกุลจะมีอัตราเร็วในการเคลื่อนที่และพลังงานจลน์แตกต่างกันเป็นช่วงกว้าง แต่เมื่อคิดเป็นพลังงานจลน์เฉลี่ยแล้วจะเท่ากัน คือ K.E. = 1/2MV2
และแปรผันตรงกับอุณหภูมิเคลวิน (K)
เมื่อ v = อัตราเร็วในการเคลื่อนที่ของโมเลกุล
m = มวลโมเลกุลของแก๊ส
* แก๊สที่มีสมบัติตรงตามทฤษฎีจลน์ของแก๊สเรียกว่า ideal gas คือแก๊สในทางสมมติหรือเป็นแก๊สในอุดมการณ์ ที่จะมีสมบัติตรงตามทฤษฎีจลน์ของแก๊สทุกข้อทุกประการ แต่สำหรับแก๊สที่มี
อยู่จริง ๆ จะมีสมบัติบางอย่างที่ไม่ตรงกับทฤษฎีจลน์ของแก๊สอย่างแท้จริง ทำให้มีสมบัติเบี่ยงเบนไปจากทฤษฎีจลน์ของแก็สได้)
(At any given instant there is a wide range of particle speeds and therefore a wide range of molecular kinetic energies, however, the average kinetic energy of all the gas particles is proportional to the absolute temperature (temperature in kelvin).
The kinetic energy, Ek or K.E, of a single gas particle is Ek = ½mv2
where m = mass of gas particle and V = speed of gas particle
Gases will deviate from ideal gas behaviour if one or more of these assumptions does not apply )
(คลิ้ก ชมทฤษฎีจลน์ของแก๊ส)
อุณหภูมิเคลวิน (อุณหภูมิสมบูรณ์ , Absolute temperature)
ก่อนหน้านี้เชื่อว่าทุกคนย่อมรู้จักอุณหภูมิเซลเซียส ฟาเรนไฮด์หรืออื่น ๆ มาแล้ว และควรทราบว่าอุณหภูมิมีความสัมพันธ์กับพลังงานความร้อน พิจารณาที่วัตถุเดียวกัน เมื่ออุณหภูมิสูงก็แสดงว่า
มีความร้อนอยู่มากกว่าเมื่ออุณหภูมิต่ำ ฉะนั้นถ้าเราดูดความร้อนออกจากวัตถุใด ๆ วัตถุนั้นก็จะมีอุณหภูมิลดลง เช่น น้ำ ถ้านำมาดูดความร้อนออกไปจนอุณหภูมิลดลงเหลือ 0 oC น้ำก็เปลี่ยนสถานะเป็น
น้ำแข็งโดยมีอุณหภูมิ 0 oC เช่นกัน แต่ความร้อนยังไม่หมดเพราะยังสามารถดูดความร้อนออกมาจากน้ำแข็งได้อีก ทำให้อุณหภูมิลดลงไปอีกจนมีค่าเป็นลบ เช่น น้ำแข็งมีอุณหภูมิ -10 oC
ฉะนั้นวัตถุที่มีอุณหภูมิ 0 oC จึงยังมีความร้อนอยู่ในวัตถุนั้น เลข 0 แบบนี้เรียกว่าศูนย์สัมพัทธ์ (relative zero)
William Thomson (ชื่อเดิม Load Kelvin ,คลิ้ก อ่านประวัติของเขา) เป็นผู้ค้นพบระบบอุณหภูมิแบบใหม่ที่เริ่มต้น 0 องศา จากภาวะที่วัตถุไม่มีความร้อนเหลืออยู่เลย เลข 0 ของอุณหภูมิ
ระบบนี้จึงเป็นเลขศูนย์แท้ (absolute zero) ทำให้เรียกอุณหภูมิระบบนี้ว่าอุณหภูมิสมบูรณ์ (absolute temperature) แต่คนทั่ว ๆ ไปจะเรียกว่าอุณหภูมิเคลวิน ( K ) การบอกอุณหภูมิตามระบบนี้ไม่ต้อง
ใช้คำว่าองศา
ภาวะที่วัตถุไม่มีความร้อนเหลืออยู่เลยอยู่ที่อุณหภูมิ -273.15 oC ซึ่งความจริงยังทำไม่ได้ แต่ทราบได้ด้วยการทดลองหาความสัมพันธ์ระหว่างอุณหภูมิกับปริมาตรของแก๊ส คือพบว่าแก๊สที่มี
จำนวนโมลและความดันคงที่ ถ้าลดอุณหภูมิจะทำให้ปริมาตรของแก๊สลดลง อุณหภูมิยิ่งลดลงปริมาตรของแก๊สจะยิ่งเหลือน้อยลงไปตามลำดับ จินตนาการว่าเมื่อปริมาตรของแก๊สลดลงจนเหลือ 0.00 หน่วย ก็หมายความว่าเป็นจุดที่อุณหภูมิลดลงจนต่ำที่สุดแล้ว เพราะทำให้ปริมาตรของแก๊สลดลงจนไม่มีเหลือแล้ว อุณหภูมิจึงลดลงไปจนต่ำกว่านี้อีกไม่ได้ การที่ลดอุณหภูมิลงไปอีกไม่ได้ย่อมแสดงว่าไม่มีความร้อนเหลืออยู่ในวัตถุที่จะดูดออกมาได้อีกแล้ว หรือจะเรียกว่าปริมาณความร้อนในวัตถุมี = 0 หน่วย แปลว่าไม่มีเลย เลข 0 แบบนี้จึงเป็นศูนย์แท้ (absolute zero)
กำหนดให้จุดนี้เป็นจุดเริ่มต้นของอุณหภูมิเคลวิน เรียกว่า 0 เคลวิน หรือ 0 K (ไม่เขียน 0 oK ) การทดลองที่ทำให้ทราบว่า 0 K อยู่ที่ -273.15 oC คือใช้แก๊สที่มีจำนวนโมลและความดันคงที่
มาหาความสัมพันธ์ระหว่างอุณหภูมิกับปริมาตรของแก๊สนั้น พบว่าปริมาตรแปรผันตรงกับอุณหภูมิ เมื่อลดอุณหภูมิลงไปตามลำดับ ปริมาตรของแก๊สก็ลดลงตามลำดับเช่นเดียวกัน บันทึกผลการทดลองเอาไว้อย่างดี แต่ความสามารถของมนุษย์ที่จะลดอุณหภูมิให้ต่ำลงนั้นมีจำกัด เมื่อทดลองจนถึงจุดที่ไม่สามารถลดอุณหภูมิให้ต่ำลงได้อีกแล้วจึงนำผลการทดลองช่วงที่ทำได้มาเขียนกราฟ (ดูกราฟด้านล่าง) แสดงความสัมพันธ์ระหว่างอุณหภูมิ (แกนนอน) กับปริมาตรของแก๊ส (แกนตั้ง) จากนั้นต่อเส้นกราฟจากจุดสิ้นสุดของที่ทดลองได้ให้ยาวออกไปตามแนวเดิม (สังเกตเส้นประ) เส้นกราฟส่วนที่ต่อออกไปจะตัดแกนนอนที่อุณหภูมิ -273.15 oC ซึ่งเป็นจุดที่ปริมาตรของแก๊สลดลงเหลือ 0.00 หน่วยพอดี ก็หมายความว่าจะไม่มีอุณหภูมิที่ต่ำไปกว่านี้อีกแล้ว หรืออีกนัยหนึ่งก็คือความร้อนหมดไปแล้ว จึงทำให้ปริมาตรของแก๊สลดลงจนไม่มีเหลืออีกแล้ว ฉะนั้น วัตถุ ณ อุณหภูมิดังกล่าวจะไม่มีพลังงานใด ๆ เหลืออยู่เลย พลังงานจลน์ก็ไม่มี จึงหยุดนิ่งอย่างแท้จริงแม้การสั่นสะเทือนก็ไม่มี อิเล็กตรอนก็จะหยุดนิ่งเช่นกันที่ภาวะนี้ ดังรูป
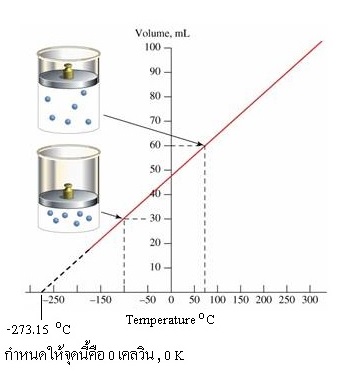
การที่วัตถุไม่มีพลังงานใด ๆ เหลืออยู่เลยดังกล่าวมานี้ก็หมายความว่ามีพลังงานเป็นศูนย์ จึงกำหนดให้จุดนี้เป็นจุดเริ่มต้นของอุณหภูมิสมบูรณ์ หรือที่เรียกกันว่าอุณหภูมิเคลวิน ( K ) ตามชื่อของ
Load Kelvin ดังรูป
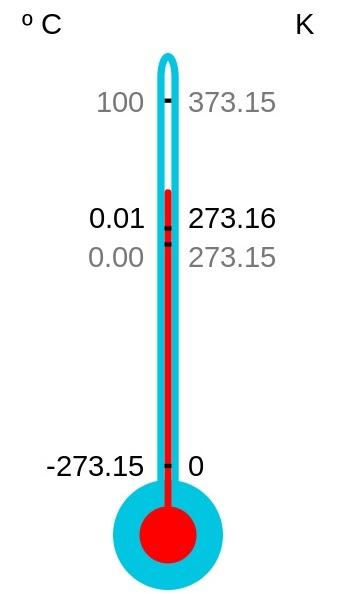
** การคิดคำนวณด้วยกฎต่าง ๆ ของแก๊ส ต้องใช้อุณหภูมิเคลวินเสมอ ช่องสเกลของอุณหภูมิเคลวินกับเซลเซียสห่างเท่ากัน ให้สังเกตว่าระหว่าง 0 oC กับ 0 K จะห่างกัน 273.15 ช่อง
หรือจะใช้เป็นจำนวนเต็มว่า 273 ช่องก็ได้ การเปลี่ยนค่าระหว่าง oC กับ K จึงเป็นดังนี้
K = oC + 273
oC = K - 273
การเปรียบเทียบระหว่างอุณหภูมิฟาเรนไฮด์ เซลเซียสและเคลวินเป็นดังรูป
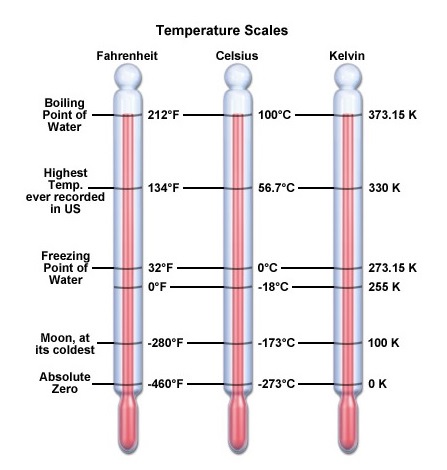
(คลิ้ก ชมอุณหภูมิเคลวิน)
|
สูตรการแปลงอุณหภูมิ
|
|
แปลงจาก
|
ไปเป็น
|
สูตร
|
|
เคลวิน
|
องศาเซลเซียส
|
°C = K - 273.15
|
|
องศาเซลเซียส
|
เคลวิน
|
K = °C + 273.15
|
|
เคลวิน
|
องศาฟาเรนไฮต์
|
°F = K (1.8 − 459.67)
|
|
องศาฟาเรนไฮต์
|
เคลวิน
|
K = (°F + 459.67) / 1.8
|
หมายเหตุ อุณหภูมิต่ำสุดที่มนุษย์ทดลองได้อยู่ที่ 100 พิโคเคลวิน ( 100 pK, หรือ 0.000 000 000 1 )
(คลิ้ก อ่านเพิ่มเติม)
รูปภาพที่เกี่ยวข้อง

Size : 25.08 KBs
Upload : 2014-02-12 21:19:36
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|