ธาตุกัมมันตรังสี
ธาตุกัมมันตรังสี (Radioactive elements.)
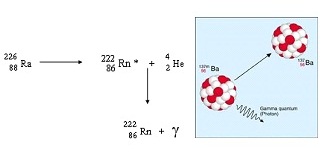
ในปี พ.ศ. 2439 อองตวน อองรี แบ็กเกอเรล (Antoine Henri Becquerel) (คลื้กชมภาพ) นักวิทยาศาสตร์ชาวฝรั่งเศส พบว่าแผ่นฟิล์มถ่ายรูปที่มีกระดาษดำห่อหุ้มอยู่ และเก็บรวมกับสารประกอบของยูเรเนียม มีลักษณะเหมือนถูกแสง จึงทดสอบกับสารประกอบของยูเรเนียมชนิดอื่นๆ พบว่าให้ผลการทดลองเช่นเดียวกัน แบ็คเกอเรลจึงสรุปในเบื้องต้นว่า มีการแผ่รังสีออกมาจากธาตุยูเรีเนียม ต่อมาปีแอร์ กูรี (Pierre Curie) (คลิ้กชมภาพ) และมารี กูรี (marie Curie) (คลิ้ก ชมภาพ) ชาวฝรั่งเศสพบว่าธาตุอื่น ๆ เช่น พอลโลเนียม ( Po) เรเดียม (Ra) และทอเรียม ( Th ) ก็สามารถแผ่รังสีได้ปรากฏการณ์ที่ธาตุแผ่รังสีได้เองอย่างต่อเนื่องเช่นนี้เรียกว่า กัมมันตภาพรังสี ปัจจุบันทราบว่าเกิดจากการเปลี่ยนแปลงภายในนิวเคลียสของไอโซโทปที่ไม่เสถียร และเรียกธาตุที่มีสมบัติเช่นนี้ว่า ธาตุกัมมันตรังสี ธาตุต่าง ๆ ที่พบในธรรมชาติถ้ามีเลขเชิงอะตอมตั้งแต่ 83 จะแผ่รังสีได้ทั้งสิ้น เช่น ซึ่งอาจเขียนใหม่เป็น U-238, U-235, Th-232, Ra-226
นอกจาก ธาตุกัมมันตรังสีที่เกิดเองในธรรมชาติแล้ว นักวิทยาศาสตร์ยังสามารถสังเคราะห์ธาตุกัมมันตรังสีขึ้นมาได้ ซึ่งสามารถนำไปใช้ประโยชน์ในด้านต่าง ๆ ได้มากมาย เออร์เนสต์ รัทเทอร์ฟอร์ด (Ernest Rutherford) ได้ศึกษาเพิ่มเติม และแสดงให้เห็นว่า รังสีที่แผ่ออกมาจากสารกัมมันตรังสีอาจเป็น รังสีอัลฟา ( - ray ) รังสีเบตา ( - ray) หรือ รังสีแกรมมา ( - ray) ซึ่งมีสมบัติต่าง ๆ กันดังนี้
ตารางแสดงชนิดและสมบัติของรังสีบางชนิด
|
ชนิดของรังสี
|
สัญลักษณ์
|
สมบัติ
|
|
รังสีอัลฟา
หรืออนุภาคอัลฟา
|
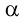
|
มีส่วนประกอบเหมือนนิวเคลียสของอะตอมฮีเลียม คือมีโปรตอนและนิวตรอน อย่างละ 2 อนุภาค ไม่มีอิเล็กตรอน จึงมีประจุไฟฟ้า 2+ มีเลขเชิงมวล 4 amu มีอำนาจในการทะลุสิ่งกีดขวางต่ำมาก ไม่สามารถผ่านแผ่นกระดาษหรือโลหะบาง ๆ ได้ เบี่ยงเบนในสนามไฟฟ้าโดยเบนเข้าหาขั้วลบ
|
|
รังสีบีตา
หรืออนุภาคบีตา
|
β
|
มีสมบัติเหมือนอิเล็กตรอน มีประจุไฟฟ้า 1- มีมวลเท่ากับมวลของ
อิเล็กตรอน มีอำนาจทะลุสิ่งกีดขวางสูงกว่ารังสีอัลฟาประมาณ 100 เท่า สามารถทะลุผ่านแผ่นโลหะบาง ๆ เช่น แผ่นตะกั่วหนา 1 mm หรือแผ่นอะลูมิเนียม หนา 5 mm มีความเร็วใกล้เคียงความเร็วแสง เบี่ยงเบนในสนามไฟฟ้า โดยเบนเข้าหาขั้วบวก
|
|
รังสีแกมมา
|
γ
|
เป็นคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นสั้นมาก ไม่มีประจุและไม่มีมวล มีอำนาจทะลุสิ่งกีดขวางสูงมาก สามารถทะลุผ่านแผ่นตะกั่วหนา 8 mm หรือผ่านแผ่นคอนกรีตหนา ๆ ได้
|
(คลิ้ก ชมแอมิเมชันแสดงสมบัติของรังสีต่าง ๆ )
(คลิ้ก ชมวีดีทัศน์แสดงสมบัติของรังสีต่าง ๆ )
นอกจากรังสี 3 ชนิดดังกล่าวแล้ว ยังอาจจะพบอนุภาคอื่น ๆ ที่แผ่รังสีออกมาจากนิวเคลียสได้ เช่น โพสิตรอน นิวตรอน และโปรตอน ซึ่งมีประจุและมวลเปรียบเทียบกับรังสีทั้ง 3 ชนิดดังในตารางต่อไปนี้
|
อนุภาค
|
สัญลักษณ์
|
ชนิดของประจุ
|
มวล(amu)*
|
|
อัลฟา
|
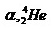
|
2+
|
4.00276
|
|
บีตา
|
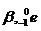
|
1-
|
0.000540
|
|
แกรมมา
|
γ
|
0
|
0
|
|
โพซิตรอน
|
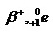
|
1+
|
0.000540
|
|
นิวตรอน
|
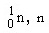
|
0
|
1.0087
|
|
โปรตอน
|
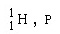
|
1+
|
1.0073
|
1 amu = 1 atomic mass unit = 1.66 x 10-24 g.
การสลายตัวของธาตุกัมมันตรังสี
จากการศึกษาไอโซโทปของธาตุต่างๆ จำนวนมากพบว่า ไอโซโทปที่นิวเคลียสมีอัตราส่วนระหว่างจำนวนนิวตรอนต่อโปรตอนไม่เหมาะสม คือ มีนิวตรอนมากกว่าหรือน้อยกว่าโปรตอนถึงระดับหนึ่ง จะไม่เสถียร ทำให้มีการเปลี่ยนแปลงภายในนิวเคลียส เพื่อเปลี่ยนเป็นนิวเคลียสใหม่ที่เสถียรกว่า โดยการแผ่รังสีออกมา นอกจากนี้ยังพบว่าไอโซโทปจำนวนโปรตอนและนิวตรอนที่เป็นจำนวนคู่จะเสถียรกว่าธาตุที่มีจำนวนโปรตอนและนิวตรอนเป็นเลขคี่ การแผ่รังสีมี 5 แบบ ดังนี้
1. การแผ่รังสีอัลฟา ( 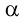 ) (Alpha Decay:) ) (Alpha Decay:)
การแผ่รังสีอัลฟา เกิดขึ้นในกรณีที่ไอโซโทปมีเลขเชิงอะตอมมากกว่า 82 และนิวเคลียสมีอัตราส่วนระหว่างจำนวนโปรตอนกับนิวตรอนไม่เหมาะสม ทำให้เกิดแรงผลักกันในนิวเคลียสมากกว่าแรงยึดเหนี่ยวกัน นิวเคลียสจึงพยายามลดจำนวนอนุภาคลงเสียบ้าง เพื่อช่วยให้นิวเคลียสที่เสถียรขึ้นกว่าเดิม การแผ่รังสีอัลฟ่หรือการปล่อยอนุภาคอัลฟาออกไป 1 อนุภาค ธาตุเดิมจะเปลี่ยนเป็นธาตุใหม่ที่มีเลขเชิงอะตอมลดลง 2 และเลขเชิงมวลลดลง 4 ปฎิกิริยาทั่วไปเป็นดังนี้ (อัลฟามีลักษณะเป็นอนุภาค , particle ไม่ใช่รังสีที่แท้จริง)

(ชมวีดีทัศน์แสดงการแผ่รังสีอัลฟาของ 239Pu)
2. การแผ่รังสีบีตา ( 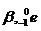 ) (Beta Decay) ) (Beta Decay)
การแผ่รังสีบีตาเกิดขึ้นในกรณีที่นิวเคลียสมีจำนวนนิวตรอนมากกว่าโปรตอนจนถึงระดับที่ไม่เสถียร จึงพยายามลดจำนวนนิวตรอน โดยนิวตรอนจะเปลี่ยนไปเป็นโปรตอน มีผลให้จำนวนนิวตรอนลดลง 1 ในขณะที่โปรตอนเพิ่มขึ้น 1 แต่เนื่องจากนิวตรอนกับโปรตอนมีมวลเท่ากัน ฉะนั้นมวลจึงไม่เปลี่ยนแปลง แต่การที่มีจำนวนโปรตอนเพิ่มขึ้นทำให้ธาตุเดิมเปลี่ยนเป็นธาตุใหม่ที่มีเลขเชิงอะตอมเพิ่มขึ้น 1 หน่วย ขณะเดียวกันจะมีอิเล็กตรอนพลังงานสูงเกิดขึ้นและพุ่งออกมาซึ่งก็คือรังสีบีตา (เป็นอิเล็กตรอนที่พุ่งออกมาจากนิวเคลียส ไม่ใช่อิเล็กตรอนที่โคจรอยู่รอบ ๆ นิวเคลียส ถ้าเราทำให้อิเล็กตรอนที่อยู่รอบ ๆ นิวเคลียสพุ่งออกมาได้ ก็จะเป็นรังสีแคโทด ไม่ใช่บีตา )
การเปลี่ยนนิวตรอนเป็นโปรตอน เป็นดังสมการ
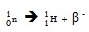

(ชมวีดีทัศน์แสดงการเปลี่ยนนิวตรอนเป็นโปรตอน + β )
3. การแผ่รังสีโพสิตรอน (positron , β + Decay)
เกิดจากกรณีที่นิวเคลียสมีจำนวนโปรตอนมากกว่าจำนวนนิวตรอนจนไม่เสถียร จึงต้องลดจำนวนโปรตอนโดยการเปลี่ยนให้เป็นนิวตรอน มีผลให้จำนวนโปรตอน (เลขเชิงอะตอม) ลดลง 1 แต่เลขเชิงมวลเท่าเดิม ทำให้ธาตุเดิมเปลี่ยนเป็นธาตุใหม่ที่มีจำนวนโปรตอนน้อยกว่าเดิม 1 หน่วย ขณะเดียวกันจะมีการปล่อยอนุภาคที่มีประจุบวกออกมา อนุภาคนี้มีมวลเท่ากับมวลของอิเล็กตรอน (9.1 x 10-28 g) จึงเรียกว่า positive electron หรือ positron ปัจจุบันทราบว่าเมื่อโพสิตรอนทำปฏิกิริยากับบีตา จะทำให้อนุภาคทั้ง 2 ชนิดหายไป กลายเป็นรังสีแกมมา

(ชมวีดีทัศน์แสดงการเปลี่ยนโปรตอนเป็นนิวตรอน + โพสิตรอน)
4.การจับยึดอิเล็กตรอน (electron capture)
เกิดขึ้นเมื่อนิวเคลียสมีจำนวนโปรตอนมากกว่านิวตรอนจนไม่เสถียร ทำนองเดียวกับการแผ่รังสีโพสิ
ตรอนในข้อ 3 แต่ต่างกันที่มีพลังงานต่ำเกินไปจึงปล่อยโพสิตรอนไม่ได้ กรณีเช่นนี้นิวเคลียสจะใช้วิธีจับเอาอิเล็กตรอน 1 อนุภาค ของมันเองที่โคจรอยู่รอบนิวเคลียสเข้ามาไว้ในนิวเคลียส และรวมเข้ากับโปรตอนกลายเป็นนิวตรอนกับนิวทริโน (neutrino ใช้สัญลักษณ์ n0 หรือ ,นิว ) อย่างละ 1 อนุภาค ทำให้กลายเป็นธาตุใหม่ที่มีจำนวนโปรตอนหรือเลขเชิงอะตอมลดลง 1 หน่วยแต่เลขเชิงมากเท่าเดิม เมื่ออิเล็กตรอนของชั้น K ถูกจับไป อิเล็กตรอนจากระดับชั้นนอก ๆ จะเข้ามาแทนที่ การจับยึดอิเล็กตรอนเป็นดังสมการ
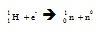
อิเล็กตรอนที่ถูกจับยึดนี้จะเป็นอิเล็กตรอนจากวงโคจรระดับชั้นในสุด คือ n=1 หรือระดับชั้นเค (K-shell) ดังนั้นการสลายแบบนี้จึงมีชื่อเรียกอีกอย่างว่า เค-แคปเชอร์ (K-capture)
ตัวอย่าง
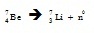
** นิวทริโน จัดเป็นอนุภาคมูลฐานที่มีมวลน้อยมาก เคลื่อนที่ด้วยความเร็วเกือบเท่าแสง ไม่มีประจุไฟฟ้า สามารถทะลุผ่านสิ่งกีดขวางหนามาก ๆ ได้ดี โดยไม่มีผลกระทบกับอะตอม หรือโมเลกุลของสสารที่ทะลุผ่านไป การตรวจหานิวทริโนทำได้ยากมาก นิวทริโนยังเป็นอนุภาคสามัญที่สุดในจักรวาล มีจำนวนมากกว่าอนุภาคที่รู้จักกันทั่วไปคือ อิเล็กตรอน โปรตอน นิวตรอน หนึ่งหมื่นล้านเท่า
5.การแผ่รังสีแกมมา (Gamma ( ) decay)
การแผ่รังสีแกมมา มักจะเกิดขึ้น ในกรณีที่ไอโซโทปมีการสลายตัวให้รังสีอัลฟาหรือบีตาไปแล้วแต่ แต่ไอโซโทปยังคงมีพลังงานเกินกว่าปกติ จึงปล่อยพลังงานส่วนเกินออกมาในรูปของรังสีแกมมา มีลักษณะเป็นคลื่นแม่เหล็กไฟฟ้า ไม่มีมวล ไม่มีประจุ อาจเรียกว่าโฟตอน (photon) ก็ได้ ( คำว่าโฟตอนเป็นการพิจารณาคลื่นแม่เหล็กไฟฟ้าในฐานะเป็นอนุภาค ) การแผ่รังสีแกมมาจึงไม่ทำให้เลขเชิงมวลและเลขเชิงอะตอมเปลี่ยนแปลง ไอโซโทปกัมมันตรังสียังคงเป็นไอโซโทปของธาตุเดิมแต่มีพลังงานลดลง เช่น
ตารางแสดงชนิดและสมบัติของรังสีและการเปลี่ยนแปลงของนิวเคลียสกันเนื่องจากการแผ่รังสีนั้น
|
การแผ่รังสี
|
การเปลี่ยนแปลงของนิวเคลียส
|
|
ชนิด
|
เลขเชิงมวล
|
ประจุ
|
เลขเชิงมวล
|
เลขเชิงอะตอม
|
|
อัลฟา -
|
4
|
2+
|
ลดลง 4
|
ลดลง 2
|
|
บีตา - -
|
0
|
1-
|
ไม่เปลี่ยน
|
เพิ่มขึ้น 1
|
|
แกมมา -
|
0
|
0
|
ไม่เปลี่ยน
|
ไม่เปลี่ยน
|
|
โพซิตรอน -
|
0
|
1+
|
ไม่เปลี่ยน
|
ลดลง 1
|
Belt of stability หรือ Band of stability
ได้มีการศึกษาถึงความเสถียรหรือไม่เสถียรของไอโซโทปต่าง ๆ ของธาตุที่มีมวลอะตอมระหว่าง 1 ถึง 20 คือไฮโดรเจนถึงแคลเซียม พบว่าไอโซโทปที่มีโปรตอนกับนิวตรอนเท่ากันเป็นไอโซโทปที่เสถียร ต่อจากนั้นธาตุต่าง ๆ จะมีจำนวนไอโซโทปเพิ่มขึ้น โดยมีทั้งไอโซโทปที่เสถียรและไม่เสถียร ไอโซโทปที่เสถียรจะมีจำนวนนิวตรอนมากกว่าโปรตอนระดับหนึ่ง แต่ถ้ามีนิวตรอนมากเกินไปก็จะไม่เถียรกลายเป็นไอโซโทปกัมมันตรังสี ไอโซโทปประเภทนี้จะมีการเปลี่ยนนิวตรอนที่มีมากเกินไปให้เป็นโปรตอน ทำให้เปลี่ยนเป็นธาตุใหม่ที่มีเลขเชิงอะตอมเพิ่มขึ้น 1 หน่วย ขณะเดียวกันก็จะปล่อยอนุภาคพลังงานสูงจำนวน 1 อนุภาคออกมา อนุภาคชนิดนี้มีประจุ -1.6 x 10-19 คูลอมบ์ มีมวล 9.1 x 10-28 กรัม เรียกว่าอนุภาคบีตา ( ) หรือรังสีบีตา ให้สังเกตว่าประจุและมวลของบีตาเท่ากับประจุและมวลของอิเล็กตรอน จึงกล่าวว่าบีตาเป็นอิเล็กตรอน แต่ไม่ใช่อิเล็กตรอนที่โคจรอยู่รอบนิวเคลียส
ขณะเดียวกันธาตุอีกส่วนหนึ่งมีโปรตอนมากกว่านิวตรอนจนไม่เสถียร จึงปรับตัวให้เสถียรโดยการเปลี่ยนโปรตอนที่มีมากเกินไปให้เป็นนิวตรอน กลายเป็นอะตอมของธาตุใหม่ที่มีเลขเชิงอะตอมลดลง 1 หน่วย ขณะเดียวกันจะปล่อยอนุภาคพลังงานสูงซึ่งมีประจุ +1.6 x 10-19 คูลอมบ์ มีมวล 9.1 x 10-28 กรัม อนุภาคนี้มีมวลเท่าอิเล็กตรอนแต่มีประจุบวกบางคนจึงเรียกว่าอิเล็กตรอนประจุบวก เรียกว่าโพสิตรอน ( ) ถ้าไม่พิจารณาให้ดีอาจสับสนว่าอิเล็กตรอนมีประจุทั้งลบทั้งบวก
สำหรับธาตุที่มีเลขเชิงอะตอมตั้งแต่ 83 ขึ้นไป ทุกไอโซโทปล้วนเป็นไอโซโทปกัมมันตรังสีทั้งสิ้น มีการปรับตัวให้เกิดความเสถียรโดยการแผ่รังสีอัลฟา (ปล่อยอนุภาคอัลฟา ) มีผลให้กลายเป็นอะตอมของธาตุใหม่ที่มีเลขเชิงอะตอมลดลง 2 หน่วย เลขเชิงมวลลดลง 4 หน่วย
กลุ่มของไอโซโทปเสถียรและไม่เสถียรเมื่อนำมาแสดงด้วยกราฟโดยให้แกนตั้งแทนจำนวนนิวตรอน แกนนอนแทนเลขเชิงอะตอมหรือจำนวนโปรตอน จะพบว่ากลุ่มของไอโซโทปที่เสถียรจะกระจายกินพื้นที่เป็นแถบแคบ ๆ เรียกว่า Belt หรือ Band of stability ดังรูป
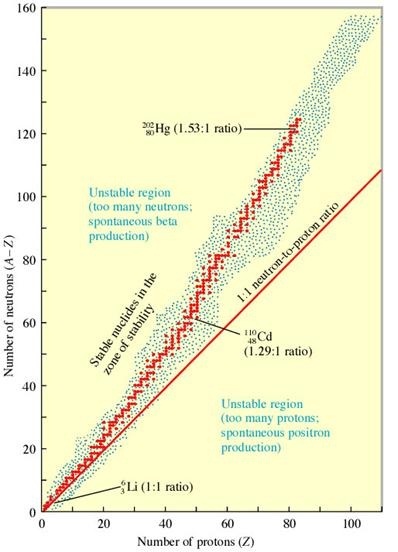
อธิบายเพิ่มเติมจากรูป ; แบ่งส่วนสำคัญของพื้นที่ในรูปเป็น 3 ส่วน ดังนี้
1. ส่วนที่อยู่บนเส้นสีแดง หมายถึงไอโซโทปที่มีจำนวนนิวตรอน เท่ากับโปรตรอน หรือ n : p = 1: 1
2. ส่วนที่อยู่ทางซ้ายของเส้นสีแดง หมายถึงไอโซโทปที่มีจำนวนนิวตอนมากกว่าโปรตอน หรือ n > p
3. ส่วนที่อยู่ทางขวาของเส้นสีแดง หมายถึงไอโซโทปที่มีจำนวนโปรตอนมากกว่านิวตรอน หรือ p > n
** ส่วนที่แสดงว่าเป็นไอโซโทปเสถียร หรือ Belt of stabiliyu หรือ Band of stability เป็นส่วนของพื้นที่แคบ ๆ เป็นส่วนหนึ่งของพื้นที่ในข้อ 2 แสดงด้วยจุดสีแดงกระจายเป็นเป็นเส้นแบน ๆ จะ
มองว่าคล้ายเข็มขัดสักเส้นหนึ่งก็ได้ เขียนข้อความกำกับว่า stable nuclides in the zone of stability ไอโซโทปต่าง ๆ ที่อยูนอกพื้นที่ส่วนนี้ล้วนเป็นไอโซโทปกัมมันตรังสีทั้งสิ้น ถ้าสังเกตให้ดีจะเห็นว่า
ไอโซโทปที่มีเลขเชิงอะตอมไม่เกิน 20 เมื่อมีจำนวนนิวตรอนเท่ากับโปรตอนจะเป็นไอโซโทปเสถียร แต่เมื่อมีจำนวนโปรตอนมากกว่า 20 ความเสถียรจะไปอยู่ที่ไอโซโทปที่มีนิวตรอนมากกว่าโปรตอน
(สังเกตที่แนวจุคสีแดงกระจาย) แต่ถ้านิวตรอนมากเกินไปก็จะไม่เสถียร สังเกตที่เขียนข้อความกำกับว่า Unstable region (too many) neutrons ; ไอโซโทปที่อยู่บริเวณส่วนนี้จะเป็นชนิดที่ปล่อย
อนุภาคบีตา ; β
ในทางกลับกันไอโซโทปที่อยู่ทางขวาของ Band of stability จะเป็นพวกที่มีโปรตอนมากกว่านิวตรอน สังเกตที่ข้อความกำกับว่า Unstable region (too many) proton ; ไอโซโทปที่อยู่ใน
บริเวณพื้นที่นี้จะเป็นชนิดที่ปล่อยโพสิตรอน
สมการนิวเคลียร์
ปฏิกิริยานิวเคลียร์ คือ ปฏิกิริยาที่เกิดขึ้นในนิวเคลียส ให้รังสีอัลฟา บีตา โพสิตรอน นิวทริโนและแกมมาดังที่กล่าวมาแล้ว มีผลให้เกิดการเปลี่ยนแปลงของนิวเคลียส สมการนิวเคลียร์ คือ สมการที่แสดงปฏิกิริยานิวเคลียร์ที่เกิดขึ้น การเขียนและการดุลสมการต้องพิจารณาเลขเชิงมวล และ เลขเชิงอะตอมของสารทุกตัวในปฏิกิริยา ตามรูปแบบของปฏิกิริยานิวเคลียร์ที่เกิดขึ้น เช่น

รูปภาพที่เกี่ยวข้อง

Size : 10.76 KBs
Upload : 2013-08-31 14:51:50
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|