สมบัติของธาตุและสารประกอบ ตอนที่ 1 สารประกอบออกไซด์และคลอไรด์
สมบัติของธาตุและสารประกอบ
สมบัติของธาตุเป็นลักษณะเฉพาะตัวของธาตุแต่ละชนิด แต่ธาตุต่างชนิดก็อาจมีสมบัติโดยรวมคล้าย ๆ กัน จึงจัดธาตุให้เป็นหมวดหมู่ต่าง ๆ ได้ แต่อย่างไรก็ตามธาตุแต่ละธาตุ
ย่อมมีสมบัติเฉพาะตัวแตกต่างกัน เมื่อใช้ความเป็นโลหะเป็นเกณฑ์ สามารถจำแนกธาตุได้เป็น 3 กลุ่ม คือ โลหะ (metals) อโลหะ (nonmetals) และกึ่งโลหะ (metalloids) ดังรูป
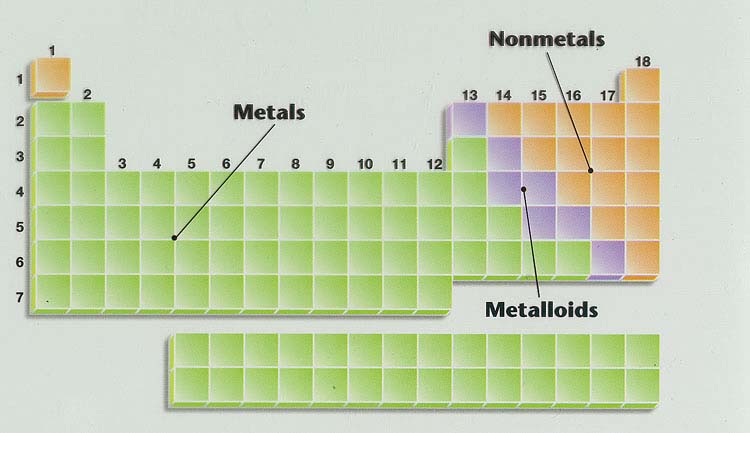
ธาตุโลหะ (metal elements) เป็นธาตุที่เกิดจากอะตอมของโลหะชนิดเดียวกันรวมกันเป็นโครงผลึกหรือเป็นก้อนของโลหะนั้น ๆ โลหะส่วนใหญ่มีสถานะเป็นของแข็ง
ยกเว้น ปรอท (Hg) และซีเซียม (Cs) โลหะแต่ละชนิดมีความหนาแน่นไม่เท่ากัน โลหะที่มีความหนาแน่นตั้งแต่ 5 g/cm3 เรียกว่าโลหะหนัก (heavy metal)
** ธาตุที่มีความหนาแน่นสูงสุด 9 อันดับมีดังนี้
1. Osmium , Os , 22.61 g/cm3
2. Iridium, Ir, 22.56 g/cm3
3. platinum, Pt, 21.4 g/cm3
4. rhenium, Re, 21.0 g/cm3
5. neptunium, Np, 20.4 g/cm3
6. plutonium, Pu, 19.8 g/cm3
7. gold, Au, 19.3 g/cm3
8. tungsten, W, 19.3 g/cm3
9. mercury, Hg, 13.53 g/cm3
โลหะหนักส่วนใหญ่เป็นโลหะแทรนซิชัน ( Transition metals) ซึ่งเป็นพิษต่อสิ่งมีชีวิต โลหะหนักเป็นสารที่คงตัว ไม่สลายตัวได้ในกระบวนการธรรมชาติ
จึงมีบางส่วนตกตะกอนสะสมอยู่ในดิน หรือดินตะกอนที่อยู่ในน้ำ รวมถึงการสะสมอยู่ในสัตว์น้ำ โลหะหนักเป็นวัตถุดิบที่ถูกนำมาใช้ในหลายภาคส่วน เช่น ในด้านอุตสาหกรรม
ใช้โลหะหนักในกระบวนการผลิตพลาสติกพีวีซี สี ถ่านไฟฉาย ด้านการเกษตร เป็นส่วนผสมของยาฆ่าแมลงและปุ๋ย ทางการแพทย์ใช้โลหะหนักเป็นส่วนผสมของยา
อุปกรณ์ทางการแพทย์และเครื่องสำอาง
ในชีวิตประจำวันคนเรามีความเสี่ยงต่อการได้รับโลหะหนักเข้าสู่ร่างกาย ผ่านทางการบริโภคอาหาร หรือดื่มน้ำที่มีโลหะหนักเจือปนอยู่ ชุมชนที่อาศัยอยู่ในบริเวณ
โรงงานที่ลักลอบทิ้งของเสียลงดินหรือลงแหล่งน้ำมีโอกาสเสี่ยงต่อการได้รับโลหะหนักมากขึ้น การกำจัดกากของเสียอย่างผิดวิธี มีโอกาสทำให้โลหะหนักกระจายสู่สิ่งแวดล้อมได้มากขึ้น
โลหะหนักบางชนิดให้ทั้งคุณและโทษต่อสิ่งมีชีวิต ขึ้นอยู่กับชนิดของสิ่งมีชีวิตและปริมาณของโลหะหนักที่ได้รับเข้าไป เช่น แบคทีเรียต้องการ โคบอลท์ (Cobalt-Co) ทองแดง (Copper-Cu)
แมงกานีส (Manganese-Mn) โมลิบดีนัม (Molybdenum-Mo) แวเนเดียม (Vanadium-V) และสังกะสี (Zinc-Zn) ในปริมาณที่พอเหมาะต่อการเจริญเติบโต แต่ถ้ามากเกินไปจะเป็นพิษต่อจุลินทรีย์
จึงใช้สารประกอบของโลหะหนักเป็นสารกำจัดเชื้อราในการเกษตร โลหะหนักบางชนิด เช่น ปรอท (Mercury-Hg) และแคดเมียม (Cadmium-Cd) จัดเป็นสารพิษอย่างแรงต่อร่างกาย
และถูกจัดให้ขึ้นบัญชีดำ (black list) ในกลุ่มของสารพิษ
โลหะหนักมีทั้งหมด 22 ชนิดได้แก่ ไททาเนียม (22Ti) โครเมียม(24Cr) แมงกานีส(25Mn) เหล็ก (26Fe) โคบอลต์(27Co) นิเกิล(28Ni) ทองแดง(29Cu) สังกะสี (30Zn)
อาร์เซนิก (33As) โมลีบดีนัม(42Mo) เงิน(47Ag) แคดเมียม(48Cd) ดีบุก(50Sn) พลวง(51Sb) แทนทาลัม(73Ta) ทังสเตน(74W) ทองคำขาว (78Pt) ทองคำ (79Au) ปรอท(80Hg)
ตะกั่ว (82Pb) บิสมัส(83Bi) ยูเรเนียม(92U)
The Agency for Toxic Substances and Disease Registry (ATSDR , คลิ้กดูเพิ่มเติมได้) เป็นองค์กรที่ก่อตั้งขึ้นเพื่อศึกษาผลกระทบต่อสุขภาพและคุณภาพชีวิตจากสารอันตรายต่าง ๆ
ได้จัดอันดับอันตรายของโลหะหนักอันดับต้น ๆ (Top Hazardous Substances) เอาไว้ดังนี้
Arsenic , อาร์เซนิก (33As)
อาเซนิกหรือสารหนู (ความหนาแน่น 5.776 g/cm3) เป็นโลหะหนักที่เป็นอันตรายลำดับที่ 1 ใน Top Hazardous Substances ของ ATSDR เนื่องจากความเป็นพิษเฉียบพลัน
อาเซนิกจะถูกปล่อยสู่สิ่งแวดล้อมได้จากกระบวนการถลุงแร่ จำพวกทองแดง สังกะสี และตะกั่ว กระบวนการผลิตสารเคมีและแก้ว รวมถึงกระบวนการผลิตยาฆ่าแมลง นอกจากนี้ยังพบในแหล่งอื่น ๆ
เช่น สี ยาเบื่อหนู ยาฆ่าเชื้อรา เมื่อเข้าสู่ร่างกายจะเข้าไปทำลายระบบเลือด ไต ระบบประสาทส่วนกลาง และระบบย่อยอาหาร
Lead , ตะกั่ว (92Pb)
ตะกั่ว (ความหนาแน่น 11.342 g/cm3) เป็นโลหะหนักที่เป็นอันตรายลำดับที่ 2 ใน Top Hazardous Substances ของ ATSDR เนื่องจากเกิดความเป็นพิษเฉียบพลันในเด็ก
ตะกั่วมักใช้เป็นส่วนผสมในโลหะที่ทำท่อส่งน้ำ ท่อระบายน้ำ และอุปกรณ์ทางทหาร ในแต่ละ ปีมีการใช้ตะกั่วในกระบวนการผลิตสิ่งต่างๆประมาณ 2.5 ล้านตันทั่วโลก
ซึ่งส่วนใหญ่ใช้ในแบตเตอรี่ การหุ้มสายเคเบิล และกระสุนปืน นอกจากนี้ยังพบในสี พลาสติกพีวีซี ดินสอ และยาฆ่าแมลง อวัยวะเมื่อเข้าสู่ร่างกายจะทำลายกระดูก สมอง ไต และต่อมไทรอยด์
Mercury, ปรอท (80Hg)
ปรอท (ความหนาแน่น 13.534 g/cm3) เป็นโลหะหนักที่เป็นอันตรายลำดับที่ 3 ใน Top Hazardous Substances ของ ATSDR ปรอทที่พบในสิ่งแวดล้อมอาจเกิดจากก๊าซ
ที่ภูเขาไฟระเบิดพ่นออกมา มี 3 รูป คือ ธาตุปรอท สารอินทรีย์ปรอท และสารอนินทรีย์ปรอท อุตสาหกรรมที่ใช้ปรอทในกระบวนการผลิตได้แก่ อุตสาหกรรมเหมืองแร่ การผลิตกระดาษ
ปรอท สี สารปรอทสามารถแพร่กระจายไปได้ทั่วโลกโดยกระแสลม และกลับสู่ผิวโลกมากับน้ำฝน มีการสะสมในแต่ละลำดับชั้นของห่วงโซ่อาหาร ปรอทถูกยกเลิกใช้เป็นส่วนประกอบของสี
และยาฆ่าแมลงมาตั้งแต่ปี 1990 (พ.ศ. 2533 ) แต่ยังคงใช้ในเทอร์โมมิเตอร์ เทอร์โมสตัต และวัสดุอุดฟัน เมื่อเข้าสู่ร่างกายจะทำลาย สมองและไต
Cadmium , แคดเมียม (48Cd)
แคดเมียม (ความหนาแน่น 8.65 g/cm3) เป็นโลหะหนักในลำดับที่ 7 ใน Top Hazardous Substances ของ ATSDR แคดเมียมเป็นผลิตภัณฑ์ซึ่งเป็นผลพลอยได้จากการ
ทำเหมืองแร่จากการถลุงแร่ตะกั่วและสังกะสี แคดเมียมมักถูกใช้ในแบตเตอรี่ร่วมกับ นิกเกิล ตะกั่ว พลาสติกพีวีซียาฆ่าแมลง และสี สามารถพบแคดเมียมในดินเนื่องจากการใช้ยาฆ่าแมลง
ยาฆ่าเชื้อรา และปุ๋ย แคดเมียมถูกดูดซับ 15 – 50% ในระบบทางเดินหายใจ และถูกดูดซับในลำไส้ประมาณ 2 – 7% เมื่อเข้าสู่ร่างกายจะทำลาย ตับ ไต สมอง ปอด และกระดูก
Iron , เหล็ก (26Fe)
เหล็ก (ความหนาแน่น 7.874 g/cm3) ความเป็นพิษของธาตุเหล็กเกิดจากการดูดซึมธาตุเหล็กเข้าร่างกายในปริมาณมากเกินไป เด็กที่ทานยาบำรุงเลือดที่มีธาตุเหล็ก
หรือวิตามินรวมต่าง ๆ อาจได้รับธาตุเหล็กในปริมาณมากจนเป็นอันตราย ต่อ ตับ ไต ระบบหัวใจและหลอดเลือด ผู้ป่วยธาลัสซีเมียมักทีภาวะธาตุเหล็กเกิน
แต่อย่างไรก็ตามธาตุเหล็กเป็นธาตุที่มีความสำคัญต่อร่างกายมาก อันตายของมันเกิดจากการที่ได้ร่างกายได้รับมากเกินไปเท่านั้น แต่ถ้าร่างกายขาดธาตุเหล็กอันตรายก็มีมากเช่นกัน
** Aluminum , อลูมิเนียม,อลูมินัม (13Al)
อลูมินัมไม่จัดเป็นโลหะหนักแต่เป็นธาตุที่มีบนผิวโลกมากเป็นอันดับ 3 อลูมินัมเป็นธาตุที่หาได้ง่ายและนำมาใช้ประโยชน์หลายด้าน เช่น ยาลดกรดในกระเพาะอาหาร สเปรย์พ่น
กระป๋องน้ำอัดลม อลูมินัมฟอยล์ เซรามิกส์ ดอกไม้ไฟ ภาชนะปรุงอาหาร วัสดุก่อสร้างและของใช้ในบ้านเรือน ผลการศึกษาเมื่อประมาณ 20 ปีที่แล้วระบุว่า อลูมินัมอาจเป็นสาเหตุในการเกิดโรค
Alzheimer เนื่องจากมีการตรวจพบอลูมินัมในเนื้อเยื่อสมองของคนไข้ที่เป็นโรค Alzheimer แต่ภายหลังมีข้อขัดแย้งเนื่องจากมีหลักฐานระบุถึงการตรวจพบอลูมินัมในเนื้อเยื่อสมองคนที่ไม่เป็นโรคเช่นกัน
การศึกษาถึงความสัมพันธ์ระหว่างอลูมินัมและโรค Alzheimer ยังคงดำเนินต่อไป โดยอวัยวะเป้าหมายหลักที่อลูมินัมเข้าไปทำปฏิกิริยาคือ ไต ระบบประสาทส่วนกลาง และระบบย่อยอาหาร
สมบัติทางเคมีของธาตุ (คลิ้กเพื่อเปิดตารางธาตุ)
แนวโน้มของสมบัติทางกายภาพของธาตุตามหมู่และตามคาบ ได้แก่ขนาดอะตอม ขนาดไอออน ความเป็นโลหะ จุดหลอมเหลว พลังงานไอออไนเซชัน อิเล็กโตรเนกาติวิตีและอิเล็กตรอนอัฟฟินิตี
เป็นสมบัติที่ศึกษามาแล้วในตอนที่ผ่านมา ในตอนต่อไปนี้จะพิจารณาสมบัติทางเคมีของธาตุ ในการเกิดสารประกอบออกไซด์ และสารประกอบคลอไรด์ กันบ้าง
สารประกอบออกไซด์ (Oxide) คือสารประกอบที่เกิดจากธาตุใดธาตุหนึ่ง (โลหะหรืออโลหะก็ได้) ทำปฏิกิริยากับออกซิเจน สารประกอบออกไซด์จึงเป็นสารประกอบธาตุคู่
คือประกอบด้วยธาตุเพียง 2 ธาตุเท่านั้น
โลหะ + ออกซิเจน → ออกไซด์ของโลหะ เช่น Na2O K2O MgO CaO Al2O3
อโลหะ + ออกซิเจน → ออกไซด์ของอโลหะ เช่น CO2 N2O NO2 N2O4 SO2 SO3
การเตรียมสารประกอบออกไซด์ต้องเริ่มจากการเตรียมก๊าซออกซิเจน ในห้องปฏิบัติการสามารถเตรียมโดยการเผาโพแทสเซียมเปอร์แมงกาเนตหรือด่างทับทิม (KMnO4) หรือเผาโพแทสเซียมคลอเรต
(KClO3) หรือจากการสลายตัวของไฮโดรเจนเปอร์ออกไซด์ (H2O2) หรือการแยกน้ำด้วยไฟฟ้า หรือวิธีอื่น ๆ อีกมากมาย เก็บก๊าซออกซิเจนโดยการแทนที่น้ำเนื่องจากมีความหนาแน่นน้อยกว่าอากาศ
เกิดปฏิกิริยาดังสมการ
KMnO4 (s) → K2MnO4 (s) + MnO2 (s) + O2 (g)
2KClO3(s) → 2KCl(s) + 3O2(g)
2H2O2 → 2H2O + O2(g)
(คลิ้ก ชมแอนิเมชันแสดงการเตรียมก๊าซออกซิเจนโดยการเผา KClO3 )
(คลิ้ก ชมแอนิเมชันแสดงการเตรียมก๊าซออกซิเจนจากการสลายตัวของ H2O2)
การเตรียมสารประกอบออกไซด์ของธาตุต่าง ๆ ทำได้โดยเผาธาตุนั้น ๆ ในก๊าซออกซิเจน ธาตุจะทำปฏิกิริยาเกิดเป็นสารประกอบออกไซด์ ความว่องไวหรือความรุนแรง
ของปฏิกิริยาจะแตกต่างกันไปตามชนิดของธาตุ
(ชมวีดีทัศน์การเตรียมออกไซด์ของฟอสฟอรัส)
(ชมวีดีทัศน์การเตรียมออกไซด์ของซัลเฟอร์)
(ชมวีดีทัศน์การเตรียมออกไซด์ของแคลเซียม)
ปฏิกิริยาในการเกิดสารประกอบออกไซด์ของฟอสฟอรัส ซัลเฟอร์และแคลเซียม เป็นดังสมการต่อไปนี้
4P(s) + 3O2(g) → P4O6
4P(s) + 5O2(g) → 2P2O5
S(s) + O2(g) → SO2(g)
2Ca(s) + O2(g) → 2CaO(s)
เมื่อนำธาตุที่มีเลขเชิงอะตอมตั้งแต่ 1 ถึง 20 คือ H ถึง Ca มาทำปฏิกิริยากับก๊าซออกซิเจนเพื่อเตรียมสารประกอบออกไซด์ พบว่ามี 17 ธาตุทำปฏิกิริยา
ได้สารประกอบออกไซด์ มี 3 ธาตุไม่ทำปฏิกิริยาคือ He Ne และ Ar ดังตาราง
|
|
|
|
|
|
|
H2O
|
(He)
|
|
Li2O
|
BeO
|
B2O3
|
CO CO2
|
NO N2O
NO2 N2O4
|
O2
|
OF2
|
(Ne)
|
|
Na2O
|
MgO
|
Al2O3
|
SiO2
|
P4O6 , P4O10(สูตรโมเลกุล)
(P2O3 , P2O5,สูตรเอมพิริกัล)
|
SO2
SO3
|
Cl2O
|
(Ar)
|
|
K2O
|
CaO
|
|
|
|
|
|
|
ความเป็นกรดหรือเบสของสารประกอบออกไซด์
1. สารประกอบออกไซด์ของโลหะ เมื่อละลายน้ำจะได้สารละลายที่เป็นเบส เรียกชื่อรวม ๆ ว่า basic oxide เช่น
Na2O + H2O → 2NaOH (โซเดียมไฮดรอกไซด์)
MgO + H2O → Mg(OH)2 (แมกนีเซียมไฮดรอกไซด์)
2. สารประกอบออกไซด์ของอโลหะ เมื่อละลายน้ำจะได้สารละลายที่เป็นกรด เรียกชื่อรวม ๆ ว่า acidic oxide เช่น
CO2 + H2O → H2CO3 (กรดคาร์บอนิก)
SO2 + H2O → H2SO3 (กรดซัลฟูรัส)
SO3 + H2O → H2SO4 (กรดซัลฟูริก)
3. สารประกอบออกไซด์ของธาตุกึ่งโลหะ ไม่ละลายน้ำ แต่ทำปฏิกิริยากับเบสและกรดได้ทั้ง 2 ชนิด แสดงว่ามีสมบัติเป็นทั้งกรดและเบส เรียกชื่อรวม ๆ ว่า
amphoteric oxide เช่น SiO2 Al2O3 ( Al อยู่ในตำแหน่งของธาตุกึ่งโลหะ แต่จัดให้เป็นโลหะ แต่สมบัติของสารประกอบออกไซด์เป็นทั้งกรดและเบส)
Al2O3 + 2NaOH → Na2Al2O4 + H2O ; (Al2O3 แสดงสมบัติเป็นกรดเพราะทำปฏิกิริยากับเบส)
Al2O3 + 6HCl è 2AlCl3 + 3H2O ; (Al2O3 แสดงสมบัติเป็นเบสเพราะทำปฏิกิริยากับกรด)
4. สารประกอบออกไซด์ของอโลหะที่เป็นกลางได้แก่ H2O CO NO ; (H2O เป็นได้ทั้งกรดและเบสตามทฤษฎีกรด-เบสของเบรินสเตด-ลาวรี ,Brønsted-Lowry Theory อยู่ในเนื่องกรด-เบส)
5. He Ne Ar ไม่ทำปฏิกิริยากับออกซิเจนจึงไม่เกิดสารประกอบออกไซด์
สารประกอบคลอไรด์ คือสารประกอบที่เกิดจากธาตุใดธาตุหนึ่งทำปฏิกิริยากับก๊าซคลอรีน เป็นสารประกอบธาตุคู่เช่นเดียวกับสารประกอบออกไซด์ ในการเตรียมสารประกอบคลอไรด์นั้น
ขั้นแรกต้องเตรียมก๊าซคลอรีนขึ้นมาก่อน ในห้องปฏิบัติการเตรียมก๊าซคลอรีนได้หลายวิธี เช่น จากปฏิกิริยาระหว่าง กรดไฮโดรคลอริก (HCl) กับโพแทสเซียมเปอร์แมงกาเนตหรือด่างทับทิม (KMnO4)
ดังสมการ
KMnO4 (s) + 16 HCl (aq) → 2KCl (aq) + 2MnCl2 (aq) + 8H2 (l) + 5Cl2 (g)
ก๊าซคลอรีนเป็นก๊าซพิษ มีสีเขียวอ่อน (ดูรูป) มีกลิ่นฉุน การสูดดมจะเป็นอันตรายต่อระบบทางเดินหายใจ จึงต้องระมัดระวัง ก๊าซคลอรีนที่เกิดขึ้นต้องผ่านสารดูดความชื้นเพื่อ
ให้ได้ก๊าซคลอรีนแห้ง การเก็บก๊าซคลอรีนสามารถเก็บโดยการแทนที่อากาศได้ เนื่องจากมีความหนาแน่นมากกว่าอากาศ และมีสีเขียวอ่อนมองเห็นได้ นอกจากนั้นยังเป็นผลดีมากกว่า
การเก็บโดยการแทนที่น้ำเพราะก๊าซคลอรีนละลายน้ำได้ จะทำให้สูญเสียก๊าซไปจากการละลายน้ำ และก๊าซคลอรีนที่เก็บด้วยการแทนที่น้ำจะมีความชื้นหรือไอน้ำเจือปน
(คลิ้กชมแอนิเมชัน แสดงการเตรียมก๊าซคลอรีน)
การเตรียมสารประกอบคลอไรด์ของธาตุต่าง ๆ ทำได้โดยการเผาธาตุนั้น ๆ กับก๊าซคลอรีน ทำนองเดียวกับการเตรียมสารประกอบออกไซด์ ธาตุที่เผาจนร้อนจะทำปฏิกิริยา
กับก๊าซคลอรีนเกิดสารประกอบคลอไรด์ของธาตุนั้น ๆ ความว่องไวหรือความแรงของปฏิกิริยาแตกต่างกันไปตามชนิดของธาตุ ส่วนมากเป็นไปตามแนวโน้มของสมบัติของธาตุตามหมู่และคาบ
(คลิ้กชมวีดีทัศน์ แสดงปฏิกิริยาระหว่างโซเดียมกับก๊าซคลอรีนเกิดสารประกอบโซเดียมคลอไรด์)
ปฏิกิริยาระหว่างก๊าซคลอรีนกับธาตุบางชนิด เป็นดังนี้
2Na(s) + Cl2(g) → 2NaCl(s)
Mg(s) + Cl2(g) → MgCl2(s)
N2(g) + 3Cl2(g) → 2NCl3(g)
2P(s) + 3Cl2(g) → 2PCl3(g)
2P(s) + 5Cl2(g) → 2PCl5(g)
เมื่อนำธาตุที่มีเลขเชิงอะตอมตั้งแต่ 1 ถึง 20 หรือจาก H ถึง Ca มาเตรียมสารประกอบคลอไรด์ พบว่ามี 17 ธาตุที่เกิดสารประกอบคลอไรด์ มี 3 ธาตุ คือ He Ne และ Ar
ไม่ทำปฏิกิริยากับก๊าซคลอรีน จึงไม่เกิดสารประกอบคลอไรด์ ดังตาราง
|
|
|
|
|
|
|
HCl
|
He
|
|
LiCl
|
BeCl2
|
BCl3
|
CCl4
|
NCl3
|
Cl2O
|
ClF
|
(Ne)
|
|
NaCl
|
MgCl2
|
AlCl3
|
SiCl4
|
PCl3 , PCl5
|
SCl2
|
Cl–Cl
|
(Ar)
|
|
KCl
|
CaCl2
|
|
ความเป็นกรดหรือเบสของสารประกอบคลอไรด์
1. สารประกอบคลอไรด์ของโลหะบางชนิด เมื่อละลายน้ำจะได้สารละลายเป็นกลาง (neutral) ได้แก่
LiCl NaCl KCl MgCl2 CaCl2 (BeCl2 ไม่ละลายน้ำ)
2. สารประกอบคลอไรด์บองโลหะบางชนิด เมื่อละลายน้ำจะได้สารละลายกรด ได้แก่ AlCl3
3. สารประกอบคลอไรด์ของอโลหะ เมื่อละลายน้ำจะได้สารละลายเป็นกรด (acidic) ได้แก่ HCl
BeCl2 BCl3 NCl5 Cl2O ClF AlCl3 PCl5 SCl2 Cl2 (CCl4 NCl3 ไม่ละลายน้ำ)
** ไม่มีสารประกอบคลอไรด์ชนิดใดที่เป็นเบส
4. He Ne Ar ไม่ทำปฏิกิริยากับก๊าซคลอรีน จึงไม่เกิดสารประกอบคลอไรด์
รูปภาพที่เกี่ยวข้อง

Size : 111.48 KBs
Upload : 2013-08-25 06:10:02
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|