ปริมาณสารสัมพันธ์ ตอนที่ 9/5 การคำนวณจากสมการมากกว่า 1 สมการที่เกิดอย่างต่อเนื่อง
ปฏิกิริยามากกว่า 1 ปฏิกิริยาต่อเนื่องกัน
ลักษณะของปฏิกิริยาประเภทนี้คือมีปฏิกิริยาตั้งแต่ 2 ปฏิกิริยาขึ้นไป โดยการเกิดขึ้นของปฏิกิริยาต้องเป็นไปตามลำดับ คือต้องให้ปฏิกิริยาขั้นแรกเกิดขึ้นก่อน
จากนั้นต้องใช้ผลิตภัณฑ์จากปฏิกิริยาที่เกิดขึ้นก่อนเป็นสารตั้งต้นของปฏิกิริยาขั้นต่อไป และต่อไปจนกว่าจะถึงปฏิกิริยาขั้นสุดท้าย เช่น การเผาไหม้ของซัลเฟอร์ทำให้เกิดก๊าซ SO2
ผสมอยู่ในบรรยากาศ เมื่อฝนตก ก๊าซ SO2 ก็จะละลายรวมตัวกับน้ำฝน กลายเป็นกรดซัลฟูรัส (H2SO3) น้ำฝนจึงมีสมบัติเป็นฝนกรด มีขั้นตอนดังนี้
ขั้นที่ 1 การเผาไหม้ของซัลเฟอร์ เกิด SO2
S + O2 → SO2
ขั้นที่ 2 SO2 ละลายในน้ำฝน กลายเป็นกรด H2SO3 (กรดซัลฟูรัส) ละลายรวมอยู่ในน้ำฝน
H2O + SO2 → H2SO3
การคำนวณเกี่ยวกับปริมาณสารจากสมการประเภทนี้ ต้องดุลสมการย่อยทุกสมการเช่นเดียวกับการดุลสมการเคมีที่ผ่านมาแล้ว จากนั้นให้สังเกตว่า ผลิตภัณฑ์จากปฏิกิริยาที่เกิดขึ้นก่อน
ที่นำมาใช้เป็นสารตั้งต้นของปฏิกิริยาขั้นต่อไปนั้นมีจำนวนโมลเท่ากันหรือไม่ ถ้าเท่ากันแสดงว่าปฏิกิริยาทั้งชุดเป็นปฏิกิริยาที่ได้รับการดุลอย่างต่อเนื่องกันแล้ว มีผลให้มาการทั้งชุดเสมือนหนึ่ง
เป็นสมการเดียวกัน เช่น
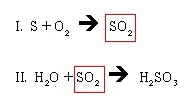
สังเกตจำนวนโมลของ SO2 ที่เกิดขึ้นในสมการ I. มีจำนวน 1 โมล และเมื่อนำมาใช้ในสมการ II. ก็มีจำนวน 1 โมลเช่นกัน ลักษณะนี้แสดงว่าสมการดุลแบบต่อเนื่องแล้ว
มีผลให้สมการทั้งชุดเสมือนเป็นสมการเดียวกัน จึงสามารถคำนวณเปรียบเทียบปริมาณสารข้ามสมการกันได้ เช่น
- ถ้าใช้ S จำนวน 1 โมล (สมการ I.) จะได้ผลิตภัณฑ์ H2SO3 จำนวน 1 โมลเช่นกัน (สมการ II.)
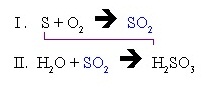
- ถ้ามี H2SO3 เกิดขึ้น 1 โมล (สมการ II.) จะต้องใช้ O2 จำนวน 1 โมลเช่นกัน (สมการ I.)
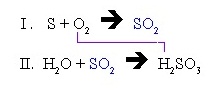
นอกจากนั้นแล้วเราสามารถรวมสมการทั้งหมดเข้าด้วยกันให้เหลือเป็นสาการเดียวก็ได้ เช่น
I. + II. ; S + O2 +H2O + SO2 → SO2 + H2SO4
สมการรวม ; S + O2 +H2O → H2SO4
เมื่อพิจารณาจากสมการรวม การเปรียบเทียบปริมาณสารต่าง ๆ ที่ทำปฏิกิริยากันและที่ได้จากปฏิกิริยาจะเห็นได้ชัดเจนกว่าขณะที่สมการยังแยกกันอยู่ เช่น
- ถ้าใช้ S จำนวน 1 โมล จะได้ผลิตภัณฑ์ H2SO3 จำนวน 1 โมลเช่นกัน

- ถ้ามี H2SO3 เกิดขึ้น 1 โมล จะต้อง O2 จำนวน 1 โมลเช่นกัน

ตัวอย่าง สิ่งที่ใช้ทำดอกไม้ไฟคือดินปืนซึ่งมีซัลเฟอร์เป็นส่วนประกอบที่สำคัญชนิดหนึ่ง สมมติว่าดอกไม้ไฟ 1 ชุด มีซัลเฟอร์เป็นส่วนประกอบอยู่ 320 กรัม อยากทราบว่า
ถ้าจุดดอกไม้ไฟชุดดังกล่าวนี้ จะมีโอกาสทำให้เกิดกรดซัลฟูรัสได้อย่างมากที่สุดกี่กรัม (H=1 O=16 S=32)
วิธีทำ ก่อนอื่นต้องดุลสมการย่อยและดุลสมการต่อเนื่องให้ถูกต้องเสียก่อน จากนั้นจึงพิจารณาว่าสิ่งที่กำหนดให้กับสิ่งที่ต้องการทราบอยู่ ณ ส่วนใดของสมการ
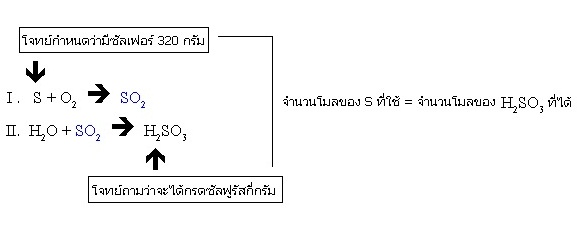
- การคำนวณปริมาณสารจากสมการเคมีทำได้หลายวิธี ขึ้นอยู่กับทักษะของแต่ละคน วิธีคิดดังที่แสดงเป็นตัวอย่างนี้เป็นวิธีที่ใช้กันทั่ว ๆ เมื่อเข้าใจดีแล้วจะใช้วิธีอื่น ๆ ได้อีก
- ขั้นแรกจะเปลี่ยนซัลเฟอร์ 320 กรัม ให้เป็นจำนวนโมลเสียก่อน เมื่อทราบจำนวนโมลของซัลเฟอร์ที่ใช้ก็จะทราบจำนวนโมลของ H2SO3 ที่ได้ จากนั้นเปลี่ยนจำนวนโมลของ H2SO3 ให้เป็นน้ำหนัก ก็จะได้คำตอบ
ถ้ามี S หนัก 32 กรัม คิดเป็น 1 โมล
ถ้ามี S หนัก 320 กรัม คิดเป็น = 10.0 โมล
จากสมการ จำนวนโมลของ H2SO3 ที่ได้ = จำนวนโมลของ S ที่ใช้
= 10.0 โมล
เปลี่ยนจำนวนโมลของ H2SO3 ให้เป็นน้ำหนัก
ถ้ามี H2SO3 จำนวน 1 โมล มีน้ำหนัก = 82 กรัม
ถ้ามี H2SO3 จำนวน 10 โมล มีน้ำหนัก = 82 x 10 = 820 กรัม
*ฉะนั้นการจุดดอกไม้ไฟ 1 ชุด ซึ่งมีซัลเฟอร์เป็นส่วนประกอบ 320 กรัม จะมีโอกาสทำให้เกิดกรดซัลฟูรัสได้สูงสุด 820 กรัม ตอบ
แต่ถ้าผลิตภัณฑ์จากปฏิกิริยาที่เกิดขึ้นก่อน ที่นำมาใช้เป็นสารตั้งต้นในปฏิกิริยาขั้นต่อไปยังมีจำนวนโมลไม่เท่ากัน แสดงว่าสมการทั้งชุดยังไม่ได้รับการดุลอย่างต่อเนื่อง
ยังคิดคำนวณเปรียบเทียบปริมาณสารข้ามสมการกันไม่ได้ ต้องดุลสมการให้ต่อเนื่องเสียก่อนโดยใช้ตัวเลขที่เหมาะสมคูณสมการเหล่านั้น เพื่อให้จำนวนโมลของสารดังกล่าวเท่ากัน
การดุลสมการต่อเนื่องมีผลให้สมการย่อยทั้งหมดเสมือนหนึ่งเป็นสมการเดียวกัน ทำให้เปรียบเทียบปริมาณสารที่อยู่ต่างสมการกันได้โดยตรง หรือจะนำมาเขียนรวมเป็นสมการเดียวก็ได้
เช่น การผลิต KMnO4 ประกอบด้วยปฏิกิริยา 2 ขั้น คือ
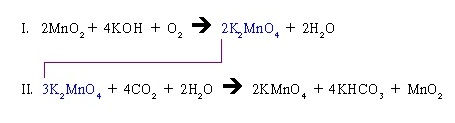
จะเห็นได้ว่า 2K2MnO4 จากสมการที่ I เมื่อนำมาใช้เป็นสารตั้งต้นในสมการที่ II กลายเป็น 3K2MnO4 กรณีนี้จำนวนโมลไม่เท่ากันแสดงว่าสมการยังไม่ดุลแบบต่อเนื่ง
จึงต้องดุลสมการแบบต่อเนื่อง โดยใช้ตัวเลขที่เหมาะสมคูณแต่ละสมการเพื่อทำให้จำนวนโมลของ K2MnO4 เท่ากันทั้ง 2 สมการ ซึ่งจะมีผลให้จำนวน
โมลของสารอื่น ๆ เปลี่ยนไปด้วย ดังนี้
คูณสมการ I ด้วย 3 คูณสมการ II ด้วย 2
I. 3(2MnO2 + 4KOH + O2 → 2K2MnO4 + 2H2O)
6MnO2 + 8KOH + 3O2 → 6K2MnO4 + 6H2O
II 2(3K2MnO4 + 4CO2 + 2H2O → 2KMnO4 + 4KHCO3 + MnO2)
6K2MnO4 + 8CO2 + 4H2O → 4KMnO4 + 8KHCO3 + 2MnO2
สมการที่ดุลแบบต่อเนื่องแล้วเป็นดังนี้
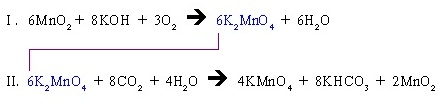
สมการย่อยทั้ง 2 สมการนี้เสมือนหนึ่งเป็นสมการเดียวกัน คำนวณเปรียบเทียบปริมาณสารทุกชนิดข้ามสมการกันได้ เช่น ถ้าต้องการ KMnO4 จำนวน 4 โมล จะต้องใช้ MnO2 6 โมล
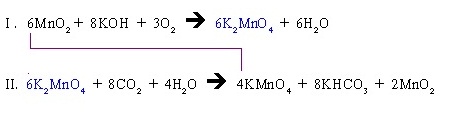
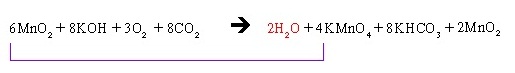
หรือจะนำสมการ I. + II. เพื่อให้เป็นสมการเดียวกันก็ได้ ดังนี้
6MnO2 + 8KOH + 3O2 + 6K2MnO4 + 8CO2 + 4H2O → 6K2MnO4 + 6H2O + 4KMnO4 + 8KHCO3 + 2MnO2
แบบฝึกหัด
1. ปฏิกิริยาในการเตรียม KMnO4 เป็นดังนี้
I. 2MnO2 + 4KOH + O2 → 2K2MnO4 + 2H2O
II 3K2MnO4 + 4CO2 + 2H2O → 2KMnO4 + 4KHCO3 + MnO2
ถ้าเริ่มต้นมี MnO2 174 กรัม จะเตรียม KMnO4 ได้มากที่สุดกี่กรัม (K = 39 Mn = 55 O = 16)
1. 210.67 2. 316.00 3. 348.00 4. 425.00
2. ในการหาปริมาณออกซิเจนในน้ำมีปฏิกิริยาเกิดขึ้นดังนี้
I. Mn(OH)2 + O2 → 2MnO2 + 2H2O
II. 2MnO2 + 4I- + 8H+ → 2Mn2+ + 2I2 + H2O
III. 2I2 + 4S2O32- → 2S4O62- + 4I-
เมื่อนำน้ำตัวอย่างที่ผ่านขั้นตอนที่ I และ II จำนวน 1,000 cm3 มาทำปฏิกิริยากับสารละลายโซเดียมไทโอซัลเฟต (Na2S2O3) ความเข้มข้น 0.005โมล/ลิตร (ปฏิกิริยาที่ III)
พบว่าต้อใช้สารละลายโซเดียมไทโอซัลเฟต 30 cm3 ปริมาณของออกซิเจนในน้ำเป็นกี่ mg/dm3
1. 1.2 2. 2.4 3. 3.6 4. 5.0
3. ในการผลิตโลหะไททาเนียมจาก TiO2 ทำได้โดยการผสม TiO2 กับผงถ่านและแก๊ส Cl2 แล้วเผาให้ร้อนจัด ปฏิกิริยาที่เกิดขึ้นเป็นดังสมการ
I. TiO2 + Cl2 + C → TiCl4 + CO2
II. TiCl4 + H2 → Ti + HCl
ถ้าใช้ TiO2 2.4 กรัม จะต้องใช้แก๊สไฮโดรเจนกี่ลิตรที่ STP (Ti = 48 Cl=35.5)
1. 0.672 2. 1.344 3. 5.376 4. 53.76
4. ในการถลุงแร่คาลโคไพไรต์ (CuFeS2) มีปฏิกิริยาเกิดขึ้นดังนี้
I. 2CuFeS2 + 4O2 → Cu2S + 2FeO + 3SO2
II. 2Cu2S + 3O2 → 2Cu2O + 2SO2
III. 2Cu2O + Cu2S → 6Cu + SO2
อยากทราบว่าเมื่อถลุงทองแดงได้ 1 กิโลกรัม จะมีแก๊ส SO2 ซึ่งเป็นแก๊สพิษเกิดขึ้นกี่กรัม
(Cu = 63.5 Fe = 56 O = 16 S = 32)
1. 1007.87 2. 1511.81 3. 2015.75 4. 6400.00
5. (Ent.42 มี.ค. อัตนัย) ในการทำลายแก๊ส SO2 โดยออกซิไดซ์เป็น SO3 แล้วละลายน้ำ จะได้กรด H 2 SO4 ถ้าได้กรด H2SO4 1.96 กิโลกรัม จะต้องใช้ก๊าซออกซิเจน
อย่างน้อยที่สุดกี่ dm3 ที่ STP
I. SO2 + O2 → SO3
II. SO3 + H2O → H2SO4
6. (Ent.42 มี.ค. อัตนัย) ในอุตสาหกรรมถลุงแร่ดีบุก โดยผสมแร่ดีบุกกับถ่านโค้ก ( C ) แล้วเผาให้ร้อนจัดในเตาถลุงที่มี O2 อยู่จำกัด ทำให้เกิดแก๊ส CO จากนั้นแก๊ส CO
จึงไปทำปฏิกิริยากับแร่ดีบุกดังสมการ
I. 2C + O2 → 2CO
II. SnO2 + 2CO → Sn + 2CO2
ถ้าในการถลุงครั้งหนึ่ง ผสมถ่านโคกกับแร่ดีบุกในอัตราส่วน 1:5 โดยมวล จงหาว่าเมื่อผลิตโลหะดีบุกได้ 119 kg จะมีถ่านโค้กเหลืออยู่กี่กิโลกรัม
7. (คัดเลือกเคมีโอลิมปิค 2543) เมื่อเผา Fe2O3 กับผงถ่านในบรรยากาศของก๊าซออกซิเจนจะได้ Fe กับก๊าซ CO2 ดังสมการเคมีที่ยังไม่ได้ดุล ถ้าเผา Fe2O3 80 kg
กับผงถ่าน 12 kg จะได้ Fe กี่กิโลกรัม
I. C(s) + O2(g) → CO(g)
II. CO(g) + Fe2O3(g) → Fe(s) + CO2(g)
1. 92 2. 54 3. 37 4. 28
8. (คัดเลือกเคมีโอลิมปิค 2544) การเตรียม KClO4 สามารถทำได้ดังปฏิกิริยาต่อไปนี้
I. Cl2 + KOH → KCl + KClO + H2O
II. 3KClO → 2KCl + KClO3
III. 4KClO3 → 3KClO4 + KCl
จะต้องใช้ Cl2 จำนวนกร่กรัมเพื่อเตรียม KClO4 จำนวน 200 กรัม
1. 205 2. 322 3. 409 4. 512
9. (Ent.47 มี.ค.) ในการเตรียมน้ำยาฟอกขาว (NaOCl) เข้มข้น 2.0 โมล/ลิตร โดยผ่านแก๊สคลอรีนที่ได้จากปฏิกิริยาระหว่าง KMnO4 กับ HCl ลงในสารละลาย
NaOH 100 cm3 ปฏิกิริยาที่เกิดขึ้นเป็นดังนี้
I. 2KMnO4 + 16HCl → 2KCl + 2MnCl2 + H2O + Cl2
II. Cl2 + NaOH → NaOCl + NaCl + H2O (สมการยังไม่ดุล)
จะต้องใช้ KMnO4 หนักกี่กรัม
1. 6.3 2. 12.7 3. 79.0 4. 126.4
10. (PAT.2 ต.ค. 51) กำหนดปฏิกิริยาต่าง ๆ ดังนี้
2Al + 2NaOH 2H2O → 2NaAlO2 + 3H2 ……………….(1)
NH4NO3 → N2O + 2H2O ……………………….(2)
H2 + N2O → H2O + N2 …………………(3)
เมื่อใช้ Al จำนวน 0.90 กรัม ทำปฏิกิริยากับ NaOH จำนวนมากเกินพอ ปรากฏว่าได้ H2 จำนวนหนึ่งซึ่งทำปฏิกิริยาพอดีกับ N2O ที่เกิดจากการสลายตัวของ
NH4NO3 มวลของ NH4NO3 ที่ใช้เป็นกี่กรัม (Al=27 Na=23 O=16 N=14 H=1)
1. 0.45 2. 1.40 3. 2.70 4. 4.00
11. (A-Net 49 อัตนัย ) เมื่อเผาแร่ AX2 ในบรรยากาศออกซิเจนและไฮโดรเจนตามลำดับ ได้โลหะ A ดังสมการ (สมการยังไม่ดุล)
AX2 + O2 → AO3 + XO2
AO3 + H2 → A + H2O
ถ้ากระบวนการเผาแร่ดังกล่าวใช้ AX2 1600 กรัม แก๊สออกซิเจน 120 กรัม จะได้โลหะ A มากที่สุดกี่กรัม (มวลอะตอมของ X = 32 A = 96)
รูปภาพที่เกี่ยวข้อง

Size : 6.64 KBs
Upload : 2013-08-08 06:18:17
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|