กรด-เบส ตอนที่ 4 ปฏิกิริยาระหว่างกรด-เบสและเกลือ
กรด-เบส (Acid – Base)
ตอนที่ 4
ปฏิกิริยาระหว่างกรด-เบส
จากทฤษฎีกรด-เบส
3
ทฤษฎีดังที่กล่าวไว้ในตอนแรก
ซึ่งมีข้อกำหนดในการแสดงความเป็นกรดหรือเบสแตกต่างกันอยู่บ้าง
ฉะนั้นเมื่อกล่าวถึงปฏิกิริยาระหว่างกรดกับเบสจึงต้องพิจารณาพร้อมกันไปด้วยว่าเป็นไปตามทฤษฎีใด
แต่อย่างไรก็ตามลักษณะของปฏิกิริยาระหว่างกรดกับเบสถ้าพิจารณากันในภาพรวมแล้ว
จะเป็นลักษณะของปฏิกิริยาในทางปริมาณสารสัมพันธ์ (Stoichiometry) เช่นเดียวกับปฏิกิริยาทั่ว ๆ
ไป เพียงแต่จำกัดชนิดของสารตั้งต้นว่าเป็นกรดกับเบสเท่านั้น ถ้าพิจารณาปฏิกิริยาระหว่างกรด – เบส
ตามทฤษฎีของอาร์รีเนียส
รูปแบบของปฏิกิริยาจะเป็นดังนี้
กรด
+ เบส
→ เกลือ +
น้ำ
เรียกปฏิกิริยาลักษณะนี้ว่า
Neutralization หรือปฏิกิริยาสะเทิน
มีผลิตภัณฑ์สำคัญที่เกิดขึ้นก็คือเกลือ
(คลิ้ก
ชมลักษณะของปฏิกิริยา Nutralization) (คลิ้ก ชมปฏิกิริยาระหว่างกรด-เบสเพิ่มเติม)
เกลือ (salt) เป็นสารไอออนิกที่ประกอบด้วยไอออนบวกของโลหะ
เช่น Na+ K+
Ba2+ Fe2+ Zn2+ …(รวมทั้ง NH4+) รวมตัวกับคู่เบสของกรด เช่น Cl- (เป็นคู่เบสของ HCl) , NO3- (เป็นคู่เบสของ HNO3) , CH3COO- (เป็นคู่เบสของ CH3COOH)…. เมื่อเกลือละลายน้ำ เกลือบางชนิดจะเกิดปฏิกิริยาไฮโดรไลซีส ทำให้สารละลายไม่เป็นกลาง
ปฏิกิริยาไฮโดรไลซีส
(Hydrolysis) คือปฏิกิริยาที่โมเลกุลของน้ำ (H2O) ทำปฏิกิริยากับอนุภาคของสารซึ่งละลายอยู่ในน้ำ ทำได้ 2
แบบคือ โมเลกุลของ
H2O ให้ H+ ให้แก่อนุภาคอื่น ทำให้กลายเป็น OH- กรณีนี้ H2O แสดงสมบัติเป็นกรด อีกแบบหนึ่งคือโมเลกุลของ H2O รับ
H+
จากอนุภาคอื่นทำให้กลายเป็น
H3O+ กรณีนี้ H2O แสดงสมบัติเป็นเบส เช่น
CH3COO- + H2O ↔ CH3COOH + OH- ; กรณีนี้ H2O แสดงสมบัติเป็นกรด
คือให้ H+ แก่ CH3COO-
NH4+ + H2O ↔ NH3
+ H3O+ ; กรณีนี้ H2O แสดงสมบัติเป็นเบส
คือรับ H+ จาก NH4+
เมื่อพิจารณาความเป็นไปได้ที่กรดหรือเบสแต่ละประเภทจะทำปฏิกิริยากันจะมี 4 แบบ
แต่ละแบบจะมีผลต่อความเป็นกรดหรือเบสของเกลือ (pH ของสารละลายเกลือ) ซึ่งเป็นผลิตภัณฑ์จากปฏิกิริยาระหว่างกรดกับเบสนั้น
ๆ ได้แก่
1. กรดแก่ + เบสแก่
เกลือที่ได้จากปฏิกิริยาจะเป็นกลาง (Neutral) หรือมี pH=7 เช่น
HCl + NaOH → NaCl
+ H2O
NaCl เป็นเกลือที่เกิดจากกรดแก่
+ เบสแก่
เมื่อละลายน้ำจะไม่เกิดปฏิกิริยาไฮโดรไลซีส
โมเลกุลของน้ำไม่มีการรับหรือเสีย
H+ ฉะนั้น
[H+]=[OH-] เช่นเดียวกับขณะที่เป็นน้ำบริสุทธิ์ สารละลายจึงเป็นกลาง pH = 7
เหมือนน้ำบริสุทธิ์
2. กรดแก่ + เบสอ่อน เกลือที่ได้จากปฏิกิริยาของกรด-เบสในลักษณะนี้ เมื่อละลายน้ำสารละลายจะมีสมบัติเป็นกรดอ่อน (weak acid) หรือมี
pH=<7 เพราะมีปฏิกิริยาไฮโดรไลซีสเกิดขึ้น
เช่น
HCl + NH4OH → NH4Cl + H2O
NH4Cl เป็นเกลือที่เกิดจากกรดแก่
+ เบสอ่อน
เกลือชนิดนี้เมื่อละลายน้ำแล้วจะเกิดปฏิกิริยาไฮโดรไลซีส การละลายในขั้นแรกจะเป็นดังสมการ
NH4Cl → NH4+ + Cl-
การเปลี่ยนแปลงในขั้นต่อไปจะเป็นการเกิดปฏิกิริยาไฮโดรไลซีส ในเบื้องต้นจะสับสนว่าอนุภาคใดเป็นตัวเกิดปฏิกิริยาไฮโดรไลซีส ให้จำเป็นหลักการเอาไว้ว่า อนุภาคที่มาจากเบสอ่อนเป็นตัวเกิดปฏิกิริยาไฮโดรไลซีส แต่แสดงสมบัติเป็นกรดอ่อน ดังสมการ
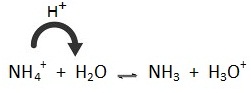
ผลจากการเกิดปฏิกิริยาไฮโดรไลซีสทำให้ในสารละลายมี H3O+ เพิ่มขึ้น มีผลให้ [H3O+ ] >
[OH-] สารละลายจึงมีสมบัติเป็นกรดอ่อน pH
< 7 ถ้าต้องการทราบว่าสารละลายมี pH เท่าไร
ต้องทราบความเข้มข้นของสารละลาย
และทราบค่า Ka ของคู่เบส กรณีนี้ก็คือ Ka ของ
NH4+ = 5.6 X 10-12 แต่บางครั้งอาจไม่บอกค่า Ka มาโดยตรง
แต่บอกค่า Kb ของ NH4OH หรือ NH3 = 1.8 X 10-5 เราสามารถคำนวณหาค่า Ka ได้
จากสมการ Ka.Kb = Kw
Ka = Kw / Kb = (1.0 x 10-14 )/(1.8 x 10-5) = 5.6 X 10-12
ถ้าสารละลายมีความเข้มข้น 1.00 โมล/ลิตร pH ของสารละลายจะคิดได้ดังนี้
จากภาวะสมดุล ดังสมการ ; NH4+ + H2O ↔ NH3 + H3O+ ; Ka = 5.6
X 10-12
คำนวณหา [H3O+
] เพื่อใช้หา pH ของสารละลายดังนี้
Ka = [NH3] [H3O]+ / [NH4+]
5.6 X 10-12 = [H3O+]2 / [NH4+]
[H3O+]2 =
5.6 X 10-12
[H3O+] = 2.37 X 10-6
pH =
- log 2.37 X 10-6
=
6 log 10 - log 2.37
=
6
- 0.37
=
5.63
3. กรดอ่อน + เบสแก่ เกลือที่ได้จากปฏิกิริยาจะเป็นเบสอ่อน (weak base) หรือมี pH >7 เช่น
CH3COOH + NaOH ↔ CH3COONa + H2O
CH3COONa เป็นเกลือที่เกิดจากกรดอ่อน + เบสแก่
เกลือชนิดนี้เมื่อละลายน้ำแล้วจะเกิดปฏิกิริยาไฮโดรไลซีส การละลายในขั้นแรกจะเป็นดังสมการ
CH3COONa → CH3COO- + Na+
การเปลี่ยนแปลงในขั้นต่อไปเป็นการเกิดปฏิกิริยาไฮโดรไลซีส
ในเบื้องต้นจะสับสนว่าอนุภาคใดเป็นตัวเกิดปฏิกิริยาไฮโดรไลซีส ให้จำเป็นหลักการเอาไว้ว่า อนุภาคที่มาจากกรดอ่อนจะเป็นตัวเกิดปฏิกิริยาไฮโดรไลซีส แต่แสดงสมบัติเป็นเบสอ่อน ดังสมการ
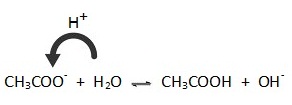
ผลจากการเกิดปฏิกิริยาไฮโดรไลซีสทำให้ในสารละลายมี OH- เพิ่มขึ้น มีผลให้ [OH-] > [H3O+ ] สารละลายจึงมีสมบัติเป็นเบสอ่อน
ถ้าต้องการทราบ pH ของสารละลาย
ต้องทราบความเข้มข้นของสารละลาย
และทราบค่า Kb ของคู่กรด กรณีนี้ก็คือ Kb ของ
CH3COO-
= 5.6 X 10-12 แต่บางครั้งอาจไม่บอกค่า Kb มาโดยตรง
แต่บอกค่า Ka ของ CH3COOH = 1.8 X 10-5 เราสามารถคำนวณหาค่า Kb ได้
จากสมการ Ka.Kb = Kw
Kb = Kw / Ka = (1.0 x 10-14) / (1.8 x 10-5) = 5.6 X 10-12
ถ้าสารละลายมีความเข้มข้น 1.00 โมล/ลิตร pH ของสารละลายจะคิดได้ดังนี้
จากภาวะสมดุล ดังสมการ ; CH3COO- + H2O ↔ CH3COOH + OH- ;
Kb = 5.6 X 10-12
คำนวณหา [OH- ] เพื่อใช้หา
pOH และ pH ของสารละลายดังนี้
Kb = [CH3COOH][OH-] / [CH3COO-] = [OH-]2 / [CH3COO-]
5.6 X 10-12 = [OH-]2 / 1
[OH-]2 =
5.6 X 10-12
[OH-] =
2.37 X 10-6
pOH = - log 2.37 X 10-6
= 6 log 10 - log 2.37
= 6
- 0.37
=
5.63
pH =
14 – pOH
=
14 - 6.63
=
8.37
4. กรดอ่อน + เบสอ่อน
เกลือที่ได้จากปฏิกิริยาจะเป็นกรดอ่อนหรือเบสอ่อนต้องเปรียบเทียบที่ค่า Ka และ Kb ของกรดอ่อนและเบสอ่อนที่ทำปฎิกิริยากัน
4.1 ถ้า Ka>Kb เกลือที่ได้จากปฏิกิริยาจะเป็นกรดอ่อน
(weak acid) หรือมี pH <7 เช่น
กรดอ่อน ; HCOOH ↔ HCOO- +
H+ ; Ka = 1.77 x 10-4
เบสอ่อน ;
NH4OH ↔ NH4+ + OH- ;
Kb = 1.8 x 10-5
ปฏิกิริยาระหว่าง กรดอ่อน + เบสอ่อน ; HCOOH +
NH4OH ↔ HCOONH4 + H2O
HCOONH4
คือเกลือที่เกิดจากปฏิกิริยาระหว่าง กรดอ่อน + เบสอ่อน ซึ่งมีค่า Ka>Kb เกลือชนิดนี้เมื่อละลายน้ำจะมีสมบัติเป็นกรดอ่อน โดยคู่กรดของ HH4OH คือ
NH4+
จะเป็นตัวเกิดปฏิกิริยาไฮโดรไลซีสแสดงสมบัติเป็นกรดอ่อน ดังสมการ
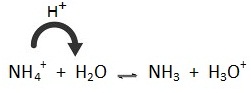
สารละลายที่ได้จะมี pH < 7
ถ้าต้องการทราบว่ามี pH เท่าไร
ต้องทราบความเข้มข้นของสารละลาย (สมมติว่า = 1M) และต้องทราบค่า Ka ของคู่กรดของเบสอ่อน ในที่นี้ก็คือ Ka ของ NH4+ ถ้าไม่บอกค่าดังกล่าวมาโดยตรง แต่บอกค่า Kb ของ NH4OH = 1.8 x
10-5 จะหา Ka ของ NH4+ ได้จากสมการ Ka.Kb
= Kw ดังนี้ ;
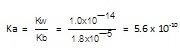
แสดงด้วยภาวะสมดุลดังนี้ ; NH4+ + H2O ↔ NH3 + H3O+ ; Ka
= 5.6 x 10-10
คำนวณหา [H3O+
] เพื่อใช้หา pH ของสารละลายดังนี้
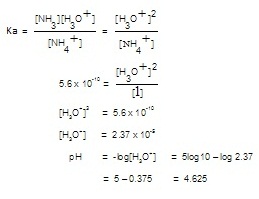
4.2
ถ้า Kb>Ka เกลือที่ได้จากปฏิกิริยาจะเป็นเบสอ่อน
(weak base) หรือมี pH >7 เช่น
เบสอ่อน ;
NH4OH NH4+ + OH- ;
Kb = 1.8 x 10-5
กรดอ่อน ; HCN H+ + CN-
;
Ka = 6.17 x 10-10
ปฏิกิริยาระหว่าง กรดอ่อน
+ เบสอ่อน ; HCN + NH4OH NH4CN + H2O
NH4CN
คือเกลือที่เกิดจากปฏิกิริยาระหว่างกรดอ่อน + เบสอ่อน ซึ่งเบสอ่อนมีค่า
Kb > Ka เกลือชนิดนี้เมื่อละลายน้ำคู่เบสของกรด HCN คือ CN- จะเป็นตัวเกิดปฏิกิริยาไฮโดรไลซีสโดยแสดงสมบัติเป็นเบสอ่อน ดังสมการ
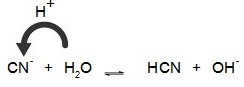
สารละลายจะเป็นเบสอ่อน pH > 7 ถ้าต้องการทราบว่าสารละลายมี pH เท่าไร
ต้องทราบความเข้มข้นของสารละลาย (สมมติว่า = 1M) และต้องทราบค่า Kb ของคู่เบสของกรด HCN ในที่นี้ก็คือ Kb ของ
CN- ถ้าไม่บอกค่าดังกล่าวมาโดยตรง จะหาได้จากสมการ Ka.Kb
= Kw
Kb = Kw / Kb = 1.0 x 10-14 / 6.17 x 10-10 = 3.08 x 10-5
แสดงด้วยภาวะสมดุลดังนี้
; CN- + H2O ↔ HCN
+ OH- ;
Kb = 3.08 x 10-5
คำนวณหา [OH-
] เพื่อใช้หา pOH แล้วเปลี่ยนเป็น pH ของสารละลาย ดังนี้
Kb = [HCN][OH-] / [CN-]
= [OH-]2 / [CN-]
3.08 x 10-5 = [OH-]2 / 1
[OH-]2 =
3.08 x 10-5
[OH-]
= 1.75 x 10-2.5
pOH
= -log [OH-] = -log
1.75 x 10-2.5
=
2.5 – log 1.75
=
2.5 - 0.24
=
2.26
pH
=
14 - pOH
=
14 - 2.26
=
11.74
แบบฝึกหัด
1. Consider the reaction: CH3NH2(aq) + H2O(l)
↔ CH3NH3+(aq)
+ OH-(aq)
where
Kb = 4.4 X 10-4. To a solution formed from the
addition of 2.0 mol CH3NH2 to 1.0 L of H2O is added 1.0 mol of KOH
(assume no
volume change on addition of solutes). What is the concentration of CH3NH3+ at equilibrium?
(พิจารณาปฏิกิริยา CH3NH2(aq) + H2O(l)
↔ CH3NH3+(aq)
+ OH-(aq)
; Kb = 4.4 X 10-4. ถ้าสารละลายชนิดหนึ่งเกิดจากใช้ CH3NH2 จำนวน 2.0 โมล
ทำให้เป็นสารละลาย 1.0 ลิตร
จากนั้นเติม KOH ลงไป 1.0 โมล
อยากทราบว่าเมื่อยู่ในภาวะสมดุลแล้วความเข้มข้นของ CH3NH3+
จะเป็นเท่าไร)
(A) 3.2 x 10-2 M (B) 2.2 x 10-4 M (C) 2.0 x 10-3 M
(D) 8.8 x 10-4 M (E) None of these
2. The Kb value of the oxalate ion, C2O42-,
is 1.85 X 10-10. Is a solution of K2C2O4 acidic, basic, or neutral?
Explain.
(ถ้า C2O42- มีค่า Kb =1.85 X 10-10 อยากทราบว่าสารละลาย K2C2O4 จะมีสมบัติเป็นกรด เป็นเบส หรือเป็นกลาง)
3. Consider the following compounds and suppose
that 0.5 M solutions are prepared of each: NaI, KF,
(NH4)2SO4,
KCN, HC2H3O2, CsNO3, and KBr. Write
the formulas of those that are (a) acidic, (b) basic, (c)
neutral. (จงพิจารณาว่าเมื่อเตรียมสารละลายของสารแต่ละชนิดได้แก่ NaI, KF, (NH4)2SO4,
KCN, HC2H3O2, CsNO3,
และ KBr ให้มีความเข้มข้น 0.5 M อยากทราบว่าสารละลายใดบ้างมีสมบัติเป็นกรด เป็นเบส
หรือเป็นกลาง)
4. Complete and balance the following
neutralization / acid-base reactions: (จงเขียนและดุลสมการให้สมบูรณ์)
a) NaOH
+ H2CO3 →
b) H2SO4 +
Ba(OH) 2 →
c) H2S +
KOH →
d) Al(OH) 3 +
HBr →
5. Write a balanced the following acid-base reactions: (จงเขียน
a) KOH
+ H2SO4 →
b) HNO3 +
Ba(OH)2 →
c) H2CO3 +
Al(OH)3 →
d) Ca(OH)2 +
HCl →
6. Given a salt, predict an acid-base pair which
would produce the salt:
(จงพิจารณาว่าเกลือแต่ละชนิดต่อไปนี้
เกิดจากกรด-เบส
ชนิดใดทำปฏิกิริยากัน)
a) Al2(SO4)3 c) CaCl2
b)
NH4F d)
KBr
7.
If in
the reaction shown above, 25.0 mL of
0.50 Molar HCl is used to neutralize 17.0 mL of NaOH, what is the
molarity of the NaOH? (สารละลาย HCl ความเข้มข้น 0.5M จำนวน 25.0 mL ทำปฏิกิริยาพอดีกับสารละลาย NaOH
17.0 mL อยากทราบว่าสารละลาย NaOH มีความเข้มข้นกี่โมลาร์)
8.
If in
the reaction shown above, 23.5 mL of
0.55 Molar NaOH is used to neutralize 33.0 mL of HCl, what is the
molarity of the HCl? (สารละลาย NaOH ความเข้มข้น 0.55M จำนวน 23.5 mL ทำปฏิกิริยาพอดีกับสารละลาย HCl
33.0 mL อยากทราบว่าสารละลาย HCl มีความเข้มข้นกี่โมลาร์)
9. What is the concentration of a sodium
hydroxide solution when 30.0mL of 0.50M hydrochloric acid are needed
to neutralize 50.0mL of the base? (สารละลายกรดไฮโดรคลอริกความเข้มข้น 0.50M
จำนวน 30.0 mL ทำปฏิกิริยา
พอดีกับสารละลายโซเดียมไฮดรอกไซด์ 50.0
mL
อยากทราบว่าสารละลายโซเดียมไฮดรอกไซด์มีความเข้มข้นกี่โมลาร์)
10.
What is the
concentration of acetic acid in vinegar when 32.5mL of 0.56M sodium hydroxide
is needed to
neutralize 15.0mL of the vinegar? (สารละลายโซเดียมไฮดรอกไซด์ความเข้มข้น 0.56M จำนวน 32.5mL ทำ
ปฏิกิริยาพอดีกับสารละลายน้ำส้มสายชู 15.0mL
อยากทราบว่าสารละลายน้ำส้มสายชูมีความเข้มข้นกี่โมลาร์)
11.
List the conjugate acids of: (that means the
following would behave like bases…) (จงพิจารณาว่าจากอนุภาคที่
กำหนดให้แต่ละชนิดต่อไปนี้ คู่กรดของมันคืออะไร ,หมายความว่าอนุภาคที่กำหนดให้นี้แต่ละชนิดแสดงสมบัติเป็นเบส)
a) H2O b) NH3 c)
OH- d)
HPO42-
12. List
the conjugate bases of: (that means the following would behave like acids…)(จงพิจารณาว่าจากอนุภาคที่
กำหนดให้แต่ละชนิดต่อไปนี้ คู่เบสของมันคืออะไร ,หมายความว่าอนุภาคที่กำหนดให้นี้แต่ละชนิดแสดงสมบัติเป็นกรด)
a) H2O b) HS- c) HCl d) NH4+
13. Determine the pH of 0.05 M CH3COONa. (Ka = 1.8 x 10-5 for acetic acid) (สารละลาย CH3COONa ความเข้มข้น
0.05 M
มี
pH เท่าไร ถ้า
Ka ของกรดแอซิติก = 1.8 x 10-5 ) (ตอบ 8.7)
14.
Determine the pH of 0.05 M NH4NO3. (Kb= 1.8 x 10-5 for ammonia) (สารละลาย NH4NO3 ความเข้มข้น 0.05M มี pH เท่าไร
ถ้าค่า Kb ของแอมโมเนียคือ 1.8 x 10-5) (ตอบ
5.3)
15.
Calculate the pH of a solution prepared by dissolving 10.5 g of NaF in
500.0 mL of water.
(Ka of HF = 7.0 x 10-4) (ถ้าใช้ NaF
10.5 กรัม ทำให้เป็นสารละลาย 5oo mL
อยากทราบว่าสารละลายจะมี pH เท่าไร
ถ้า Ka ของ
HF = 7.0 x 10-4 ) (ตอบ 8.9)
16.. Aspirin is
acetylsalicylic acid, a monoprotic acid whose Ka value is 3.27 X 10-4. Does
a solution of the sodium
salt of aspirin in water
test acidic, basic, or neutral? Explain (ยาแอสไพรินเป็นสารที่มีชื่อว่า
acetylsalicylic acid มี
สมบัติเป็นกรดโมโนโปรติก มีค่า
Ka = 3.27 x 10-4 อยากทราบว่าถ้านำเกลือโซเดียมของแอสไพรินมาละลายน้ำแล้ว
สารละลายจะมีสมบัติเป็นกรด หรือเบส
หรือเป็นกลาง เพราะเหตุใด)
17. Calculate
the pH of a 0.10 M NaC2H3O2 solution. Ka for HC2H3O2 = 1.8 x 10-5. (จงคำนวณค่า pH ของสารละลาย
NaC2H3O2 ความเข้มข้น 0.10M
กำหนดค่า
Ka ของ HC2H3O2 = 1.8
x 10-5)
18. 3.2
M sulfuric acid is used to neutralize 75.0 mL of 2.1 M potassium hydroxide.
(a)
What mass of water is produced?
(b) what volume of sulfuric acid must be
used?
(c) How many sulfate ions are in solution (do not answer in moles)?
(d) If the volumes of the solutions are
‘additive’ (total volume = sum of added volumes),
what is the molarity of potassium
sulfate after the reaction?
(สารละลายกรดซัลฟิวริกความเข้มข้น 3.2M
ทำปฏิกิริยาพอดีกับสารละลายโพแทสเซียมไฮดรอกไซด์ความเข้มข้น 2.1M
จำนวน 75.0
mL จงตอบคำถามต่อไปนี้
(a). มีน้ำเกิดขึ้นกี่กรัม
(b). ต้องใช้สารละลายกรดซัลฟิวริกกี่ mL
(c). มีซัลเฟตไอออนเกิดขึ้นในสารละลายกี่ไอออน
, ไม่ให้ตอบเป็นโมล
(d). ถ้าสารละลายมีปริมาตรเท่ากับผลรวมของปริมาตรของกรดและเบสที่นำมาผสมกัน
อยากทราบว่าเมื่อปฏิกิริยาสิ้นสุดแล้วความเข้มข้นของโพแทสเซี่ยมซัลเฟตเป็นกี่โมลาร์)
(คำตอบ : a) 2.8 g b) 25 mL
c) 4.7x1022 d)
0.79 M )
19. The base anhydride
calcium oxide, CaO can be added to water to make a solution of calcium
hydroxide. If
the solubility of calcium hydroxide
is 0.509 g/L at room temperature, ?
(a)
what mass of calcium hydroxide is
needed to make 2.50 L of saturated
solution?
(b) how many grams of calcium oxide
are needed to produce
2.50 L of saturated solution?
(c) what is the molarity of OH¯ in the
saturated solution?
(เมื่อใส่ CaO ลงในน้ำจะได้สารละลายแคลเซียมไฮครอกไซด์ ถ้าสภาพการละลายของแคลเซียมไฮดรอกไซด์ ณ
อุณหภูมิห้องคือ 0.0509 g/L จงตอบคำถามต่อไปนี้
(a) ถ้าต้องการเตรียมสารละลายอิ่มตัวของแคลเซียมไฮดรอกไซด์
จำนวน 2.50 L จะต้องใช้แคลเซียมไฮดรอกไซด์กี่กรัม
(b)
ถ้าต้องการเตรียมสารละลายอิ่มตัวของแคลเซียมไฮดรอกไซด์
จำนวน 2.50 L จะต้องใช้แคลเซียมออกไซด์กี่กรัม
(c) ความเข้มข้นของ OH- ในสารละลายอิ่มตัวเป็นกี่โมลาร์
(คำตอบ : a. 1.27
g b. 0.963 g c. 0.0138 M)
รูปภาพที่เกี่ยวข้อง

Size : 6.07 KBs
Upload : 2013-09-05 19:23:10
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|