พันธะเคมี ตอนที่ 10 พลังงานพันธะและความยาวพันธะ
พลังงานพันธะ (bond energy)
การสร้างพันธะเคมีเป็นกระบวนการที่จะทำให้อะตอมมีความเสถียรขึ้นกว่าเดิม
ความเสถียรมีความสัมพันธ์กับระดับพลังงานของอะตอม อะตอมที่มีพลังงานต่ำจะเสถียรกว่าอะตอมที่มีพลังงานสูง การสร้างพันธะเคมีจะเกิดขึ้นพร้อมการคายพลังงานจำนวนหนึ่งออกมา จึงมีผลให้อะตอมที่สร้างพันธะเคมีแล้วจะมีพลังงานต่ำกว่าก่อนการสร้างพันธะ จึงมีความเสถียรเพิ่มขึ้น
แต่ถ้าอะตอมใดมีพลังงานต่ำอยู่แล้วก็ไม่จำเป็นต้องสร้างพันธะ เช่น
อะตอมของธาตุหมู่ 8A พลังงานที่คายออกมาเมื่อมีการสร้างพันธะเรียกว่าพลังงานพันธะ
(Bond
energy) ให้สังเกตว่ามีหน่วยเป็น kJ/mol หรือ MJ/mol คำว่า mol หมายถึงสิ่งใด ๆ จำนวน 6.02 x 1023 อนุภาค นักวิทยาศาสตร์มีข้อตกลงว่าพลังงานพันธะของพันธะต่าง
ๆ
ให้คิดจากพลังงานที่คายออกมาเมื่อมีการสร้างพันธะนั้น ๆ จำนวน
6.02 x 1023 พันธะ หรือ 1
โมลพันธะ หน่วยของพลังงานจึงมีคำว่า
...../ โมล กำกับไว้ ดังตัวอย่าง
|
พันธะ
|
พลังงานพันธะ(kJ/mol)
|
พันธะ
|
พลังงานพันธะ(kJ/mol)
|
|
H-H
|
436
|
C-O
|
358
|
|
H-F
|
467
|
C=O
|
745
|
|
H-Cl
|
431
|
S-S
|
255
|
|
H-Br
|
361
|
F-F
|
159
|
|
H-I
|
298
|
Cl-Cl
|
242
|
|
H-O
|
436
|
Br-Br
|
193
|
|
N-H
|
391
|
I-I
|
151
|
|
N-N
|
163
|
S-F
|
327
|
|
N=N
|
418
|
S-H
|
367
|
|
NΞN
|
945
|
O-O
|
146
|
|
N-O
|
201
|
O=O
|
498
|
|
N-F
|
270
|
Cl-F
|
146
|
|
N-Cl
|
200
|
Br-Cl
|
281
|
|
C-H
|
413
|
I-Cl
|
210
|
|
C-C
|
348
|
I-Br
|
178
|
|
C=C
|
614
|
C-N
|
305
|
|
CC
|
839
|
C=N
|
615
|
|
C-Cl
|
339
|
CN
|
891
|
|
C-Br
|
270
|
C=S
|
477
|
ถ้าต้องการทราบว่าเมื่อมีการสร้างพันธะนั้น
ๆ เพียง 1 พันธะจะมีการคายพลังงานเท่าไร ก็สามารถคิดได้จากนำพลังงานพันธะนั้น ๆ หารด้วย
6.02
X 1023 เช่น
พลังงานที่คายออกมาจากการสร้างพันธะ H-H เพียง 1
พันธะ
จะมีค่าเท่ากับ 436 / 6.02 x 1023 = 71.76 X 10-24 kJ
= 7.176 x 10-23 kJ
ในทางกลับกันเมื่อต้องการแยกสลายพันธะต่าง ๆ เพื่อทำให้อะตอมแยกออกจากกันไป กลายเป็นอะตอมอิสสระไม่มีพันธะ ก็จะต้องใช้พลังงานเท่ากับพลังงานที่คายออกมาเมื่อมีการสร้างพันธะนั้น
ๆ คืนกลับเข้าไป พันธะก็จะแยกสลายออกเป็นอะตอมอิสสระอีกครั้งหนึ่งและอะตอมจะมีพลังงายสูงตามเดิม เมื่อเขียนในรูปสมการเคมีจะเป็นดังนี้
** การสร้างพันธะแสดงด้วยสมการเคมี ดังนี้
2H(g) → H2(g) + 432 kJ/mol
หรือ H(g) + H(g) → H-H(g)
+ 432 kJ/mol
** ความหมายของสมการเคมีนี้ก็คือ อะตอมของ H ในภาวะก๊าซจำนวน 2
โมลอะตอม คือ 2(6.02 x 1023) อะตอม สร้างพันธะกันเป็นโมเลกุลของ H2 จำนวน
1 โมลโมเลกุล คือ 6.02
x 1023 โมเลกุล คายพลังงานออกมา 432 kJ
** ถ้าใช้สัญลักษณ์ แทนพลังงานที่คายออกมา จะเป็นดังนี้
; 2H(g)
→ H2(g) , = - 432 kJ/mol
(เครื่องหมายลบหมายความว่าคายพลังงาน ไม่ใช่ค่าเป็นลบ)
** การสลายพันธะแสดงด้วยสมการเคมี ดังนี้
H2(g) + 432 kJ/mol
→ 2H(g)
หรือ H-H(g)
+ 432 kJ/mol
→ H(g) + H(g)
** ความหมายของสมการเคมีนี้ก็คือ โมเลกุลของ H2 ในภาวะก๊าซจำนวน 1
โมเลกุล คือ 6.02 x 1023
โมเลกุล เมื่อได้รับพลังงาน 432
kJ ทำให้แยกสลายพันธะ กลายเป็นอะตอมของ H
จำนวน 2 โมลอะตอม
คือ 2(6.02 x 1023) อะตอม
** ถ้าใช้สัญลักษณ์ ΔH แทนพลังงานที่เกี่ยวข้อง จะเป็นดังนี้
; H2(g) → 2H(g)) , ΔH = + 432 kJ/mol
(เครื่องหมาย + แสดงว่าเป็นการดูดพลังงานเข้าไป)
พลังงานพันธะเป็นพลังงานศักย์รูปแบบหนึ่ง กล่าวกันว่าพลังงานทั้งหลายในโลกของเรานี้
(ยกเว้นนิวเคลียร์) เป็นพลังงานงานที่มีต้นกำเนิดมาจากดวงอาทิตย์ แสดงว่าว่าพลังงานจาก
น้ำมันและก๊าซธรรมชาติ ถ่านหิน
ถ่านจากไม้
พลังงานน้ำจากเขื่อน พลังงานจากลม... ต้นกำเนิดของพลังงานก็คือดวงอาทิตย์ ถ้าไม่เข้าใจกระบวนการทางพันธะเคมี ก็จะไม่ทราบว่าเป็นไปได้
อย่างไร อธิบายได้ดังนี้
เริ่มต้นจากกระบวนการสังเคราะห์ด้วยแสงของพืช แสงอาทิตย์มีพลังงานมากแต่เราเก็บเอาไว้โดยตรงไม่ได้ เช่น
เก็บแสงสว่างเอาไว้ใช้ตอนกลางคืนไม่ได้
แต่กระบวนการสังเคราะห์ด้วยแสง
ของพืชจะเก็บพลังงานแสงอาทิตย์เอาไว้ในพันธะที่มีอยู่ในโมเลกุลของ C6H12O6 ดังรูป
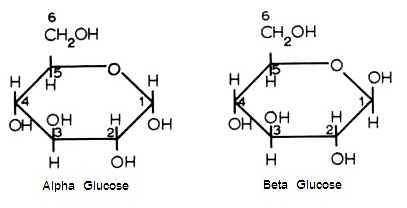
C6H12O6 มีโครงสร้างโมเลกุล 2
แบบ ความแตกต่างอยู่ที่หมู่ -OH ที่
C อะตอมหมายเลข 1
แบบซ้ายเรียกว่า alpha glucose
โครงสร้างนี้เมื่อเป็นน้ำตาลเชิงซ้อนจะเป็นแป้ง
(starch)
ดังรูป
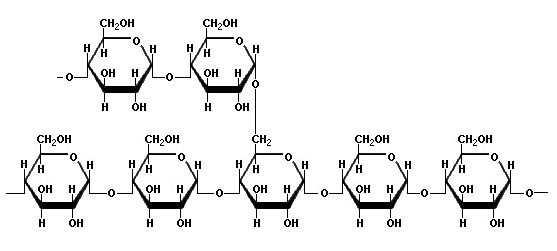 สำหรับกลูโคสที่มีโครงสร้างโมเลกุลดังรูปด้านขวา เรียกว่า beta glucose โครงสร้างนี้เมื่อเป็นน้ำตาลเชิงซ้อน จะเป็นเซลลูโลส (cellulose) ดังรูป สำหรับกลูโคสที่มีโครงสร้างโมเลกุลดังรูปด้านขวา เรียกว่า beta glucose โครงสร้างนี้เมื่อเป็นน้ำตาลเชิงซ้อน จะเป็นเซลลูโลส (cellulose) ดังรูป
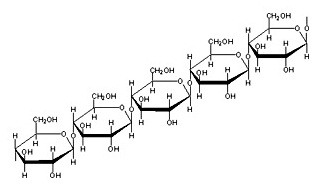
นอกจากนี้แล้วพืชยังสามารถผลิตน้ำมันและโปรตีนรวมทั้งสารชีวโมเลกุลชนิดอื่น
ๆ ได้ด้วย
สิ่งที่พืชผลิตหรือสังเคราะห์ขึ้นมาได้นี้
เมื่อเป็นอาหารของสัตว์ก็จะถ่ายเทไปสะสมอยู่ในร่างกายของสัตว์ และมีอีกจำนวนมากที่กระบวนการในร่างกายของสัตว์ผลิตขึ้นได้อีก เมื่อสิ่งมีชีวิตทั้งพืชและสัตว์ถูกฝังกลบ (จะด้วยเหตุผลใดก็ตาม)
อยู่ใต้พื้นโลกในภาวะที่ขาด O2
สารชีวโมเลกุลจะแปรสภาพเป็นก๊าซธรรมชาติและปิโตรเลียม ซากพืชอาจเปลี่ยนเป็นถ่านหิน เป็นแหล่งพลังงานสำคัญของโลก แต่จะเห็นได้ว่าพลังงานเหล่านี้มีจุดเริ่มต้นมาจากกระบวนการสังเคราะห์ด้วยแสงของพืช แล้วเก็บพลังงานแสงเอาไว้ในรูปของพลังงานพันธะ จึงกล่าวได้ว่าพลังงานต่าง ๆ
ที่ใช้กันอยู่ในโลกเป็นพลังงานที่ได้จากดวงอาทิตย์ กระบวนการสังเคราะห์ด้วยแสงของพืชอาจแสดงด้วยสมการเคมีอย่างง่าย ดังนี้
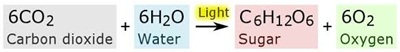
ยังถือว่าเป็นเรื่องยากที่จะทำความเข้ากระบวนการนี้ในขณะนี้ แต่เป็นสิ่งที่ทำความเข้าใจได้และก็จะต้องเข้าใจให้ได้ด้วย
ก่อนอื่นต้องทราบความหมายของสมการเคมีเสียก่อน สมการมีความหมายว่า ก๊าซ CO2 ทำปฏิกิริยากับ H2O ได้
C6H12O6 และ
ก๊าซ O2 กระบวนการนี้เป็นความสามารถพิเศษของพืช สัตว์รวมทั้งมนุษย์ทำไม่ได้ เพราะกระบวนการของมนุษย์เมื่อทำให้น้ำกับก๊าซคาร์บอนไดออกไซด์รวมตัวกัน
สิ่งที่ได้จะเป็นน้ำโซดาหรือน้ำอัดลมเท่านั้น
สิ่งที่จะต้องทำความเข้าใจให้ถูกต้องก็คือ การกล่าวถึงปริมาณของสารแต่ละชนิดในสมการเคมี ให้สังเกตตัวเลขที่อยู่ด้านหน้าของสารแต่ละชนิดว่าเป็นเลขอะไร ถ้าไม่มีตัวเลขให้ถือว่ามีเลข 1
ใช้ตัวเลขดังกล่าวในการบอกปริมาณของสารแต่ละชนิดในปฏิกิริยานั้น ๆ ซึ่งมี
2 แบบ คือ บอกด้วยจำนวนโมเลกุลและบอกด้วยจำนวนโมล (mole) จากสมการแสดงการสังเคราะห์ด้วยแสงของพิช ถ้าบอกปริมาณสารด้วยจำนวนโมเลกุลจะเป็นดังนี้

ถ้าบอกปริมาณสารด้วยจำนวนโมลจะเป็นดังนี้
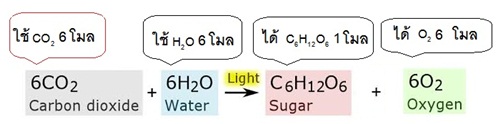
** คำว่าโมล (mole) เป็นหน่วยที่ใช้บอกปริมาณสารจำนวนมาก
ๆ สาร
1
โมลหมายถึงสารที่มีจำนวนอนุภาคเท่ากับ
6.02 x 1023 อนุภาค เรียกตัวเลขนี้ว่าเลขอาโวกาโดร
(คำว่าอนุภาคอาจหมายถึงจำนวนโมเลกุล จำนวนอะตอมหรือจำนวนไอออน หรืออื่น ๆ ก็ได้ จำนวนโมลของสารยังสามารถเปลี่ยนเป็นน้ำหนัก
หรือเปลี่ยนเป็นปริมาตรสำหรับสารที่เป็นก๊าซก็ได้
ในการเกิดปฏิกิริยาของการสังเคราะห์ด้วยแสงจะมีปฏิกิริยา 2
ส่วนคือ ส่วนแรกเป็นการสลายพันธะใน CO2 และ
H2O การสลายพันธะจะดูดพลังงานจากภายนอกเข้าไป ได้แก่พลังงานจากแสงอาทิตย์พลังงานที่ดูดเข้าไปจะมีจำนวนมาก จากนั้นจะมีการสร้างพันธะกันใหม่กลายเป็น C6H12O6 และ O2 การสร้างพันธะจะคายพลังงานออกมาจำนวนหนึ่ง แต่น้อยกว่าพลังงานที่ดูดเข้าไปจากแสงอาทิตย์ ดังสมการ
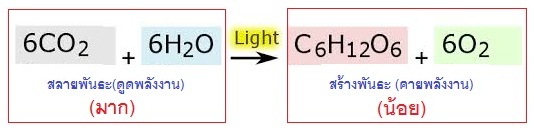
การที่พลังงานที่คายออกมามีน้อยกว่าพลังงานที่ดูดเข้าไป จึงมีพลังงานส่วนหนึ่งเหลืออยู่ พลังงานส่วนที่เหลือจะเก็บเอาไว้ในรูปพลังงานพันธะ อยู่ใน C6H12O6 และ O2
C6H12O6 เป็นต้นกำเนิดของอาหารหลายหมู่ คือคาร์โบไฮเดรต ไขมัน
โปรตีน และวิตามิน ยกเว้นเกลือแร่ สำหรับ
O2
ใช้ในกระบวนการหายใจของทั้งพืชและสัตว์
การหายใจเป็นการนำ O2 เข้าไปเพื่อสันดาปกับ C6H12O6 คือทำปฏิกิริยากับ C6H12O6 กลายเป็น CO2 และ
H2O ซึ่งก็คือปฏิกิริยาย้อนกลับของกระบวนการสังเคราะห์ด้วยแสง พลังงานแสงอาทิตย์ที่เก็บเอาไว้ในพลังงานพันธะก็จะถูกปล่อยออกมา ดังสมการ

การเกิดปฏิกิริยาเคมีต่าง ๆ จะประกอบด้วยการสลายพันธะในสารตั้งต้น (ดูดพลังงาน)
และมีการสสร้างพันธะกันใหม่เป็นสารผลิตภัณฑ์ (คายพลังงาน) พลังงาน
2
ส่วนที่กล่าวนี้จะมีค่าไม่เท่ากัน
ทำให้จำแนกปฏิกิริยาในเชิงพลังงานได้
2 ประเภท คือ
1. ปฏิกิริยาดูดพลังงานหรือปฏิกิริยาดูดความร้อน (Endothermic reaction) คือปฏิกิริยาที่ดูดพลังงานเพื่อใช้สลายพันธะในสารตั้งต้น
มากกว่าพลังงานที่คายเมื่อสร้างพันธะในผลิตภัณฑ์ ; ΔH ใช้เครื่องหมาย
+
2. ปฏิกิริยาคายพลังงานหรือปฏิกิริยาคายความร้อน (Exothermic reaction) คือปฏิกิริยาที่ดูดพลังงานเพื่อใช้สลายพันธะในสารตั้งต้น
น้อยกว่าพลังงานที่คายเมื่อสร้างพันธะในผลิตภัณฑ์ ; ΔH ใช้เครื่องหมาย
–
การคำนวณพลังงานของปฏิกิริยา
การคำนวณหาค่าพลังงานของปฏิกิริยาเคมีใด
ๆ มีขั้นตอนดังนี้
1. เขียนสมการแสดงปฏิกิริยาที่เกิดขึ้น
2. เขียนสูตรโครงสร้างลิวอิส เพื่อแสดงพันธะในสารแต่ละชนิดของปฏิกิริยา
3. แทนค่าพลังงานพันธะของพันธะต่าง ๆ ตามสูตรลิวอิสที่เขียนขึ้น
-
พลังงานของสารที่อยู่ทางซ้ายของสมการ
เป็นพลังงานที่ดูดเข้าไปจากภายนอก
ใช้สัญลักษณ์ว่า H1 หรือ
ΔH1 และใช้เครื่องหมาย + ในการแสดงค่าพลังาน
-
พลังงานของสารที่อยู่ทางขวามือของสมการ
เป็นพลังงานที่คายออกมาสู่ภายนอก ใช้สัญลักษณ์ว่า H2 หรือ
ΔH2 และใช้เครื่องหมาย
- ในการแสดงค่าพลังาน
4. นำพลังงานจากข้อ 3
มารวมกัน (นำเครื่องหมาย + หรือ – ของพลังงานมาด้วย)
-
เรียกผลรวมของพลังงานว่า
พลังงานของปฏิกิริยา ( Heat of reaction ; H คือ enthalpy เช่นเดียวกับในเรื่อง
สารไอออนิก)
ΔH = ΔH1
+ ΔH2
- ถ้าพลังงานที่ดูดจากภายนอกมากกว่าพลังงานที่คาย ปฏิกิริยาจะเป็นชนิดดูดความร้อน H ใช้เครื่องหมาย +
-
ถ้าพลังงานที่ดูดจากภายนอกน้อยกว่าพลังงานที่คาย ปฏิกิริยาจะเป็นชนิดคายความร้อน H
ใช้เครื่องหมาย -
ตัวอย่าง จงคำนวณหาพลังงานของปฏิกิริยา
(H )
ของปฏิกิริยา 2H2 + O2 → 2H2O
กำหนดพลังงานพันธะ หน่วยเป็น kJ/mol
ดังนี้ ; H – H
= 436 , O=O = 499 , O-H = 463
วิธีทำ
ขั้นที่ 1
เขียนสูตรลิวอิสเพื่อแสดงพันธะของสารแต่ละชนิดในปฏิกิริยา
(ปฏิกิริยา) 2H2 +
O2 → 2H2O
(สูตรลิวอิส) 2(H-H) + O=O → 2(H-O-H)
2(H-H) + O=O → 4(H-O)
ขั้นที่ 2 แทนค่าพลังงานพันธะ และรวมพลังงานแต่ละด้าน
2(436) +
499 → 4(463)
872
+ 499 → 1,852
1,371 → 1,852
(ΔH1 ) (ΔH2 )
(พลังงานทางซ้ายคือ
ΔH1 ใช้เครื่องหมาย +)
→ (พลังงานทางขวาคือ ΔH2 ใช้เครื่องหมาย - )
ขั้นที่ 3 คำนวณพลังงานของปฏิกิริยา
ΔH =
ΔH1
+ ΔH2
= + 1,371 + (-1,852)
= - 481
kJ ตอบ
ค่า ΔH ของปฏิกิริยามีค่าเป็นลบ
หมายความว่าปฏิกิริยานี้เป็นปฏิกิริยาคายความร้อน ปริมาณความร้อนจะแปรผันตรงกับปริมาณสารที่ทำปฏิกิริยากัน
ถ้าดูจากสมการและค่าที่คำนวณจะเห็นว่า เมื่อใช้ H2 จำนวน 2 โมล ทำปฏิกิริยากับ O2 จำนวน 1 โมล ได้ H2O จำนวน 2 โมล จะคายความร้อน 481 kJ
* ถ้าเพิ่มปริมาณสารเป็น 2 เท่า
พลังงานที่คายจะเพิ่มเป็น 2 เท่าเช่นกัน
เมื่อใช้ H2 จำนวน 4 โมล
ทำปฏิกิริยากับ O2 จำนวน 2 โมล ได้
H2O
จำนวน 4 โมล
จะคายความร้อน = 2(481) = 962
kJ
ความยาวพันธะ (Bond length )
ถ้าเราสังเกตระยะห่างระหว่างอะตอม
2 อะตอม ที่จะสร้างพันธะกันจะพบว่า ก่อนสร้างพันธะอะตอมจะอยู่ห่างกันมากและต่างฝ่ายต่างมีพลังงานสูง เมื่อจะสร้างพันธะก็จะเคลื่อนที่เข้าหากัน พร้อมกับมีการคายพลังงานออกไปด้วย ทำให้ระยะห่างระหว่างอะตอมและพลังงานลดลงเช่นกัน เมื่อเคลื่อนที่เข้มมาใกล้กันมากขึ้นก็จะยิ่งคายพลังงานออกไปมากขึ้น จนถึงระยะห่างพอเหมาะที่ทำให้คายพลังงานจนลดลงได้ต่ำสุด อะตอมก็จะสร้างพันธะกันโดยสมบูรณ์ ถ้ามีการสร้างพันธะเดียวกันจำนวน 6.02 x 1023 พันธะ ( 1 โมลพันธะ) พลังงานที่คายออกมาทั้งหมดรวมกันก็คือพลังงานพันธะ
(Bond energy) และเรียกระยะห่างระหว่างอะตอมที่สร้างพันธะกันว่าความยาวพันธะ
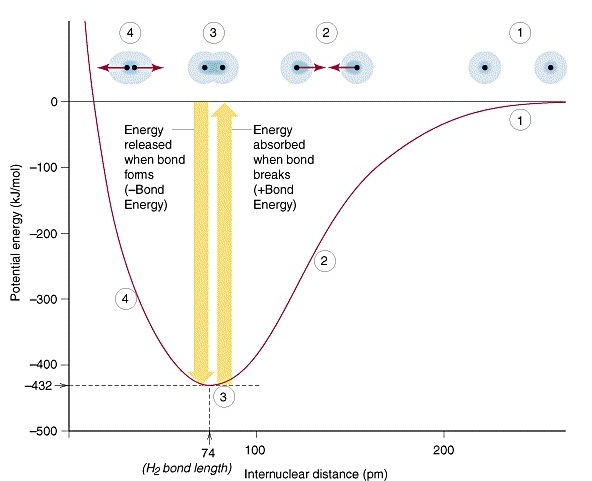
(Bond length) แต่ถ้าอะตอมเข้าไปอยู่ใกล้กันมากกว่านี้ พลังงานก็จะเพิ่มขึ้นอีก กราฟต่อไปนี้เป็นการแสดงความสัมพันธ์ระหว่าง ระยะห่างระหว่างอะตอมของไฮโดรเจน 2
อะตอมที่จะสร้างพันธะกันกับระดับพลังงานที่เปลี่ยนแปลงไป
เริ่มจากตำแหน่งหมายเลข 1
อะตอมยังอยู่ห่างกันมาก มีพลังงานสูง
- ตำแหน่งหมายเลข 2
อะตอมเลื่อนเข้ามาอยู่ใกล้กันมากขึ้น
พลังงานต่ำลง
- ตำแหน่งหมายเลข 3
อะตอมเลื่อนเข้ามาอยู่ใกล้พอเหมาะ ทำให้พลังงานลดลงต่ำสุด แสดงว่ามีการสร้างพันธะกันอย่างสมบูรณ์
ณ จุดนี้ และระยะห่างระหว่างอะตอม
ณ
จุดนี้คือความยาวพันธะ
-
ตำแหน่งหมายเลข 4 อะตอมเข้าใกล้กันเกินไป ทำให้พลังงานสูงขึ้นอีก
(คลิ้ก
ชมความสัมพันธ์ระหว่างระยะห่างระหว่างอะตอมกับพลังงาน)
(คลิ้กชม Bond length
and bond energy)
พลังงานที่คายออกมาถ้าดูจากกราฟก็จะเห็นว่ามีค่าเท่ากับ 0 – (- 432) = 432
kJ/mol ในกราฟจะแสดงให้เห็นอะตอมเพียง 1
คู่มาสร้างพันธะกัน
1 พันธะ แต่ให้เข้าใจว่ามีการสร้างพันธะเช่นเดียวกันนี้จำนวน 6.02 X 1023 พันธะ หรือ
1 โมลพันธะ พลังงานที่คายออกมาทั้งหมดจึงจะรวมกันได้ = 432 kJ
จึงใช้หน่วยของพลังงานพันธะเป็น kJ/mol (พลังงานพันธะจากแหล่งอ้างอิงต่าง ๆ
อาจมีค่าต่างกันบ้างแต่ไม่มากนัก)
ตัวอย่างความยาวพันธะเฉลี่ยและพลังงานพันธะระหว่างอะตอมต่าง ๆ มีดังนี้
|
พันธะ
|
ความยาวพันธะ(pm)
|
พลังงานพันธะ
kJ/mol
|
พันธะ
|
ความยาวพันธะ(pm)
|
พลังงานพันธะ
kJ/mol
|
|
C-C
|
154
|
348
|
C=N
|
130
|
615
|
|
C=C
|
134
|
614
|
CN
|
116
|
891
|
|
CC
|
120
|
834
|
C-O
|
143
|
358
|
|
C-H
|
108
|
413
|
C=O
|
122
|
799
|
|
C-Cl
|
177
|
328
|
N-H
|
101
|
391
|
|
C-N
|
147
|
293
|
N-O
|
136
|
201
|
|
H-H
|
74
|
436
|
H-F
|
92
|
467
|
|
F-F
|
142
|
155
|
Cl-Cl
|
199
|
242
|
ให้สังเกตว่าพันธะระหว่างอะตอมของธาตุเดียวกัน พันธะเดี่ยวจะมีความยาวพันธะมากที่สุด แต่มีพลังงานพันธะน้อยที่สุดในขณะที่พันธะสาม มีความยาวพันธะน้อยที่สุดแต่มีพลังงานพันธะมากที่สุด
การที่พันธะเดี่ยวมีความยาวพันธะมากที่สุดเป็นเพราะ เป็นการสร้างพันธะแบบซิกมาบอน คือเกิดการซ้อนทับกันที่ส่วนปลายของออร์บิทัล จึงเกิดขึ้นได้แม้ว่าอะตอมจะอยู่ห่างกัน
สำหรับพันธะคู่มีความยาวพันธะลดลงประกอบด้วยซิกมาบอนด์
1 พันธะ ไพบอนด์ 1 พันธะ
การสร้างพันธะแบบไพบอนเป็นการซ้อนทับด้านข้างของออร์บิทัล อะตอมต้องเลื่อนตัวเข้ามาใกล้กันมากกว่าเดิม
สำหรับพันธะสามมีความยาวพันธะน้อยที่สุดเป็นเพราะ ประกอบด้วยซิกมาบอนด์ 1 พันธะกับไพบอนด์ 2
พันธะ
อะตอมต้องเลื่อนตัวเข้ามาใกล้กันยิ่งขึ้นอีกจึงจะสร้างไพบอนด์ทั้ง
2 พันธะได้ พันธะสามจึงมีความยาวพันธะน้อยที่สุด
(แบบฝึกหัด อยู่ตอนถัดไป , ตอนที่ 10/1 )
รูปภาพที่เกี่ยวข้อง

Size : 9.42 KBs
Upload : 2013-01-25 05:32:05
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|