การดุลสมการรีดอกซ์ (Balancing Redox Equation)
การดุลสมการรีดอกซ์ (Balancing Redox Equation)
การดุลสมการรีดอกซ์มีความยุ่งยากและซับซ้อนกว่าการดุลสมการของปฏิกิริยาธรรมดา ปฏิกิริยารีดอกซ์บางปฏิกิริยาอนุภาคทั้งหมดเกี่ยวข้องกับการเกิดปฏิกิริยารีดอกซ์ล้วน ๆ เช่น
H2 + Cl2 → 2HCl ในขณะที่บางปฏิกิริยาจะมีทั้งอนุภาคท่ีเกี่ยวข้องกับการเกิดปฏิกิริยารีดอกซ์ ในขณะท่ีอนุภาคอีกส่วนหน่ึงเกิดปฏิกิริยาธรรมดา เช่น
KMnO4 + NaCl + H2SO4 → Cl2 + K2SO4 + MnSO4 + H2O + Na2SO4
- ส่วนที่เกิดปฏิกิริยารีดอกซ์คือธาตุที่มีการเปลี่ยนแปลงเลขออกซิเดชัน ได้แก่ Mn ใน KMnO4 และ Cl ใน NaCl
- ส่วนที่เกิดปฏิกิริยาธรรมดาคือธาตุที่ไม่เปลี่ยนแปลงเลขออกซิเดชัน ได้แก่ K O Na H และ S
การดุลปฏิกิริยารีดอกซ์ที่มีปฏิกิริยาธรรมดารวมอยู่ด้วย ให้ดุลส่วนที่เกิดปฏิกิริยารีดอกซ์ก่อน แล้วจึงดุลส่วนที่เกิดปฏิกิริยาธรรมดา นอกจากนั้นแล้วยังเกี่ยวข้องกับภาวะแวดล้อมของปฏิกิริยาว่าเป็นกลางหรือเป็นกรดหรือเป็นเบสอีกด้วย การดุลสมการรีดอกซ์อาจทำได้ 2 วิธีคือ
1. ดุลสมการรีดอกซ์โดยใช้เลขออกซิเดชัน (Balancing redox equation using oxidation number)
2. ดุลสมการรีดอกซ์โดยใช้ปฏิกิริยาครึ่งเซลล์ (Balancing redox equation using half reaction)
การดุลสมการรีดอกซ์โดยใช้เลขออกซิเดชัน มีขั้นตอนสำคัญดังนี้
1. หาตัวรีดิวซ์ (ธาตุที่มีเลขออกดซิเดชั่นเพิ่มขึ้น) และตัวออกซิไดซ์ (ธาตุที่มีเลขออกซิเดชันลดลง) เลขออกซิเดชันที่เพิ่มขึ้นหมายถึงจำนวนอิเล็กตรอนที่ตัวรีดิวซ์ปล่อยออกไป เลขออกซิเดชันที่ลดลงหมายถึงจำนวนอิเล็กตรอนที่ตัวออกซิไดซ์รับไว้ เช่น
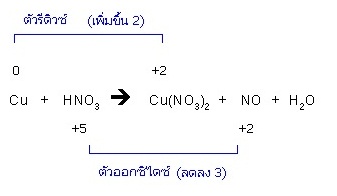
2. ถ้าเลขออกซิเดชันที่เพิ่มขึ้นมีค่าเท่ากับเลขออกซิเดชันที่ลดลง แสดงว่าจำนวนอิเล็กตรอนที่ตัวรีดิวซ์ปล่อยออกไป กับจำนวนอิเล็กตรอนที่ตัวออกซิไดซ์รับเอาไว้มีจำนวนเท่ากัน ให้ดุลสมการต่อไปจนจบ แต่ถ้าเลขออกซิเดชันที่เพิ่มขึ้นและลดลงมีค่าไม่เท่ากัน ให้หาตัวเลขที่เหมาะสมมาคูณเลขออกซิเดชันที่เพิ่มและลดเพื่อให้ได้ค่าเท่ากัน แล้วให้ใช้ตัวเลขที่นำมาเป็นตัวคูณนั้น เป็นจำนวนโมล ของตัวรีดิวซ์หรือตัวออกซิไดซ์ตามลำดับ
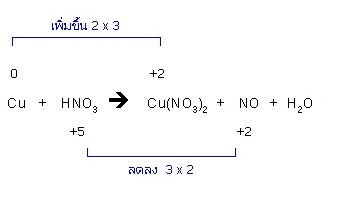
3. ดุลจำนวนโมลของตัวรีดิวซ์กับผลิตภัณฑ์ที่เกิดจากตัวรีดิวซ์ให้เท่ากัน และดุลจำนวนโมล ของตัวออกซิไดซ์กับผลิตภัณฑ์ที่เกิดจากตัวออกซิไดซ์ให้เท่ากันด้วย
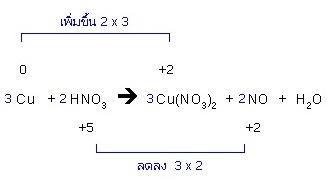
4. ถ้ามีกรดอยู่ในปฏิกิริยาให้พิจารณาดังนี้ (ตัวอย่างนี้เป็นแบบ 4.2)
4.1 กรดไม่เกิดปฏิกิริยารีดอกซ์ สังเกตไอออนลบของกรด(คู่เบส)ไม่เปลี่ยนรูปไปเป็นอย่างอื่น กรณีนี้ดุลสมการโดยการทำให้จำนวนโมลของกรดทางสารตั้งต้น ให้มีจำนวนโมลเท่ากับจำนวนโมลของไอออนลบของกรด(คู่เบส)ทั้งหมดทางด้านผลิตภัณฑ์ ที่อาจอยู่ในผลิตภัณฑ์ชนิดเดียวหรือหลายชนิดก็ได้
4.2 กรดเกิดปฏิกิริยารีดอกซ์บางส่วน สังเกตจากไอออนลบของกรดมีการเปลี่ยนรูปไปเป็นสารใหม่บางส่วน แต่ยังคงมีไอออนลบในรูปเดิมเหลืออยู่ด้วย ในกรณีนี้ให้ตรวจสอบดูว่าไอออนลบของกรดที่อยู่ในรูปเดิมทางด้านผลิตภัณฑ์ยังมีอยู่กี่โมล ให้เพิ่มจำนวนโมลของกรดทางสารตั้งต้นอีกเท่านั้น ตัวอย่างยี้มีกรด HNO3 อยู่ในปฏิกิริยา คู่เบสของมันคือ NO3- จะเห็นได้ว่ามีอยู่ในผลิตภัณฑ์ 6 โมล จึงต้องเพิ่อม HNO3
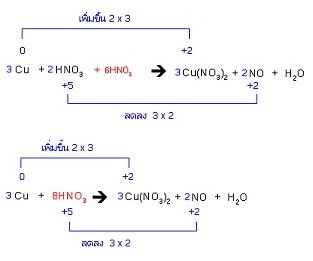
4.3 กรดเกิดปฏิกิริยารีดอกซ์ทั้งหมด สังเกตจากไม่มีไอออนลบของกรดในรูปเดิมเหลืออยู่เลยในผลิตภัณฑ์ กรณีนี้ให้ดุลสมการต่อไปโดยไม่ต้องเพิ่มจำนวนโมลของกรดทางสารตั้งต้น
5. ดุลสมการส่วนที่ไม่เกิดปฏิกิริยารีดอกซ์ แล้วทำให้เป็นอัตราส่วนอย่างต่ำเท่าที่จะทำได้
6. ถ้าปฏิกิริยาเกิดขึ้นในสารละลายกรดบางครั้งจะพบว่าหลังจากดุลสมการทุกส่วนแล้ว ยังขาดอะตอมของ H หรือ O ทางด้านใดด้านหนึ่ง ให้แก้ปัญหาดังนี้
6.1 ด้านใดขาด H ให้เติม H+ ตามจำนวนที่ขาด
6.2 ด้านใดขาด O ให้เติม H2O ตามจำนวนโมลที่ขาด ดังตัวอย่าง (ตัวอย่างใหม่)
ทางซ้ายมี O = 4 ทางขวายังไม่มี ต้องเติม 4H2O แต่ก็มีผลให้ทางขวามี H = 8 ขณะที่ทางซ้ายยังไม่มี ต้องเติม 8H+ ทางซ้าย
7. ถ้าปฏิกิริยาเกิดขึ้นในสารละลายเบสบางครั้งจะพบว่าหลังจากดุลสมการทุกส่วนแล้ว ยังขาดอะตอมของ H หรือ O ทางด้านใดด้านหนึ่ง ให้แก้ปัญหาดังนี้
7.1 ด้านใดขาด O ให้เติม H2O ตามจำนวนที่ขาด เช่นเดียวกับปฏิกิริยาที่เกิดขึ้นในสารละลายกรด ดังตัวอย่าง (ตัวอย่างใหม่)
7.2 ด้านใดขาด H ให้เติม H+ ตามจำนวนที่ขาด แล้วเติม OH- ทั้ง 2 ข้าง เท่ากับจำนวนของ H+ ที่เติม H+ และ OH- จะรวมตัวกันเป็น H2O ถ้าอีกด้านหนึ่งมี H2O
อยู่ด้วย ให้หักล้างกันได้ (แนะนำให้ทำข้อ 7.1 ก่อนจะดีกว่า)
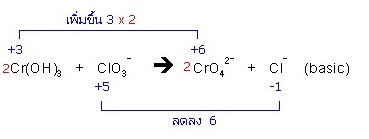
- ทางซ้ายมี O = 9 ทางขวามี O = 8 ต้องเติม H2O ทางขวา
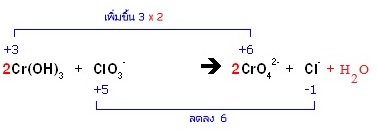
* ทางซ้ายมี H = 6 ทางขวามี H = 2 ต้องเติม H+ ทางขวาอีก 4H+ แล้วเติม 4OH- ทั้ง 2 ด้าน
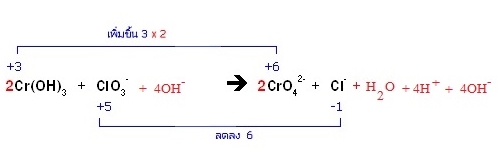
* 4H+ + 4OH- ทางขวารวมตัวกันเป็น 4H2O รวมกับ H2O ที่มีอยู่เดิมเป็น 5H2O
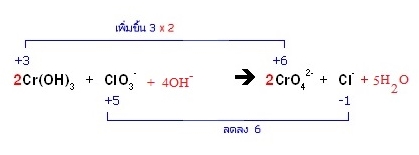
สมการที่ดุลแล้วเป็นดังนี้ ; 2Cr(OH)3 + ClO3- + 4OH- → 2CrO42- + Cl- + 5H2O
การดุลสมการรีดอกซ์โดยครึ่งปฏิกิริยา (Balancing redox equation using half reaction)
หลักการทั่วไปคือ พิจารณาให้ได้ว่าส่วนใดของปฏิกิริยาเป็นส่วนออกซิเดชันและเป็นส่วนรีดัดชัน แล้วแยกแต่ละส่วนออกมาเขียนเป็นสมการย่อยเพื่อให้เห็นจำนวนอิเล็กตรอนที่ถ่ายเทกันว่าเท่ากันหรือไม่ ถ้าไม่เท่าให้ใช้ตัวเลขที่เหมาะสมคูณแต่ละสมการเพื่อทำให้เท่ากัน ขั้นนี้เป็นการดุลสมการส่วนที่เกิดปฏิกิริยารีดอกซ์ จากนั้นรวมสมการย่อยเข้าด้วยกันแล้วดุลสมการส่วนที่เกิดปฏิกิริยาธรรมดา โดยใช้หลักการต่าง ๆ เช่นเดียวกับการดุลโดยเลขออกซิเดชัน ดูตัวอย่าง
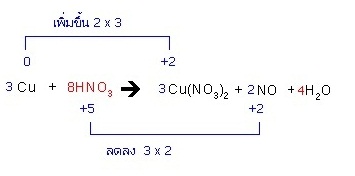
ตัวอย่าง จงดุลสมการรีดอกซ์ต่อไปนี้ Cu + HNO3 → Cu(NO3)) + NO + H2O
ออกซิเดชัน ; Cu → Cu2+ + 2e-
รีดักชัน ; N5+ + 3e- → N2+
จำนวนอิเล็กตรอนจากปฏิกิริยาออกซิเดชันกับรีดักชันยังไม่เท่ากัน ต้องทำให้เท่ากันโดยคูณสมการด้วยตัวเลขที่เหมาะสม
ออกซิเดชัน ; 3(Cu → Cu2+ + 2e-)
3Cu → 3Cu2+ + 6e-
รีดักชัน ; 2(N5+ + 3e- → N2+)
2N5+ + 6e- → 2N2+
ต่อจากนี้รวมเป็นสมการเดียวกัน แล้วดุลสมการต่อไปจนจบด้วยหลักการเดียวกับการดุลด้วยเลขออกซิเดชัน
3Cu + 2N5+ + 6e → 3Cu2+ + 6e- + 2N2+
3Cu + 2HNO3 + 6e- → 3Cu(NO3)2 + 6e- + 2NO + H2O
3Cu + 2HNO3 → 3Cu(NO3)2 + 2NO + H2O
แบบฝึกหัด จงดุลสมการรีดอกซ์ต่อไปนี้ โดยวิธีใช้เลขออกซิเดชันและโดยวิธีใช้ครึ่งปฏิกิริยา (บางปฏิกิริยาอาจเกิดในสารละลายกรดหรือเบสแต่ไม่ได้บอกไว้)
1. Fe + V2O3 → Fe2O3 + VO
2. H2C2O4 + KMnO4 → CO2 + K2O + Mn2O3 + H2O
3. Mn(NO3) 2 + NaBiO3 + HNO3 →HMnO4 + Bi(NO3) 3 + NaNO3 + H2O
4. H2C2O4 + K2MnO4 → CO2 + K2O + Mn2O3 + H2O
5. KClO3 + C12H22O11 →KCl + H2O + CO2
6. K2Cr2O7 + H2O + S → SO2 + KOH + Cr2O3
7. KMnO4 + NaCl + H2SO4 → Cl2 + K2SO4 + MnSO4 + H2O + Na2SO4
8. K2Cr2O7 + SnCl2 + HCl → CrCl3 + SnCl4 + KCl + H2O
9. KMnO4 + KNO2 + H2SO4 → MnSO4 + H2O + KNO3 + K2SO4
10. Cu + HNO3 → Cu2+ + NO+ NO3- + H2O
11. Al(s) + MnO2→ Al2O3+ Mn
12. SO2+ HNO2→ H2SO4+ NO
13. HNO3+ H2S→ NO+ S+ H2O
14. Al+ H2SO4→ Al2(SO4)3+ H2
15. HNO3+ H3AsO3→ NO(+ H3AsO4(+ H2O
16. Cu+ HNO3→ Cu(NO3)2+ NO+ H2O
17. NO2+ H2→ NH3+ H2O
18. Cr2O72−+ HNO2→ Cr3++ NO3− (acidic)
(Cr2O72− 3HNO2+5H+ → 2Cr3+ + 3NO3− + 4H2O)
19. Cr(OH)3 + ClO3− → CrO42− + Cl− (basic)
(2Cr(OH)3 + ClO3− + 4OH− → 2CrO42− + Cl− + 5H2O)
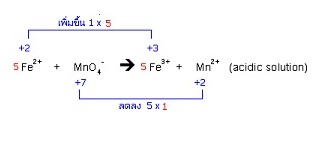
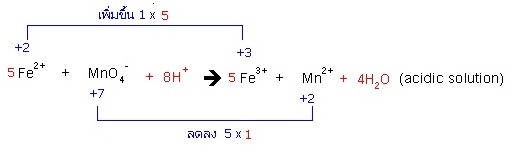
20. Fe2+ + MnO4- → Fe3+ + Mn2+ (acidic solution)
(5Fe2+ + MnO4- + 8H+ → 5Fe3+ + Mn2+ + 4H2O)
21. Pb + PbO2 + SO42- → PbSO4 (acidic solution)
รูปภาพที่เกี่ยวข้อง

Size : 39.47 KBs
Upload : 2012-10-29 21:18:54
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|