โครงสร้างอะตอม ตอนที่ 7 เลขเชิงอะตอม เลขเชิงมวลและไอโซโทป
เลขเชิงอะตอม เลขเชิงมวลและไอโซโทป (atomic
number mass number and isotope)
เลขเชิงอะตอม
(atomic number , Z) หมายถึงจำนวนโปรตอนที่มีอยู่ในอะตอมของธาตุแต่ละธาตุ
เช่น ไฮโดรเจน ( H ) มีโปรตอน 1 ตัว
(อยู่ในนิวเคลียส) จึงมีเลขเชิงอะตอมเท่ากับ 1 ธาตุ คาร์บอนมีโปรตอน 6
ตัว(อยู่ในนิวเคลียส) จึงมีเลขเชิงอะตอมเท่ากับ
6 จำนวนโปรตอนหรือเลขเชิงอะตอมเป็นสมบัติเฉพาะตัวของแต่ละธาตุ เป็นสิ่งที่แสดงความเป็นธาตุนั้น ๆ กล่าวคือถ้า เป็นอะตอมของธาตุเดียวกัน ทุกอะตอมจะมีจำนวนโปรตอนเท่ากัน จำนวนโปรตอนหรือเลขเชิงอะตอมจึงเป็นสิ่งที่ใช้บอกชนิดของธาตุ อะตอมในภาวะปกติจะมีจำนวนโปรตอนเท่ากับจำนวนอิเล็กตรอน ทำให้อะตอม ไม่มีประจุไฟฟ้า หรือเป็นกลางทางไฟฟ้า (neutral) แต่เมื่ออิเล็กตรอนของอะตอมหนึ่งเคลื่อนย้ายไปอยู่ที่อะตอมอื่น อะตอมที่เสียอิเล็กตรอนไปจะมีโปรตอนมากกว่าอิเล็กตรอน จึงมี ประจุไฟฟ้าเป็นบวก เรียกว่าไอออนบวก (cation อ่านว่า แคท ไอออน) เช่น Ca2+ หมายถึงไอออนบวกของแคลเซียม มีอิเล็กตรอนน้อยกว่าโปรตอนอยู่ 2 ตัว
เกิดจากเสียอิเล็กตรอนไป 2 ตัว
(ไม่ใช่ได้โปรตอนมา 2 ตัว) ในทางตรงกันข้ามอะตอมที่ได้รับอิเล็กตรอนก็จะมีอิเล็กตรอนมากกว่าโปรตอน ทำให้มีประจุไฟฟ้าเป็นลบ เรียกว่าไอออนลบ (anion อ่านว่า แอน ไอออน) เช่น S2- หมายถึงไอออนลบของซัลเฟอร์ หรือกำมะถัน มีอิเล็กตรอนมากกว่าโปรตอนอยู่ 2 ตัว เกิดจากได้รับอิเล็กตรอนมาจากอะตอมอื่น 2
ตัว (ไม่ใช่เสียโปรตอนไป 2 ตัว)
เลขเชิงมวล (
Mass number , A )
ก่อนอื่นต้องทราบข้อมูลเบื้องต้นว่า อะตอมของไฮโดรเจนไอโซโทปโปรเตียม (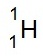 ) เป็นอะตอมที่มีมวลน้อยที่สุดหรือเบาที่สุด มีมวลประมาณ 1.66 x
10-24 กรัม และเรียกค่านี้ว่า 1
amu ( 1 amu = 1.66 x 10-24 g) (amu หรือ AMU เป็นคำย่อของคำว่า Atomic Mass Unit) ธาตุอื่น ๆ ล้วนแต่มีมวลมากกว่า ไฮโดรเจนไอโซโทปนี้ทั้งสิ้น
กำหนดให้ใช้มวลของไฮโดรเจน ไอโซโทปนี้ เป็นค่ามาตรฐาน
เปรียบเทียบมวลกับอะตอมของธาตุอื่นที่มีจำนวนอะตอมเท่ากัน
เพื่อดูว่าอะตอมของธาตุอื่นมีมวลมากกว่ากี่เท่า ใช้จำนวนเท่าที่ได้จากการเปรียบเทียบเป็นเลขเชิงมวล หรือมวลอะตอม ของธาตุนั้น
ๆ ดังสมการ ) เป็นอะตอมที่มีมวลน้อยที่สุดหรือเบาที่สุด มีมวลประมาณ 1.66 x
10-24 กรัม และเรียกค่านี้ว่า 1
amu ( 1 amu = 1.66 x 10-24 g) (amu หรือ AMU เป็นคำย่อของคำว่า Atomic Mass Unit) ธาตุอื่น ๆ ล้วนแต่มีมวลมากกว่า ไฮโดรเจนไอโซโทปนี้ทั้งสิ้น
กำหนดให้ใช้มวลของไฮโดรเจน ไอโซโทปนี้ เป็นค่ามาตรฐาน
เปรียบเทียบมวลกับอะตอมของธาตุอื่นที่มีจำนวนอะตอมเท่ากัน
เพื่อดูว่าอะตอมของธาตุอื่นมีมวลมากกว่ากี่เท่า ใช้จำนวนเท่าที่ได้จากการเปรียบเทียบเป็นเลขเชิงมวล หรือมวลอะตอม ของธาตุนั้น
ๆ ดังสมการ
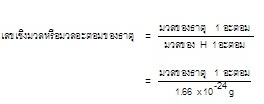
การเปรียบเทียบดังกล่าวนี้พบว่า 12C
1 อะตอม มีมวลมากกว่า 1H 1 อะตอมอยู่
12 เท่า ฉะนั้นมวลอะตอมของ C
= 12 หรือ
12 amu
ปัจจุบันเปลี่ยนมาใช้ 1/12 ของ 12C จำนวน
1 อะตอม (อ่านว่า 1/12 ของ คาร์บอนสิบสอง) แทนการใช้ 1H แต่ค่าที่ได้จากการคำนวณจะเท่าเดิม เพราะ 12Cจำนวน 1 อะตอม
มีมวล เป็น 12 เท่าของ 1H 1 อะตอม ฉะนั้นเมื่อใช้เพียง 1/12 ของ 12C จำนวน
1 อะตอม จึงมีมวลเท่ากับ 1H 1
อะตอมพอดี สมการจะเป็นดังนี้

**
จำนวนอะตอมที่นำมาเปรียบเทียบกันไม่จำเป็นต้องเป็น 1:1 เสมอไป
ใช้เท่าไรก็ได้แต่ต้องเท่ากัน
(X : X)
ตัวอย่าง ธาตุ
He จำนวน 1
อะตอม มีมวล 6.64 x 10-24 g เลขเชิงมวลหรือมวลอะตอมของ
He เป็นเท่าไร
วิธีทำ (ทดลองทำด้วยตัวเองก่อน แล้วจึงคลิ้กดูเฉลย)
ตัวอย่าง ธาตุ
He จำนวน 100
อะตอม มีมวล 6.64 x 10-22
g เลขเชิงมวลหรือมวลอะตอมของ
He เป็นเท่าไร
วิธีทำ (ทดลองทำด้วยตัวเองก่อน แล้วจึง คลิ้กดูเฉลย)
ปัจจุบันเราสามารถหาเลขเชิงมวล หรือมวลอะตอมของธาตุได้จากผลรวมระหว่างจำนวนโปรตอน
(p)
กับนิวตรอน (n) ของแต่ละธาตุ เช่น อะตอมฮีเลียม (He) ประกอบด้วยโปรตอน 2 ตัว นิวตรอน 2
ตัว ฉะนั้นเลขเชิงมวลหรือมวลอะตอมของ He จะเท่ากับ 4 หรือ
4 amu. หรือ 4 g/mol อาจแสดงด้วยสมการต่อไปนี้
A =
p+n ( p คือ จำนวนโปรตอน n
คือ จำนวนนิวตรอน)
= 2+2
= 4 หรือ 4
amu หรือ 4 g/mol
หน่วยของเลขเชิงมวล
ถ้าดูจากสมการจะเห็นได้ว่าเลขเชิงมวลหรือมวลอะตอมของธาตุจะไม่มีหน่วยเพราะตัดกันหมดไป แต่เราก็สามารถที่จะใช้หน่วยได้ คือใช้หน่วยเป็น amu เพราะค่าที่ได้จะมีค่าเป็นจำนวนเท่าของ 1 amu ฉะนั้นเลขเชิงมวลหรือมวลอะตอมของ He
= 4 amu ในตอนต่อไปจะพบว่ามีการใช้หน่วยเป็นอย่างอื่นได้อีก คือใช้ในรูป
มวล/โมล (molar mass) ซึ่งจะพบว่าธาตุ He มีมวล
4 กรัม/ โมล หรือ 4 g/mol หมายความว่าธาตุ He 1
โมล มีมวล 4 กรัม (คำว่า 1
โมลหมายถึงจำนวนอนุภาค 6.02
x 1023
อนุภาค ในที่นี้แปลว่าถ้ามี He จำนวน 6.02
x 1023
อะตอม จะมีมวล 4
กรัม)
สัญลักษณ์นิวเคลียร์ของธาตุ (Atomic nuclear
symbol)
การเขียนสัญลักษณ์ของธาตุดังที่ทราบมาแล้ว เป็นการเขียนแสดงเฉพาะชื่อของแต่ละธาตุ เช่น
C หมายถึงธาตุคาร์บอน แต่ในที่นี้จะเป็นการเขียนสัญลักษณ์ของธาตุพร้อมแสดงจำนวนอนุภาค มูลฐาน (อิเล็กตรอน โปรตอน
และนิวตอน) เอาไว้ด้วย แต่แสดงเอาไว้ในรูปของเลขเชิงอะตอม (atomic
number , z ) และเลขเชิงมวล (mass number , A ) โดยมีรูปแบบดังนี้

Z = เลขเชิงอะตอม (atomic number) คือจำนวนโปรตอน ( p ) ที่มีอยู่ในอะตอมของแต่ละธาตุ
(อะตอมในภาวะปกติจำนวนโปรตอน =
จำนวนอิเล็กตรอน
หรือ p = e-)
* ถ้าจำนวนโปรตอนมากกว่าจำนวนอิเล็กตรอน
อะตอมจะเป็นไอออนบวก (cation)
เช่น
Ca2+ มีโปรตอนมากกว่าอิเล็กตรอน 2 ตัว เกิดจากเสียอิเล็กตรอนไป 2
ตัวให้แก่อะตอมอื่น
* ถ้าจำนวนอิเล็กตรอนมากกว่าจำนวนโปรตอน
อะตอมจะเป็นไอออนลบ (anion) เช่น S2-
มีอิเล็กตรอนมากกว่าโปรตอน 2 ตัว
เกิดจากได้รับอิเล็กตรอนมา 2 ตัวจากอะตอมอื่น
A =
เลขเชิงมวล
(mass number) หรือมวลอะตอมของธาตุ คิดจากจำนวนโปรตอน (p) รวมกับจำนวนนิวตรอน (n)
ที่มีอยู่ใน อะตอมของแต่ละธาตุ
เขียนในรูปสมการดังนี้ ; A
= p + n
* อะตอมของธาตุเดียวกันถ้ามีนิวตรอนไม่เท่ากัน เลขเชิงมวลหรือมวลอะตอมก็จะไม่เท่ากันด้วย
เรียกว่าเป็นไอโซโทปกัน
สัญลักษณ์นิวเคลียร์ทำให้เราทราบว่า อะตอมของธาตุนั้น ๆ หรือไอออนนั้น ๆ มีจำนวนอนุภาคมูลฐานแต่ละชนิดอย่างละเท่าไร เช่น
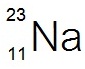
หมายถึง ธาตุโซเดียม
ประกอบด้วย p =
11 e- = 11 n
= 12
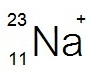
หมายถึงไอออนของโซเดียม
ประกอบด้วย p = 11 e-
= 10 n
= 12
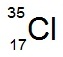
หมายถึงธาตุคลอรีน
ประกอบด้วย p = 17 e- = 17 n = 18
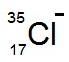
หมายถึง ไอออนของคลอรีน
ประกอบด้วย p=17 e- = 18 n = 18
(คลิ้ก ศึกษาเพิ่มเติม)
(คลิ้ก ทดสอบความเข้าใจเกี่ยวกับจำนวนอนุภาคมูลฐานของอะตอม)
(คลิ้ก ดูตารางธาตุ)
ไอโซโทป (Isotope) หมายถึง
การที่อะตอมของธาตุเดียวกัน แต่มีนิวตรอนไม่เท่ากัน ทำให้เลขเชิงมวลหรือมวลอะตอมไม่เท่ากันด้วย
เช่น ไฮโดรเจน มี 3 ไอโซโทป คือ
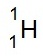
(โปรเตียม , H) ประกอบด้วย p = 1 e-
= 1 n = 0 ไอโซโทปนี้ใช้สัญลักษณ์ว่า
H เมื่อทำปฏิกิริยากับออกซิเจนจะกลายเป็น H2O (น้ำธรรมดา 1
น้ำชนิดนี้มีมวลโมเลกุล 18 amu. )
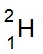
( ดิวทีเรียม
,D) ประกอบด้วย p = 1 e-
= 1 n = 1 ไอโซโทปนี้ใช้สัญลักษณ์ว่า
D เมื่อทำปฏิกิริยากับออกซิเจนจะกลายเป็น D2O (น้ำชนิดหนัก Heavy
water
น้ำชนิดนี้มีมวลโมเลกุล
20 amu.)
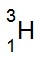
(ตริเตียม
,T) ประกอบด้วย p = 1 e-
= 1 n = 2 ไอโซโทปนี้ใช้สัญลักษณ์ว่า
T เมื่อทำปฏิกิริยากับออกซิเจนจะกลายเป็น T2O (น้ำชนิดหนัก Heavy water น้ำชนิดนี้มีมวลโมเลกุล
22 amu.)
คาร์บอน มี
3 ไอโซโทป คือ

คลอรีน มี 2 ไอโซโทป คือ

ออกซิเจน มี
3 ไอโซโทป คือ
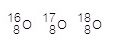
อาร์กอน มี
3 ไอโซโทป คือ

นีออน มี
3 ไอโซโทป คือ
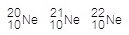
การที่ธาตุมีหลายไอโซโทป ซึ่งแต่ละไอโซโทปมีเลขเชิงมวลหรือมวลอะตอมไม่เท่ากัน จึงต้องหาค่าเฉลี่ยของเลขเชิงมวล หรือมวลอะตอมเฉลี่ย ดังสมการ
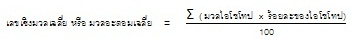
(คลิ้ก
ชมการหามวลอะตอมเฉลี่ย1)
(คลิ้ก
ชมการหามวลอะตอมเฉลี่ย2)
ตัวอย่าง
โลหะเงินมี
2 ไอโซโทป ดังแสดงในตาราง จงหามวลอะตอมเฉลี่ยของโลหะเงิน
|
Isotope name
|
Isotope mass
(amu)
|
percentage
|
|
Silver
107
|
106.90509
|
56.86
|
|
Slver-109
|
108.9047
|
48.14
|
|
วิธีทำ (ทดลองทำด้วยตัวเองก่อน แล้วคลิ้กดูเฉลย)
ไอโซบาร์ (Isobar) หมายถึง การที่อะตอมของธาตุต่างชนิดแต่มีเลขเชิงมวลหรือมวลอะตอมเท่ากัน เช่น
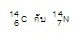
เป็นไอโซบาร์กัน (มีมวลอะตอม = 14 ทั้ง
2 ชนิด)
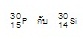 เป็นไอโซบาร์กัน (มีมวลอะตอม = 30 ทั้ง 2
ชนิด) เป็นไอโซบาร์กัน (มีมวลอะตอม = 30 ทั้ง 2
ชนิด)
ไอโซโทน (Isotone) หมายถึงอะตอมของธาตุต่างชนิดที่มีจำนวนนิวตรอนเท่ากัน เช่น
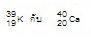 เป็นไอโซโทนกัน (มีนิวตรอน = 20
ทั้ง 2 ชนิด) เป็นไอโซโทนกัน (มีนิวตรอน = 20
ทั้ง 2 ชนิด)
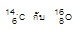 เป็นไอโซโทนกัน (มีนิวตรอน =
8 ทั้ง 2 ชนิด ) เป็นไอโซโทนกัน (มีนิวตรอน =
8 ทั้ง 2 ชนิด )
** บรรดาสัญลักษณ์ของธาตุต่าง ๆ เลขเชิงอะตอมและเลขเชิงมวลเฉลี่ย จะแสดงอยู่ในตารางธาตุ
(Periodic table) (คลิ้ก เปิดตารางธาตุ)
แบบฝึกหัด
1.
Complete
the following chart and answer the questions below.
(จงเติมข้อมูลลงในช่องว่างให้สมบูรณ์และตอบคำถามในตอนท้าย)
|
Element
Name
(ชื่อธาตุ)
|
Atomic
Number
(เลขเชิงอะตอม)
|
Number of
Protons
(จำนวนโปรตอน)
|
Number of
Neutrons
(จำนวนนิวตรอน)
|
Mass Number
(เลขเชิงมวล)
|
|
carbon
|
|
|
|
12
|
|
|
8
|
|
8
|
|
|
hydrogen
|
|
|
|
1
|
|
|
|
6
|
|
14
|
|
hydrogen
|
|
|
2
|
|
|
nitrogen
|
|
|
|
14
|
|
|
|
|
1
|
2
|
|
|
92
|
|
146
|
|
|
cesium
|
|
|
82
|
|
|
|
11
|
|
12
|
|
|
|
|
47
|
|
108
|
|
tungsten
|
|
|
110
|
|
|
|
|
|
45
|
80
|
|
|
|
24
|
|
52
|
|
|
|
|
89
|
152
|
|
silver
|
|
|
|
107
|
|
|
76
|
|
114
|
|
(คลิ้ก
ดูเฉลย)
1.1 How are the atomic number and the number
of protons related to each other?
(เลขเชิงอะตอมกับจำนวนโปรตอนมีความสัมพันธ์กันอย่างไร)
1.2 How do the number of protons, number of
neutrons, and the mass number
relate to each other?
(เลขเชิงมวลมีความสัมพันธ์กับจำนวนโปรตอนและจำนวนนิวตรอนอย่างไร)
1.3 What is the one thing that determines the identity of an atom (that is, whether
it is an oxygen atom or a carbon atom,
etc.)?
(สิ่งใดเป็นตัวกำหนดว่าอะตอมหนึ่ง ๆ
เป็นอะตอมของธาตุใด )
(คลิ้ก ดูเฉลย)
2.. ถ้าธาตุ A มีเลขเชิงอะตอมเท่ากับ
80 เลขเชิงมวลเท่ากับ 200 ธาตุ A จะมีจำนวนนิวตรอนเท่าไร (ตอบ. 4)
1.
80 2.
280 3.
200 4.
120
3. ข้อแตกต่างของยูเรเนียม
-234,ยูเรเนียม -235 และยูเรเนียม -238
คืออะไร (ตอบ. 1)
1. มีเลขเชิงมวลต่างกันเนื่องจากมีจำนวนนิวตรอนต่างกัน
2. ให้ปฏิกิริยาเคมีต่างกันเนื่องจากมีจำนวนอิเล็กตรอนต่างกัน
3. ประจุของนิวเคลียสต่างกัน
เนื่องจากมีจำนวนโปรตอนต่างกัน
4. ทั้ง 1.
2. และ 3.
4. คำกล่าวต่อไปนี้ข้อใดถูกต้อง (ตอบ. 4)
ก. มวลอะตอมของธาตุใดๆขึ้นอยู่กับมวลของโปรตอน(
p ) และนิวตรอน(n) ในนิวเคลียส
ข. ทุกอะตอมของธาตุชนิดเดียวกันจะต้องมีจำนวนโปรตอนและนิวตรอนในนิวเคลียสเท่ากัน
ค. ในอะตอมที่เป็นกลางชนิดหนึ่งๆจำนวนโปรตอนต้องเท่ากับจำนวนอิเล็กตรอน
ง. เราเรียกอะตอมของธาตุชนิดเดียวกันที่มีมวลต่างกันว่า
ไอโซโทป
1. ก 2.
ก,ข 3. ก,ง 4. ก,ค และ ง
5. ข้อใดคือข้อความที่ถูกต้องที่สุด (ตอบ. 4)
1. อะตอมของธาตุชนิดเดียวกันมีจำนวนนิวตรอนเท่ากัน
2. อะตอมของธาตุชนิดเดียวกันมีมวลเท่ากัน
3. อะตอมของธาตุชนิดเดียวกันมีจำนวนอิเล็กตรอนเท่ากัน
4. อะตอมของธาตุชนิดเดียวกันมีเลขเชิงอะตอมเท่ากัน
6.
จงพิจารณาว่าข้อใดไม่ถูกต้อง (ตอบ. 3)
1. จำนวนโปรตอนเรียกว่า เลขเชิงอะตอม
2. ผลรวมของโปรตอนและนิวตรอนเรียกว่า เลขเชิงมวล
3. อะตอมของธาตุเดียวกันมีจำนวนโปรตอนและนิวตรอนเท่ากัน
แต่จำนวนอิเล็กตรอนต่างกัน จึงเรียกอะตอมของธาตุเดียวกันว่าไอโซโทป
4. อะตอมของธาตุชนิดหนึ่ง จะมีจำนวนโปรตอนเฉพาะตัวไม่ซ้ำกับธาตุอื่นๆ
7. ถ้าธาตุ X ไปผ่านกระบวนการอย่างใดอย่างหนึ่ง
ซึ่งมีผลทำให้อะตอมของธาตุ X เกิดการเปลี่ยนแปลง การ
จะพิจารณาตัดสินว่าธาตุ X เปลี่ยนไปเป็นธาตุใหม่หรือไม่ จะพิจารณาได้จากข้อใด (ตอบ. 3)
1. จำนวนไอโซโทปของธาตุ
X มีมากชนิดนี้กว่าเดิมมาก
2. จำนวนนิวตรอนเปลี่ยนไปจากเดิม
3. จำนวนโปรตอนเปลี่ยนไปจากเดิม
4. มีการเปลี่ยนแปลงจำนวนอิเล็กตรอนในแต่ละชั้นพลังงานอย่างเห็นได้ชัด
8 อนุภาคในข้อใดมีจำนวนอิเล็กตรอนเท่ากันทุกอนุภาค
(ตอบ. 3)
1. 4Be , 12Mg
2+ , 20Ca , 38Sr 2+ 2.
11Na + , 25Mn2+ , 17Al3+
, 14Si4+
3. 17Cl- , 18Ar
, 20Ca2+ , 22Ti4+ 4.
7N3- , 8O2- , 11Na , 12Mg
9. X และ Y เป็นอะตอมของธาตุซึ่งเป็นไอโซโทปกัน
ถ้า X มีจำนวนนิวตรอนในนิวเคลียสเท่ากับ b และ Y มีจำนวนอิเล็กตรอนเท่ากับ a กับมีเลขเชิงมวลเท่ากับ c
เลขเชิงมวลของ X และจำนวนนิวตรอน ของ Y มีค่าเท่ากับ (ตอบ. 1)
1. a + b และ c
– a 2.
a + b และ a – c
3. a + b และ a
+ c 4.
a + b และ a + c
10. จงเลือกคำตอบที่ถูกต้องที่สุด (ตอบ.
3)
1. นิวเคลียสของ Cl-
มีประจุลบ
2. 11Na+
มีจำนวนอิเล็กตรอนมากว่า 8O2- สามอิเล็กตรอน
3. มีจำนวนอิเล็กตรอนมากกว่า หนึ่งอิเล็กตรอน
4. กับ มีจำนวนอิเล็กตรอนเท่ากัน
11. ธาตุ X มีโปรตอน
22 ตัว มีนิวตรอน
24 ตัว มีอิเล็กตรอน
20 ตัว สัญลักษณ์นิวเคลียร์ของ X คือข้อใด (ตอบ. 4)
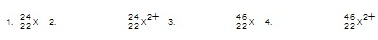
12. (O-net.49) A และ B เป็นไอโซโทปกัน (ตอบ. 2)
A มีจำนวนโปรตอนเท่ากับ 10 และมีเลขเชิงมวลเท่ากับ 20
B มีจำนวนนิวตรอนมากกว่า A อยู่ 2 นิวตรอน
ข้อใดเป็นสัญลักษณ์นิวเคลียร์ของธาตุ B

13. (O-net.50)ถ้าสามารถดึงโปรตอน 4
ตัว อิเล็กตรอน 5 ตัว และนิวตรอน
5 ตัว ออกจากอะตอมของฟอสฟอรัส จะได้อนุภาคใดเป็นผลิตภัณฑ์(กำหนดให้ฟอสฟอรัสมีเลขเชิงอะตอม 15 เลข เชิงมวล 31
และ 11Na 12Mg 13Al ) (ตอบ. 1)
1. Na+ 2. Na 3. Mg2+ 4.
Al3+
14. (Ent.41ต.ค.) Hg2+ 0.5 cm3
มีจำนวนอนุภาคมูลฐานทั้งหมดกี่อนุภาค (ความหนาแน่นของปรอท
= 13.6 g/cm3 มวลอะตอมของ Hg ไอโซโทปนี้ = 200 เลขเชิงอะตอมของปรอท = 80)
(ตอบ. 1)
1. 5.69 x 1024 2.
6.76 x 1024 3. 1.138 x 1025 4. 1.146 x 1025
15. (Ent.42 มี.ค.)
ถ้าไอโซโทนคืออะตอมที่มีจำนวนนิวตรอนเท่ากัน
และไอโซบาร์คืออะตอมที่มีเลขเชิงมวลเท่ากัน จากสัญลักษณ์นิวเคลียร์ต่อไปนี้ (ตอบ. 4)
ข้อใดไม่ถูกต้อง
1. กับ เป็นไอโซโทนแต่ไม่เป็นไอโซบาร์
2. กับ ไม่เป็นไอโซโทนและไม่เป็นไอโซบาร์
3. กับ ไม่เป็นไอโซโทนแต่เป็นไอโซโทป
4. กับ เป็นไอโซบาร์แต่ไม่เป็นไอโซโทน
16. ธาตุ X
มี 2 ไอโซโทปคือ มีในธรรมชาติร้อยละ 85
และ 15 ตามลำดับ
มวลอะตอมเฉลี่ยของ X เป็นเท่าไร (ตอบ. 30.30)
17. ธาตุ Y มี 2 ไอโซโทปคือ มีมวลอะตอมเฉลี่ย =
40.20
จงหาร้อยละในธรรมชาติของไอโซโทปทั้งสอง (ตอบ. 40Y = 90
% 42Y=10%))
18. ธาตุ Z
มี 2 ไอโซโทปคือ มี 70% มีมวลอะตอมเฉลี่ย 50.6
จงเขียนสัญลักษณ์นิวเคลียร์ของอีก
ไอโซโทปหนึ่ง (ตอบ.)
19. (Ent.42 ต.ค.) ไนโตรเจนในธรรมชาติ
(มวลอะตอม 14.004) ประกอบด้วย 2
ไอโซโทป คือ 14N และ 15N
ปริมาณร้อยละของไอโซโทปทั้งสองของไนโตรเจนที่มีอยู่ตามธรรมชาติมีค่าเท่าใด (ตอบ. 4)
1. 14N = 4 15N = 96 2. 14N = 50 15N = 50
3. 14N = 96 15N = 4 4. 14N = 99.6 15N = 0.4
20. (Ent.42 มี.ค.) ธาตุ A มี
2 ไอโซโทป ไอโซโทปที่ 1
มีมวลอะตอม 23.08 มีปริมาณในธรรมชาติ 90.00 % ที่เหลือเป็นปริมาณของไอโซโทปที่ 2
ถ้ามวลอะตอมเฉลี่ยของธาตุ A = 23.19 มวลอะตอมของไอโซโทปที่ 2 เป็นเท่าใด (ตอบ. 2)
1. 24.00 2. 24.18 3. 25.00 4. 25.50
21.
(Ent.48 มี.ค. อัตนัย) ธาตุ A มี 2 ไอโซโทปซึ่งมีมวล 14.0
และ 12.9 ธาตุ
B
ซึ่งมีมวลเฉลี่ยเท่ากับ 36.0 สารประกอบ AB4 มีมวลโมเลกุล 157
จงหาร้อยละของไอโซโทปที่มีมวล 14.0
(ตอบทศนิยม 2 ตำแหน่ง) (ตอบ. 9.08 %)
22. (O-NET ก.พ.54) ถ้านำธาตุ
X ไปผ่านกระบวนการหนึ่งทำให้อะตอมของธาตุ X เกิดการเปลี่ยนแปลง การตัดสินว่าธาตุ X
เปลี่ยนไปเป็นธาตุใหม่หรือไม่
พิจารณาได้จากข้อใด (ตอบ 2)
1. จำนวนไอโซโทปเพิ่มขึ้น
2. จำนวนโปรตอนเปลี่ยนไปจากเดิม
3. จำนวนนิวตรอนเปลี่ยนไปจากเดิม
4.
จำนวนอิเล็กตรอนในแต่ละระดับพลังงานเปลี่ยนไปจากเดิมอย่างเห็นได้ชัด
23. ธาตุ A มีจำนวนอิเล็กตรอนและนิวตรอนเท่ากับ
13 และ 14 ตามลำดับ
และเป็นกลางทางไฟฟ้าธาตุ A มี
เลขเชิงอะตอมและเลขเชิงมวลเท่าไร (ตอบ. 1)
1. 14 , 27 2. 13 , 14 3. 13 , 27 4. 27 , 13
Appendix (ภาคผนวก)
1. The 3 particles of the atom are: (อนุภาคมูลฐานทั้ง 3 ชนิดของอะตอมมีอะไรบ้าง)
a. ______________________b.
______________________c. ______________________
Their respective charges are: (อนุภาคดังกล่าวมีประจุอย่างไร)
b. ______________________b.
______________________c. ______________________
2. The number of
protons in one atom of an element determines the atom’s call :
(จำนวนโปรตอนของอะตอมต่าง ๆ
เรียกว่าอะไร)______________________
3. The atomic number tells you the number of
(เลขเชิงอะตอมเป็นการบอกจำนวนของสิ่งใดของอะตอม)______________________
in one atom of an
element. It also tells you
the number of (ตัวเลขดังกล่าวใช้บอกจำนวนของสิ่งใดได้ด้วยเมื่ออะตอมอยู่
ในภาวะปกติ)______________________
in a neutral atom
of thatelement.
4. The ______________________
of an element is the total number of protons and neutrons in
the______________________ of the atom.
(.......................คือผลรวมระหว่างโปรตอนกับนิวตรอนที่มีอยู่ใน..............................ของอะตอม)
5. The mass number is used
to calculate the number of ______________________ in one atom
of an element. In order to calculate the
number of neutrons you must subtract the
______________________ from the
______________________ .
(เลขเชิงมวลสามารถใช้ในการคำนวณหา.....ของอะตอมของธาตุ เช่นถ้าต้องการคำนวณหาจำนวน
นิวตรอน
จะต้องนำ.................................ลบออกจาก.............................)
6. Give the
symbol and number of protons in one atom of:
(จงเขียนแสดงสัญลักษณ์พร้อมจำนวนโปรตอนของธาตุต่อไปนี้)
Lithium ______3Li_________
Bromine __________________
Iron __________________ Copper
__________________
Oxygen __________________ Mercury
__________________
Krypton __________________ Helium
__________________
7. Give the
symbol and number of electrons in a neutral atom of:
(จงเขียนสัญลักษณ์และบอกจำนวน อิเล็กตรอนของธาตุต่อไปนี้)
Uranium ______U , 92 e-________
Chlorine __________________
Boron __________________ Iodine
__________________
Antimony __________________ Xenon
__________________
8. Give the
symbol and number of neutrons in one atom of:
(จงเขียนสัญลักษณ์ (นิวเคลียร์)และแสดงวิธีคำนวณหาจำนวนนิวตรอนของธาตุต่อไปนี้)
(To get “mass number”, you must round
the “atomic mass” to the nearest whole number)
Show your calculations.
Barium __________________ Bismuth
__________________
n = A-Z
= 137 – 56
= 81
Carbon __________________ Hydrogen
__________________
Fluorine
__________________ Magnesium
__________________
Calcium __________________ Mercury
__________________
9. Name the
element which has the following numbers of particles:
(จงบอกชื่อธาตุที่มีองค์ประกอบดังที่กำหนดในแต่ละข้อ)
a. 26 electrons, 29 neutrons, 26 protons ______Copper__________
b. 53
protons, 74 neutrons _____________________
c. 2
electrons (neutral atoms) _____________________
d. 20
protons _____________________
e. 86
electrons, 125 neutrons, 82 protons (charged atom) _____________________
f. 0
neutrons _____________________
10. If you know
only the following information can you always determine what the element is?
(Yes/No). ;
(ถ้าคุณทราบข้อมูลเพียงอย่างเดียวตามที่กำหนดในแต่ละข้อ จะระบุชนิดของธาตุได้หรือไม่)
a. number of protons ___________
b. number of neutrons___________
c. number of electrons in a neutral
atom___________
11. Complete
the table for
the following elements.
(จงหาค่าของสิ่งที่อยู่ในช่องว่างของตาราง)
|
Element
|
number of
proton
|
number of
electron
|
number of
neutron
|
Atomic number
|
Mass number
|
|
Manganese
|
25
|
|
30
|
|
|
|
Sodium
|
|
11
|
12
|
|
|
|
Bromine
|
35
|
|
45
|
|
|
|
Yttrium
|
|
|
|
39
|
89
|
|
Arsenic
|
|
33
|
|
|
75
|
|
Actinium
|
|
|
138
|
|
227
|
12 .
Rubidium has two common isotopes , 85Rb and 87Rb. If the abundance of 85Rb is
72.2% and the abundance of 78Rb
is 27.8% , what is the average atomic
mass of the rubidium?
( รูบิเดียมมี 2 ไอโซโทปคือ 85Rb และ 87Rb พบในธรรมชาติร้อยละ 7.28 และ 27.8 %
ตามลำดับ
มวลอะตอมเฉลี่ยของรูบิเดียมเป็นเท่าไร) . ตอบ 85.56
13. Uranium has three common isotopes. If
the abundance of 234U is 0.01%, the abundance of 235U is
0.71%, and the abundance of 238U is 99.28% , what is the average
atomic mass of uranium? (ยูเรเนียมมี 3 ไอโซโทป คือ 234U
จำนวน 0.01% 235U จำนวน 0.71% และ 238U
จำนวน 99.28% มวลอะตอมเฉลี่ยของยูเรเนียมเป็นเท่าไร)
(ตอบ 236.29)
14. Titanium has five common isotopes; 46Ti (8.0%). 47Ti (7.8%), 48Ti (73.4%) , 49Ti
(5.5%), 50Ti (5.3%). What is
the average atomic mass of
titanium?
(ไททาเนียมประกอบด้วยไอโซโทป 5 ชนิด คือ 46Ti (8.0%). 47Ti (7.8%), 48Ti (73.4%) , 49Ti
(5.5%), 50Ti (5.3%) มวลอะตอมเฉลี่ยของไททาเนียมเป็นเท่าไร)
(ตอบ 47.76)
15. Naturally occurring chlorine that is
put in pools is 75.53 percent 35Cl
(mass = 34.969) and 24.47 percent 37Cl (mass=36.966). Calculate the average atomic mass.
(คลอรีนที่ใช้เติมลงในสระว่ายน้ำนั้นในธรรมชาติประกอบด้วย 35Cl (มีมวลอะตอม 34.969) จำนวน 75.53 เปอร์เซ็นต์ และ 37Cl
(มีมวลอะตอม 36.966) จำนวน 24.47 เปอร์เซ็นต์ จงหามวล
รูปภาพที่เกี่ยวข้อง

Size : 1.99 KBs
Upload : 2015-04-01 06:18:54
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|