ของแข็ง ของเหลว แก๊ส (ตอนที่ 6 ) กฎของชาร์ล
กฎของชาร์ล (Charles , s law)
ในปี ค.ศ. 1778 (พ.ศ.2321 หลังจากการค้นพบของบอยล์ 116 ปี) จ๊าก–อาเล็กซองเดร์–เซซา ชาร์ล (Jacqes A.C. Charles) นักวิทยาศาสตร์ชาวฝรั่งเศส ได้ศึกษาความสัมพันธ์ระหว่างอุณหภูมิกับปริมาตรของแก๊ส ที่มีจำนวนโมลและความดันคงที่ พบว่าปริมาตรของแก๊สแปรผันตรง ( varies directly ) กับอุณหภูมิเคลวิน และอัตราส่วนระหว่าง ปริมาตร : อุณหภูมิ เป็นค่าคงที่ ; (n , P คงที่ , V แปรผันตรงกับ T เคลวิน ) ;
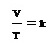
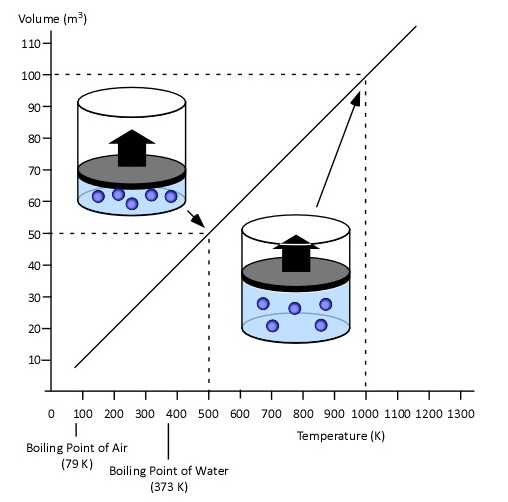
ตัวอย่างผลการทดลอง
|
การทดลองครั้งที่
|
V (cm3)
|
T ( K )
|
V/T (cm3/K)
|
|
1
|
100
|
283
|
0.35
|
|
2
|
114
|
323
|
0.35
|
|
3
|
132
|
373
|
0.35
|
|
4
|
167
|
473
|
0.35
|
เขียนแสดงในรูปของสัญลักษณ์
- ปริมาตรแปรผันตรงกับอุณหภูมิ เขียนว่า T
- อัตราส่วนระหว่าง ปริมาตร : อุณหภูมิ เป็นค่าคงที่ เขียนว่า
เมื่อมีการทดลองซ้ำหลาย ๆ ครั้ง จำนวน จึงมีหลายครั้งด้วย เช่น
สมการเพื่อการคิดคำนวณด้วยกฎของชาร์ลคือ
* V1 กับ V2 ต้องเป็นหน่วยเดียวกัน อาจเป็น dm3 , cm3 หรือหน่วยปริมาตรอื่น ๆ ก็ได้
* T1 กับ T2 ต้องเป็นอุณหภูมิเคลวินเสมอ
(คลิ้ก ชมการอธิบายกฎของชาร์ล) (คลิ้ก ชมการทดลองตามกฎของชาร์ล)
ตัวอย่าง ใช้ Mg จำนวน 1.00 โมล ทำปฏิกิริยากับสารละลายกรด HCl ซึ่งมากเกินพอ เกิดปฏิกิริยาดังสมการ : Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
- ถ้าทดลองที่ภาวะ STP จะได้ H2 กี่ dm3
- ถ้าทดลองที่อุณหภูมิ 27 oC ความดัน 1.00 atm จะได้ H2 กี่ dm3
วิธีทำ จากสมการ ; จำนวนโมลของ H2 ที่ได้ = จำนวนโมลของ Mg ที่ใช้
= 1.00 โมล
- ถ้าทดลองที่ภาวะ STP จะได้ H2 1.00 x 22.4 = 22.4 dm3 ตอบ
- ถ้าทดลองที่อุณหภูมิ 27 oC ความดัน 1.00 atm จะได้ H2 กี่ dm3 ต้องคิดด้วยกฎของชาร์ล
** คำถาม แก๊ส H2 จำนวน 22.4 dm3 กับแก๊ส H2 จำนวน 24.62 dm3 ที่คำนวณได้ มีจำนวนโมลเท่ากันหรือไม่
แบบฝึกหัด
1. A balloon is filled to 5.60 liters in a store at 20oC and then is taken outside where the temperature
is 38oC. What is the resulting volume (L) of the balloon? (ans.a) ; (ลูกโป่งขณะที่อยู่ในอาคารมีปริมาตร
5.60 ลิตร อุณหภูมิ 20 oC เมื่อนำออกไปภายนอกอาคารซึ่งมีอุณหภูมิ 38 oC ปริมาตรของลูกโป่งจะเป็นกี่
ลิตร)
a) 5.94 b) 6.28 c) 5.80 d) 6.18 e) 5.25
2. A sample of a gas at 300 K and 700 torr occupies 60.0 mL. What temperature (oC) is necessary to
increase the volume to 75.0 mL at the same pressure? (ans.a) ; (แก๊สชนิดหนึ่งมีปริมาตร 60.0 ml
ที่อุณหภูมิ 300 K ความดัน 700 torr ถ้าต้องการทำให้ปริมาตรเพิ่มขึ้นเป็น 75.0 ml จะต้องใช้อุณหภูมิ
กี่ oC)
a) 102 b) 121 c) 129 d) 56 e) 85
3. A sample of neon that occupies 125 cm3 at 737 mm Hg and 30oC is heated to 60oC at constant
pressure. What is the new volume (cm3)? (ans.a) (แก๊สนีออนมีปริมาตร 125 cm3 ที่ความดัน 737 mm
Hg อุณหภูมิ 30oC เพิ่มอุณหภูมิเป็น 60oC จะมีปริมาตรกี่ cm3)
a) 137 b) 142 c) 133 d) 131 e) 127
4. A 0.432 liter sample of O2 is collected at 745 mm Hg and 24oC. What volume (L) will the gas
occupy at 0oC at the same pressure? (ans.a) (แก๊ส O2 0.432 ลิตร มีความดัน 745 mm Hgที่อุณหภูมิ
24oC. ถ้าเปลี่ยนอุณหภูมิเป็น 0oC ความดันเท่าเดิม ปริมาตรจะเป็นกี่ลิตร)
a) 0.397 b) 0.362 c) 0.421 d) 0.407 e) 0.385
5. A balloon is filled with air and has a volume of 3.25 L at 30oC. The balloon is placed in a freezer at
-10oC. What is the volume of the balloon at this temperature? (ans.a) (บัลลูนลูกหนึ่งบรรจุอากาศ มี
ปริมาตร3.25 Lที่ 30oC ถ้านำไปอยู่ที่อุณหภูมิ -10oC ปริมาตรจะเป็นเท่าไร)
a) 2.82 b) 3.74 c) 2.02 d) 2.30 e) 2.56
6. แก๊สที่มีจำนวนโมลและความดันคงที่ ณ อุณหภูมิ 27 oC ถ้าเพิ่มอุณหภูมิเป็น 127 oC ปริมาตรจะเพิ่มขึ้น
กี่เท่า
1. 4.7 2. 1.33 3. 0.75 4. 0.21
7. แก๊ส X มีปริมาตร 11.2 dm3 ที่ STP ถ้าต้องการทำให้แก๊ส X มีปริมาตรเพิ่มขึ้นเป็น 5 เท่า ของปริมาตร
เดิม จะต้องเพิ่มอุณหภูมิขึ้นกี่เคลวิน โดยความดันและมวลคงที่
1. 1365 2. 1092 3. 842 4. 530
8. แก๊สซึ่งมีจำนวนโมลและความดันคงที่ มีปริมาตร 8.5 dm3 ที่อุณหภูมิ 29 oC เมื่อเพิ่มอุณหภูมิเป็น 125
oC จะมีปริมาตรกี่ dm3 และเมื่อต้องการให้มีปริมาตรเหลือ 5 dm3 จะต้องใช้อุณหภูมิกี่ oC
9. A sample of 23.0 L of NH3 gas at 10.0 oC is heated at constant pressure until it fills a volume of
50.0 L. What is a new temperature in oC? (แก๊สแอมโมเนีย 23.0 ลิตร อุณหภูมิ 10.0 oC เพิ่มอุณหภูมิ
โดยความดันคงที่ จนมีปริมาตร 50.0 ลิตร อุณหภูมิเป็นกี่ oC)
10. If a sample of 4.17 L of C2H6 gas at 725 oC is cool to 175 oC at constant pressure, What
is the new volume? (แก๊ส C2H6 4.17 ลิตร อุณหภูมิ 725 oC ลดอุณหภูมิลงเหลือ 175 oC โดย
ความดันคงที่ ปริมาตรจะเป็นเท่าไร)
11. A fix quantity of gas at a constant pressure occupies a volume of 8.50 L at a
temperature of 29.0 oC. Use Charles’s law to calculate the following: (แก๊สซึ่งมีปริมาณคงที่
มีปริมาตร 8.50 L ที่อุณหภูมิ 29.0 oC จงในกฎของชาร์ล คำนวณหาค่าต่าง ๆ ในข้อต่อไปนี้)
a. the volume the gas will occupy if the temperature increase to 125 oC. (ถ้าเพิ่มอุณหภูมิ
เป็น 125 oC ปริมาตรจะเป็นเท่าไร)
b. the temperature in degree Celsius at which the volume of the gas will be 5.00 L. (ถ้าทำ
ให้มีปริมาตร 5.00 ลิตร อุณหภูมิจะเป็นกี่องศาเซลเซียส)
12. Calculate the final volume of each of these gases. The pressure remain constant at 1
atm. (จงคำนวณหาปริมาตรของแก๊สในแต่ละข้อ โดยกำหนดให้ความดันเป็น 1 atm คงที่)
a. 27.8 mL of HI at 24.5 oC is heat to 400 oC. (แก๊ส HI 27.8 mL ที่อุณหภูมิ 24.5 oC เพิ่ม
อุณหภูมิเป็น 400 oC ปริมาตรจะเป็นกี่ mL)
b. 23.3 L of CH4 at 300 K is cooled to 150 K. (แก๊ส CH4 23.3 L อุณหภูมิ 300 K เมื่อลด
อุณหภูมิเหลือ 150 K จะมีปริมาตรกี่ L)
c. 0.0754 L of SO2 at 40 oC is heated to 75 oC. (แก๊ส SO2 0.0754 L ที่อุณหภูมิ 40 oC เพิ่ม
อุณหภูมิเป็น 75 oC ปริมาตรจะเป็นกี่ L)
รูปภาพที่เกี่ยวข้อง

Size : 48.16 KBs
Upload : 2014-02-13 20:49:01
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|