ปริมาณสารสัมพันธ์ ตอนที่ 6 ความเข้มข้น โมล/กิโลกรัม
5. โมล/กิโลกรัม หรือ โมแลลลิตี หรือ โมแลล (mol/kg , molality , molal ,m)
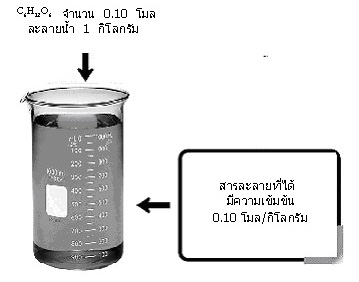
เป็นการบอกจำนวนโมลของตัวละลายที่มีอยู่ในตัวทำละลาย 1 กิโลกรัม เช่น ใช้น้ำตาลกลูโคส (C6H12O6) จำนวน 0.10 โมล ละลายในน้ำ 1 กิโลกรัม จะได้สารละลายที่มีความเข้มข้น 0.10 โมล/กิโลกรัม หรือ 0.10 โมแลล ดังรูป
ตัวอย่าง ใช้ C6H12O6 จำนวน 18 กรัม ละลายในน้ำ 100 กรัม สารละลายที่ได้มีความเข้มข้นกี่โมล/กิโลกรัม
วิธีทำ น้ำ 100 กรัม มี C6H12O6 ละลายอยู่ 18 กรัม
น้ำ 1,000 กรัม มี C6H12O6 ละลายอยู่ = 180 กรัม
คิดเป็นโมล ; n = W/M = 180/180 = 1.0 โมล
สารละลายมีความเข้มข้น 1.0 โมล/กิโลกรัม ตอบ
ใช้สูตร กำหนดตัวแปรดังนี้
C = ความเข้มข้น (โมล/กิโลกรัม)
W1 = น้ำหนักของตัวละลาย (กรัม)
W2 = น้ำหนักของตัวทำละลาย(กรัม)
M = มวลโมเลกุลของตัวละลาย
สูตร C = 1,000 x W1 /W2 x M
จากตัวอย่าง C = 1,000 x 18 /100 x 180 = 1.0 โมล
สารละลายมีความเข้มข้น 1.0 โมล/กิโลกรัม ตอบ
แบบฝึกหัด
1. น้ำ 125 g มี NH3 ละลายอยู่ 0.85 g สารละลายมีความเข้มข้นกี่โมล/กิโลกรัม (ตอบ 0.40 )
2. สารละลายกลูโคส (C6H12O6) เข้มข้น 0.50 m จำนวนหนึ่ง มีน้ำ 200 กรัม เป็นตัวทำละลาย อยากทราบว่ามีกลูโคสละลายอยู่กี่กรัม (ตอบ 18 g )
3. สารละลาย H2SO4 เข้มข้น 20 % โดยมวล/มวล คิดเป็นความเข้มข้นกี่โมล/กิโลกรัม (ตอบ 2.6 )
4. สารละลายซูโครส (C12H22O11, น้ำหนักโมเลกุล 342) ซึ่งเข้มข้น 0.630 M และมีความหนาแน่น 1.08 g/cm3 คิดเป็นความเข้มข้นกี่โมล/กิโลกรัม (ตอบ 0.730 )
5. สารละลาย NaCl ความเข้มข้น 1 โมล/กิโลกรัม ถ้าต้องการ NaCl จากสารละลายนี้จำนวน 5.85 กรัม จะต้องนำสารละลายนี้มากี่ cm3 ความหนาแน่นของสารละลายเท่ากับ 1.20 g/cm3
6. สารละลาย H2SO4 เข้มข้นร้อยละ 35 โดยมวล ความหนาแน่น 1.26 g/cm3 มีความเข้มข้นเท่าใดในหน่วย mol/kg
7. จงคำนวณหาความเข้มข้นเป็นโมล/กิโลกรัม และ โมล/ลิตร ของสารสารละลาย C2H5OH ในน้ำ โดยกำหนดให้เศษส่วนโมลของเอทานอลเป็น 0.05 และความหนาแน่นของสารละลาย 0.99 g/cm3
8. เอธิลีนไกลคอล C2H6O2 เข้มข้น 0.10 M ความหนาแน่น 0.90 g/cm3 คิดเป็นกี่ molal (ตอบ 0.11 m)
9. สารละลาย NH3 ความเข้มข้นร้อยละ 30 โดยมวล มีความหนาแน่น 0.90 g/cm3 จงหาเศษส่วนโมลของ NH3 และความเข้มข้นของสารละลาย NH3 เป็นโมล/กิโลกรัม
10. ถ้าต้องการสารละลาย CH3OH ในน้ำ ที่มีเศษส่วนโมล 0.093 จะต้องใช้ CH3OH กี่กรัม ละลายในน้ำ 500 กรัม และสารละลายมีความเข้มข้นกี่โมล/กิโลกรัม
11. สารละลายกรดไฮโดรครอริกเข้มข้น 12.0 M มีความหนาแน่น 1.18 g/ml จะมีความเข้มข้นกี่โมล/กิโลกรัม
( ตอบ16.2)
12 . จงคำนวณความเข้มข้นเป็นโมล/กิโลกรัม ของสารละลายที่มีน้ำตาลซูโครส (C12H22O11) จำนวน 20.0 กรัม ละลายในน้ำ 125.0 กรัม ( ตอบ 0.468 m)
13. ถ้าสารละลายกรดสเตียริกในเอทานอลเข้มข้น B% โดยปริมาตร โดยมวลโมเลกุลของกรดสเตียริกเท่ากับAสารละลายนี้มีความเข้มข้นกี่โมแลล (ความหนาแน่นของเอทานอล = d g/cm3 ความหนาแน่นของกรดสเตียริก = c g/cm3)
1. 2.
3. 4.
14. จงคำนวณหาเศษส่วนโมลของ NaCl และ H2O ในสารละลาย NaCl เข้มข้น 3.0 โมล/กิโลกรัม (ตอบ 0.051 และ 0.949 )
15. สารสารละลาย C2H5OH ในน้ำ มีเศษส่วนโมลของเอทานอลเป็น 0.05 และความหนาแน่นของสารละลาย 0.99 g/cm3 จงหาความเข้มข้นเป็นโมล/ลิตรและโมล/กิโลกรัม
16. ถ้าต้องการเตรียมสารละลายต่อไปนี้ให้มีความเข้มข้น 1 โมล/กิโลกรัม โดยใช้น้ำ 100 กรัม เป็นตัวทำละลาย เหมือนกันทุกชนิด อยากทราบว่าจะต้องใช้ตัวละลายตามที่กำหนดในแต่ละข้อชนิดละกี่กรัม
16.1 สารละลายยูเรีย { NH2CONH2 หรือ (NH2)2CO }
16.2 สารละลายน้ำตาลกลูโคส (C6H12O6)
16.3 สารละลายน้ำตาลทรายหรือซูโครส (C12H22O11)
16.4 สารละลายโซเดียมคลอไรด์ (NaCl)
17. สารละลายน้ำตาลทรายกับสารละลายน้ำตาลกลูโคส มีความเข้มข้น 1 โมล/กิโลกรัม เท่ากัน โดยมีน้ำเป็นตัวทำละลายเช่นเดียวกัน จะมีอัตราส่วนระหว่าง จำนวนโมเลกุลของน้ำตาลทราย : จำนวนโมเลกุลของน้ำ และอัตราส่วนระหว่าง จำนวนโมเลกุลของน้ำตาลกลูโคส : จำนวนโมเลกุลของน้ำ เป็นเท่าไร
Appendix
1. If you have 10.0 grams of Br2 and dissolve it in 1.00 L of cyclohexane, what is the molality of the solution? The density of cyclohexane is 0.779 kg/l at room temperature. (ถ้าคุณนำ Br2 จำนวน 10.0 กรัม ละลายในไซโคลเฮกเซน 1.00 ลิตร สารละลายที่ได้จะมีความเข้มข้นกี่โมแลล ถ้าความหนาแน่นของไซโคลเฮกเซนเท่ากับ 0.779 กิโลกรัม/ลิตร)
2. How can you find the molality of a solution that contains 1.80 g of glucose (M. W. 180) and 10.0 g of water?
(สารละลายที่ประกอบด้วยกลูโคส 1.80 กรัม (มวลโมเลกุล 180) และน้ำ 10.0 กรัม มีความเข้มข้นกี่โมล/กิโลกรัม)
3. A 4 g sugar cube (Sucrose: C12H22O11) is dissolved in a 350 ml teacup of 80 °C water. What is the molality of the sugar solution? Given: Density of water at 80° = 0.975 g/ml (ซูโครส , C12H22O11 4 กรัม ละลายในน้ำซึ่งมีอุณหภูมิ 80 °C ในถ้วยน้ำชา สารละลายจะมีความเข้มข้นกี่โมล/กิโลกรัม ถ้าความหนาแน่นของน้ำในขณะนั้น = 0.975 g/ml )
4. Calculate the molality of the solution ; The density of 1.10 M aqueous solution of Pb(NO3)2 (MM = 331 g/mole) is 1.31 g/mL. (สารละลาย Pb(NO3)2 ซึ่งมีความหนาแน่น 1.31 g/mL. มีความเข้มข้นกี่โมล/กิโลกรัม กำหนดมวลโมเลกุลของ Pb(NO3)2 = 331)
5. What is the molality of a solution containing 10.5 g of ethylene glycol dissolved in 155 g of water.? (สารละลายที่ประกอบด้วยเอททิลีนไกลคอล ,C2H6O2 10.5 กรัม ละลายอยู่ในน้ำ 155 กรัม มีความเข้มข้นกี่โมล/กิโลกรัม)
6. What is the molality of a solution prepared by dissolving 10.0 g of NaCl in 600.0 kg of water? (สารละลายที่เตรียมขึ้นจากการนำ NaCl 10.0 กรัม ละลายในน้ำ 600.0 กิโลกรัม มีความเข้มข้นกี่โมล/กิโลกรัม)
7. Suppose we had 1.00 mole of sucrose (it's about 342.3 grams) and proceeded to mix it into exactly 1.00 liter water. It would dissolve and make sugar water. We keep adding water, dissolving and stirring until all the solid was gone. We then made sure everything was well-mixed. What would be the molality of this solution? Notice that my one liter of water weighs 1000 grams (density of water = 1.00 g / mL and 1000 mL of water in a liter). 1000 g is 1.00 kg, so: (สมมติว่าเรามีน้ำตาลซูโครสอยู่ 1.00 โมล (342.3 grams) นำไปละลายในน้ำ 1.00 ลิตร (1000 grams) สารละลายที่ได้จะมีความเข้มข้นกี่โมแลล)
8. Suppose you had 58.44 grams of NaCl and you dissolved it in exactly 2.00 kg of pure water (the solvent). What would be the molality of the solution? (สมมติว่าคุณมี NaCl อยู่ 58.44 กรัม แล้วนำไปละลายในบ้ำบริสุทธิ์ 2.00 กิโลกรัม สารละลายที่ได้จะมีความเข้มข้นกี่โมล/กิโลกรัม)
9. Calculate the molality of 25.0 grams of KBr dissolved in 750.0 mL pure water. (เมื่อนำ KBr 25.0 กรัม ละลายในน้ำบริสุทธิ์ 750.0 cm3 ความเข้มข้นของสารละลายเป็นกี่โมล/ลิตร)
10. A 80.0 grams of glucose (C6H12O6, mol. wt = 180. g/mol) is dissolved in 1.00 kg of water. Calculate the molality. (น้ำกลูโคส 80.0 กรัม ละลายในน้ำ 1.00 กิโลกรัม จะได้สารละลายที่มีความเข้มข้นกี่โมล/กิโลกรัม)
11. Calcuate the molality when 75.0 grams of MgCl2 is dissolved in 500.0 g of solvent. (Ans.1.58m) (เมื่อนำ MgCl2 75.0 กรัม ละลายในตัวทำละลาย 500.0 กรัม สารละลายที่ได้จะมีความเข้มข้นกี่โมล/กิโลกรัม)
12. A 100.0 grams of sucrose (C12H22O11, mol. wt. = 342.3 g/mol) is dissolved in 1.50 L of water. What is the molality? (Ans.0.195m) ; (น้ำตาล C12H22O11 ซึ่งมีมวลโมเลกุล 342.3 g/mol จำนวน 100.0 grams ละลายอยู่ในน้ำ 1.50 L สารละลายมีความเข้มข้นกี่โมล/กิโลกรัม)
13. A 49.8 grams of KI is dissolved in 1.00 kg of solvent. What is the molality? (Ans.0.30 m) ; (โพแทสเซียมไอโอไดด์ , KI จำนวน 49.8 gramsละลายอยู่ในน้ำ 1.00 kg สารละลายมีความเข้มข้นกี่โมล/กิโลกรัม)
14. What is the molality of a solution of 50.0 g of propanol (CH3CH2CH2OH) in 152 mL water, if the density of water is 1.0 g/mL? (Ans.5.47) ; (โพรพานอล (CH3CH2CH2OH) จำนวน 50.0 g ละลายอยู่ในน้ำ 152 mL สารละลายมีความเข้มข้นกี่โมล/กิโลกรัม ถ้าความหนาแน่นของน้ำคือ 1.0 g/mL)
15. An aqueous solution contains 100.0 g of ethanol (C2H5OH) in 200.0 g of solution. What is the mole fraction and molality of ethanol ? (Ans.0.281 and 21.7) (สารละลายที่ประกอบด้วยเอทานอล(C2H5OH) 100.0 กรัม ละลายอยู่ในสารละลาย 200 กรัม จะมีเศษส่วยโมลของเอทานอลเท่าไร และมีความเข้มข้นกี่โมล/กิโลกรัม)
16. Calculate the molality of each of the following solution ; (จงคำนวณหาความเข้มข้นในหน่วยโมล/กิโลกรัมของสารละลายต่อไปนี้)
a. 13.0 g benzene , C6H6, dissolved in 17.0 g carbon tetrachloride , CCl4 ; (เบนซีน, C6H6 13.0 g ละลายอยู่ในคาร์บอนเตตระคลอไรด์ , CCl4 17.0 g)
b. 5.85 g NaCl dissolved in 0.250 L of water ; (โซเดียมคลอไรด์ 5.85 g ละลายอยู่ในน้ำ 0.250 L)
17. a. How many g of sulfur, S8 , must be dissolved in 100.0 g napthalene, C10H8 ,to make a 0.16 molal solution? (จะต้องใช้ซัลเฟอร์กี่กรัม เพื่อละลายในแนพทาลีน 100.0 กรัม สารละลายที่ได้จึงจะมีความเข้มข้น 0.16 โมล/กิโลกรัม)
b. What is the molality of a solution formed by dissolving 1.80 mole of KCl in 16.0 mole of water ?
(เมื่อ KCl 1.80 mole ละลายอยู่ในน้ำ 16.0 mole สารละลายมีความเข้มข้นกี่โมล/กิโลกรัม)
18. The density of acetonitrile, CH3CN , is 0.786 g/cm3 and the density of methanol ,CH3OH, is 0.791 g/cm3 a solution is made by dissolving 20.0 cm3 CH3OH in 100.0 cm3 CH3CN (กำหนดความหนาแน่นของ acetonitrile, CH3CN ,= 0.786 g/cm3 และความหนาแน่นของ methanol ,CH3OH, = 0.791 g/cm3 ถ้านำ CH3OH 20.0 cm3 ละลายใน CH3CN 100.0 cm3 จงตอบคำถามต่อไปนี้)
a. What is the mole fraction of methanol in the solution ? (เศษส่วนโมลของเมทานอลเป็นเท่าไร)
b. What is the molality of the solution. (สารละลายมีความเข้มข้นกี่โมล/กิโลกรัม)
c. Assuming that the volumes are additive , what is the molality of CH3OH in the solution ? (สมมติว่าปริมาตรของสารละลายเท่ากับผลรวมของปริมาตรระหว่าง CH3CN + CH3OH สารละลายจะมีความเข้มข้นกี่โมล/กิโลกรัม)
19. The density of toluene , C7H8, is 0.867 g/cm3 and the density of thiophene, C4H4S , is 1.065 g/cm3. A solution is made by dissolving 15.0 g of thiophene in 250.0 cm3 of toluene. (ถ้าโทลูอีน , C7H8 มีความหนาแน่น 0.867 g/cm3 ขณะที่ไทโอฟีน , C4H4S มีความหนาแน่น 1.065 g/cm3 ถ้าสารละลายประกอบด้วย ไทโอเฟน 15.0 g ในโทลูอีน 250.0 cm3 )
a. Calculate the mole fraction of thiophene in the solution (จงคำนวณหาเศษส่วนโมลของไทโอเฟน)
b. Calculate the molality of thiophene in the solution (จงคำนวณหาความเข้มข้นในหน่วนโมล/กิโลกรัม)
c. Assuming that the volumes of the solute and solvent are additive , What is the molarity of thiophene in the solution ? (ถ้าปริมาตรของสารละลายเท่ากับปริมาตรรวมของสารที่ผสมกัน สารละลายจะมีความเข้มข้นของ thiophene เป็นกี่โมล/ลิตร)
20. Ascorbic acid , Vitamin C , is water – soluble vitamin. A solution containing 80.5 g of ascorbic acid , C6H8O6 dissolved in 210 g of water has a density of 1.22 g/cm3 at 25 oC . Calculate; (เมื่อกรอแอสคาร์บิกหรือวิตามินซี 80.5 กรัม ละลายในน้ำ 210 กรัม สารละลายที่ได้มีความหนาแน่น 1.22 g/cm3 ที่ 25 oC จงตอบคำถามต่อไปนี้)
a. the mass percentage (ความเข้มข้นร้อยละโดยมวลเป็นเท่าไร)
b. the mole fraction (เศษส่วนโมลเป็นเท่าไร)
c. the molality (มีความเข้มข้นกี่โมล/กิโลกรัม)
d. the molarity of ascorbic acid in the solution (มีความเข้มข้นกี่โมล/ลิตร)
21. A sulfuric acid solution containing 571.6 g of H2SO4 per liter of solution has a density of 1.329 g/cm3 . Calculate ; (สารละลายกรด H2SO4 1 ลิตร มี H2SO4 ละลายอยู่ 571.6 กรัม ความหนาแน่นของสารละลาย = 1.329 g/cm3 . จงคำนวณหาสิ่งต่อไปนี้)
a. the mass percentage (ความเข้มข้นร้อยละโดยมวลเป็นเท่าไร)
b. the mole fraction (เศษส่วนโมลเป็นเท่าไร)
c. the molality (มีความเข้มข้นกี่โมล/กิโลกรัม)
d. the molarity of H2SO4 in this solution (มีความเข้มข้นกี่โมล/ลิตร)
รูปภาพที่เกี่ยวข้อง

Size : 35.73 KBs
Upload : 2013-08-05 04:02:52
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|