การเกิดปฏิกิริยาเคมีคือการเปลี่ยนแปลงที่มีสารใหม่เกิดขึ้น ปริมาณสารสัมพันธ์เป็นการศึกษาเกี่ยวกับปริมาณสาร
ที่เกี่ยวข้องกันในปฏิกิริยาเคเมี
เช่น การเผาไหม้ของก๊าซธรรมชาติ (CH4) ก๊าซดังกล่าวนี้เมื่อใช้กับรถยนต์เรียกว่า NGV ; (Natural Gas
for Vehicle) หรือบางครั้งก็เรียกว่า CNG ;
(Compressed Natural Gas) การเผาไหม้เป็นการทำปฏิกิริยากับก๊าซออกซิเจน (O2) สิ่งที่ได้จากปฏิกิริยาคือก๊าซ CO2 กับไอน้ำ (H2O) เขียนแสดงด้วยสมการเคมีดังนี้
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
ถ้าเข้าใจปริมาณสารสัมพันธ์จะทราบว่าปริมาณสารทั้ง 4 ชนิด ในปฏิกิริยามีความสัมพันธ์กัน ดังนี้
เลขเชิงมวล
(mass number , A) คิดจากผลรวมของจำนวนโปรตอนกับจำนวนนิวตรอน
(A = z + N หรือ A = p + N)
; พิจารณาสัญลักษณ์นิวเคลียร์ของไฮโดรเจนไอโซโทปโปรเตียม ดังรูป

* เลข 1 ที่อยู่ด้านล่าง คือจำนวนโปรตอน (p) ของไอโซโทปนี้ ซึ่งมีอยู่เพียง 1 ตัว
* เลข 1
ที่อยู่ด้านบนคือเลขเชิงมวล (A)
- บรรดาธาตุทั้งหลายในโลกนี้ ไฮโดรเจนไอโซโทปโปรเตียม เป็นไอโซโทปที่มีมวลน้อยที่สุด
คือ 1.66
x 10-24 กรัม หรือ 1 amu. ใช้ค่าดังกล่าวนี้เป็นค่ามาตรฐานสำหรับเปรียบเทียบมวลกับ
ธาตุอื่น
ๆ หรือไอโซโทปอื่น ๆ ที่มีจำนวนอะตอมเท่ากัน ค่าที่ได้จากการเปรียบเทียบก็คือมวล
อะตอมของธาตุนั้น
ๆ เช่น C จำนวน 1
อะตอม มีมวลมากกว่า H 1 อะตอม
อยู่ 12
เท่า ก็หมายความว่ามวลอะตอมของ C คือ 12
สมการแสดงการคิดมวลอะตอมของธาตุต่าง ๆ ในยุคเริ่มต้นเป็นดังนี้
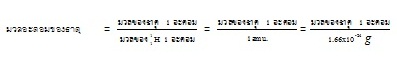
ประมาณ พ.ศ. 2504
มีการใช้ค่า 1 amu.
ในทางอ้างอิงระหว่างทางเคมีกับทางฟิสิกส์แตกต่างกัน คือ
ทางเคมีใช้ 1/16 ของค่าเฉลี่ยของมวลของอะตอมออกซิเจน (คิดเฉลี่ยจากปริมาณของทุก
ไอโซโทป ในธรรมชาติ)
ในขณะที่ทางพิสิกส์ใช้ 1/16
ของมวลอะตอมของ ออกซิเจน -16 เพียงไอโซโทปเดียว ทำให้ค่าตัวเลขแตกต่างกันเล็กน้อย จึงไม่ใช้ทั้ง
2 แบบ แล้วเปลี่ยนมาใช้แบบเดียวกัน คือใช้
ของ คาร์บอนไอโซโทปที่มีมวล 12 ซึ่งเขียนแสดงได้หลายอย่าง คือ C-12 หรือ 12C ค่าดังกล่าวนี้มีค่าเท่ากับ H 1 อะตอม
คือ 1.66 x 10-24 กรัม หรือ
1 amu. สมการที่ใช้คำนวณมวลอะตอมของธาตุจึงเปลี่ยนเป็น

การใช้หน่วยมวลอะตอมในปัจจุบัน ใช้ได้
3 แบบ คือ
ไม่ต้องใส่หน่วยใด ๆ เลข
เว้นว่างไว้ หรือใช้ amu. หรือใช้ g/mol
ก็ได้
= 12
g/mol (กรณีที่ 3 ใช้หน่วย g/mol เพราะ C
ไอโซโทปนี้ 1 mol มี
มวล 12 g )
มวลอะตอมหรือเลขเชิงมวลของธาตุต่างๆ ทั้งที่มีจริงในธรรมชาติและที่ได้จากการสังเคราะห์ ได้ผ่านการคิดคำนวณมาแล้วทุกธาตุ ดังแสดงอยู่ในตารางธาตุทั่วไป (คลิ้ก เพื่อเปิดตารางธาตุ)
เลขเชิงมวลหรือมวลอะตอมของธาตุส่วนใหญ่จะเห็นได้ว่าไม่เป็นจำนวนเต็ม ทั้งนี้เนื่องจากธาตุส่วนมากมีหลายไอโซโทป จึงต้องคิดมวลอะตอมเฉลี่ย ดังสมการ
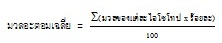
(คลิ้ก ชมการหามวลอะตอมเฉลี่ย)
สิ่งที่จะต้องทำความเข้าใจเอาไว้ตลอดเวลาก็คือ เลขเชิงมวลหรือมวลอะตอมของธาตุใด ๆ เป็นตัวเลขที่แสดงว่าธาตุนั้น ๆ 1 อะตอม มีมวลมากกว่า 1H 1
อะตอม หรือ 1/12 ของ 12C จำนวน 1 อะตอม อยู่กี่เท่า เช่น 20Ne หมายความว่า Ne 1 อะตอม มีมวลมากกว่า 1H 1 อะตอม หรือ 1/12 ของ 12C จำนวน 1
อะตอม 20 เท่า
คำว่า “ มวลอะตอมของธาตุ” กับคำว่า “มวลของธาตุ 1 อะตอม หรือหลาย ๆ อะตอม” คำทั้งสองนี้ความหมายสัมพันธ์กัน คือ มวลอะตอมของธาตุ (atomic mass) เป็นค่าที่บอกว่าธาตุนั้น ๆ
1 อะตอมมีมวลมากกว่า 1H จำนวน 1 อะตอม หรือ 1/12 ของ 12C จำนวน 1 อะตอม อยู่กี่เท่า หรือกี่ amu. ส่วนคำว่า มวลของธาตุ 1 อะตอม (mass of 1 atom) เป็นค่าที่บอกน้ำหนัก
หรือมวลของธาตุนั้น ๆ ว่า ธาตุดังกล่าวจำนวน 1 อะตอม มีน้ำหนัก (มวล) กี่กรัมหรือกี่กิโลกรัม เช่น 20Ne มีความหมายดังนี้
1. ในความหมายของ “มวลอะตอมของธาตุ” (atomic mass) หมายความว่า Ne 1 อะตอม มีมวลมากกว่า 1H 1 อะตอมหรือ 1/12ของ 12C จำนวน 1 อะตอม อยู่ 20 เท่า
หรือ 20 amu. ; (atomic mass of Ne = 20 amu.)
2. ในความหมายของ “มวลของธาตุ 1 อะตอม “ (mass of 1 atom) หมายความว่า 20Ne 1 อะตอมมีมวล = 20 x 1.66 x 10-24 กรัม = 3.320 x 10-23 กรัม ;
(mass of Ne 1 atom = 20 x 1.66 x 10-24 g )
* ถ้ามี Ne 2 อะตอม จะมีมวล = 2 x 20 x 1.66 x 10-24 กรัม
= 6.640 x 10-23 กรัม ;
* ถ้ามี Ne 100 อะตอม จะมีมวล =100 x 20 x 1.66 x 10-24 กรัม
= 3.320 x 10-21 กรัม
* ถ้ามี Ne 1,000 อะตอม จะมีมวล = 1,000 x 20 x 1.66 x 10-24 กรัม
= 3.320 x 10-20 กรัม ;
* ถ้ามี Ne 6.02 x 1023 อะตอม จะมีมวล = (6.02 x 1023) x 20 x (1.66 x 10-24 ) กรัม
= 19.986 กรัม
= 20 กรัม
แบบฝึกหัด
1. จงหามวลอะตอมของธาตุและมวลของธาตุ 1 อะตอม จากธาตุที่กำหนดให้ต่อไปนี้
|
ธาตุที่กำหนด
|
มวลอะตอมของธาตุ
|
มวลของธาตุ 1
อะตอม
|
|
40Ca
|
40
|
40
x 1.66 x 10-24 กรัม
6.64
x 10-23
กรัม
|
|
63.5Cu
|
|
|
|
127I
|
|
|
|
108Ag
|
|
|
|
128U
|
|
|
2. ถ้า Al 1 อะตอมมีมวล 4.482 x 10-23 กรัม มวลอะตอมของ Al เป็นเท่าใด
3. ทองคำ (Au) ขนาด 1 บาท มีน้ำหนัก 15.20 กรัม อยากทราบว่าประกอบด้วยจำนวนอะตอมของทองคำกี่อะตอม (Au = 197)
4. เหล็กมีมวลอะตอม 55.8 ข้อความแต่ละข้อต่อไปนี้ถูกหรือผิดถ้าผิดจงแสดงสิ่งที่ถูกต้อง (Fe=55.8)
ก. เหล็ก 1 อะตอม หนัก 55.8 กรัม
ข. เหล็ก 1 อะตอม หนัก 55.8 เท่าของคาร์บอน-12 จำนวน 1 อะตอม
ค. เหล็ก 1 อะตอมหนักเป็น 55.8 เท่าของ มวลของ C-12 จำนวน 1 อะตอม
ง. มวลอะตอมของเหล็กเท่ากับ 55.8 กรัม
จ. มวลอะตอมของเหล็กเท่ากับ 55.8 amu.
5. ธาตุ X จำนวน 4 อะตอม มีมวลเท่ากับธาตุ Y จำนวน 2 อะตอม ถ้า Y มีมวลอะตอมเท่ากับ 14 อยากทราบว่ามวลอะตอมของ X เป็นเท่าไร (ตอบ 7)
6. ธาตุ Na Ca และ Ne มีน้ำหนักชนิดละ 1.00 กรัม จะมีจำนวนอะตอมชนิดละกี่อะตอม (Na=23 Ca=40 Ne=20)
7. ธาตุ He Hg และ Mg ชนิดละ 10,000 อะตอม จะมีน้ำหนักชนิดละกี่กรัม (He=4 Hg=200 Mg=24)
8. He กี่อะตอมจึงจะมีน้ำหนักเท่ากับ Ar 100 อะตอม (He=4 Ar=40)
9. ถ้าทองคำน้ำหนัก 1 บาท( 15.2 กรัม ) ราคา 20,000 บาท อยากทราบว่าถ้าซื้อทองคำด้วยเงิน 1 บาท จะได้ทองคำกี่อะตอม ( Au=197 )
มวลโมเลกุล (molecular mass)
โมเลกุลที่แท้จริงนั้นเป็นสมบัติของสารโคเวเลนต์ เช่น CO2 CH4 C6H12O6 แต่สำหรับสารไอออนิกแม้จะไม่มีโมเลกุลที่แท้จริงแต่ก็ให้ถือว่าสูตรที่เขียนแสดงสารไอออนิก
มีความหมายเสมือนหนึ่งเป็นสูตรโมเลกุลเช่นเดียวกับสารโคเวเลนต์ แต่ต้องทราบว่าสูตรของสารไอออนิกเป็นสูตรอย่างง่าย คือแสดงอัตราส่วนอย่างต่ำที่ไอออนรวมตัวกันเป็นสารไอออนิกนั้น
ๆ ให้เเรียกสูตรของสารไอออนิกว่าหน่วยสูตร(formalar unit) แทนคำว่าโมเลกุล เช่น NaCl เราไม่เรียกว่า NaCl 1 โมเลกุล แต่ให้เรียกว่า NaCl 1 หน่วยสูตร
โดยทั่วไปจะถือว่าโมเลกุลหมายถึงสารที่ประกอบด้วยอะตอมตั้งแต่ 2 อะตอมขึ้นไป ถ้าเป็นอะตอมของธาตุเดียวกัน โมเลกุลนั้นก็จะเป็นโลเลกุลของธาตุ เช่น
H2 Cl2 O2 F2 Br2 I2 O3 P4 S8 C60 ถ้าเป็นอะตอมของธาตุต่างชนิดกัน โมเลกุลนั้นก็จะเป็นโมเลกุลของสารประกอบ เช่น HCl H2O H2SO4 C6H12O6 KClO3 …
การที่อะตอมรวมตัวกันเป็นโมเลกุลเกิดจากการทำปฏิกิริยาเคมีแล้วสร้างพันธะเคมีกัน ซึ่งจะต้องเป็นไปตามกฎทรงมวล (law of conservation of mass) คือมวลสารก่อนและหลังปฏิกิริยาจะมีค่าเท่ากัน
ฉะนั้นมวลโมเลกุลจึงมีค่าเท่ากับผลรวมของมวลอะตอมทั้งหมดที่มีอยู่ในโมเลกุลนั้นๆ นอกจากนั้นยังเป็นไปตามกฎสัดส่วนคงที่ด้วย(law of definite proportion) คือ อัตราส่วนโดยมวลของธาตุที่รวมตัวกัน
จะมีค่าคงที่ เช่น C + O2 → CO2
กฎทรงมวล มวลของ C + มวลของ O2 = มวลของ CO2
กฎสัดส่วนคงที่ มวลของ C : มวลของ O2 = 12 : 32
การหามวลโมเลกุลหรือมวลของหน่วยสูตร หาได้จากผลรวมของมวลอะตอมของธาตุทั้งหมดที่มีอยู่ในสารนั้น ๆ
(คลิ้ก ศึกษาการคิดมวลโมเลกุลและมวลของหน่วยสูตร)
มวลโมเลกุล (molecular mass) มีความหมายทำนองเดียวกับมวลอะตอม(atomic mass , mass number) ของธาตุดังที่ผ่านมาแล้ว ต่างกันเพียงที่ว่าสิ่งหนึ่งเป็นอะตอม สิ่งหนึ่งเป็นโมเลกุล
เปรียบเทียบกันดังตาราง
|
อนุภาค
|
ชนิดของอนุภาค
|
มวลของอนุภาค
|
|
มวลอะตอม
|
มวลโมเลกุล
|
มวล/โมล
|
|
C
|
อะตอม
|
12 amu.
|
-
|
12 g/mol
|
|
O2
|
โมเลกุล
|
-
|
32 amu.
|
32 g/mol
|
|
CO2
|
โมเลกุล
|
-
|
44 amu.
|
44 g/mol
|
สูตรโมเลกุลของสารต่าง ๆ ทำให้เราทราบว่าสารนั้น ๆ มีธาตุใดเป็นองค์ประกอบอยู่บ้าง และจะทำให้ทราบร้อยละโดยมวลของธาตุที่เป็นองค์ประกอบด้วย การคำนวณหาร้อยละของธาตุ
ที่เป็นองค์ประกอบเป็นดังสมการ
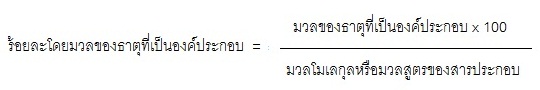
ตัวอย่าง ถ้าสูตรโมเลกุลของน้ำคือ H2O อยากทราบว่ามี H และ O เป็นองค์ประกอบอยู่ร้อยละเท่าไร (H=1 O=16)
วิธีทำ
มวลโมเลกุลของ H2O = 2H + O
= 2(1) + 16
= 18 amu.
ร้อยละโดยมวลของ H = 2(100) / 18
= 11.11
ร้อยละโดยมวลของ O = 100 – 11.11
= 88.89
ตัวอย่าง
แร่เหล็กคือสารประกอบออกไซด์ของเหล็กซึ่งมีหลายชนิดได้แก่ Fe2O3 Fe3O4 Fe2S3 ในอุตสาหกรรมถลุงเหล็กควรเลือกใช้แร่ชนิดใด (Fe=55.5 O=16 S=32)
วิธีทำ แนวคิด
การถลุงเหล็กก็คือการนำแร่เหล็กมาแยกเอาธาตุอื่น ๆ ออกไป จึงควรเลือกแร่เหล็กชนิดที่มีเหล็กเป็นองค์ประกอบมากที่สุด
ร้อยละของ Fe ใน Fe2O3 = 2Fe (100 ) / Fe2O3
= 2(55.5)(100) /159 = 69.81
ร้อยละของ Fe ใน Fe3O4 = 3Fe(100) / Fe3O4
= 3(5535)(100) /230.5 = 72.23
ร้อยละของ Fe ใน Fe2S3 = 2Fe (100) / Fe2S3
= 2(55.5)(100) / 207 = 53.62
จากร้อยละของ Fe ในแร่เหล็กแต่ละชนิดที่คำนวณได้ จะเห็นได้ว่าใน Fe3O4 มีร้อยละของ Fe เป็นองค์ประกอบมากที่สุด จึงควรเลือก Fe3O4 ในอุตสาหกรรมการถลุงเหล็ก
แบบฝึกหัด
- จงหามวลโมเลกุลหรือมวลสูตรของสารและมวลของสาร 1 โมเลกุลหรือ 1 หน่วยสูตร ตามที่กำหนด
H=1 C=12 N=14 O=16 S=32 Fe=56 K=39 Cu=63.5 Cr=52
|
สารที่กำหนด
|
มวลโมเลกุลหรือมวลสูตรของสาร
|
มวลของสาร 1
โมเลกุล
หรือ 1
หน่วยสูตร
|
|
C12H22O11
|
(342amu.)
|
|
|
Fe3O4
|
(232amu.)
|
|
|
K3[Fe(CN)6]
|
(245amu.)
|
|
|
(NH3)4CuSO4
|
(227.5amu.)
|
|
|
K2Cr2O7
|
(294amu.)
|
|
2. จงหามวลโมเลกุล (molecular mass) กฎสัดส่วนคงที่ (law of definite proportion) และมวลของสาร 1 โมเลกุล (mass of 1 molecule) หรือมวลของหน่วยสูตร
(formula unit) จากสูตรของสารที่กำหนดให้
H = 1 C=12 O=16 Mg=24 S=32 Cl=35.5 K=39 Ca=40 Mn=55
|
สูตรของสารที่กำหนด
|
มวลโมเลกุล
หรือมวลของหน่วยสูตร
|
มวลของสาร
1 โมเลกุล
หรือ 1
หน่วยสูตร
|
มวล/โมล
(molar
mass)
|
|
H2
|
H+H
1+1
= 2
|
-
|
|
|
Cl2
|
Cl+Cl
35.5+35.5=71
|
-
|
|
|
O2
|
O+O
16.16=32
|
-
|
|
|
HCl
|
H+Cl
1+35.5=36.5
|
H:Cl
1:35.5
|
|
|
H2O
|
2H+O
(2x1)+16=18
|
H:O
2:16
1:8
|
|
|
C6H12O6
|
6C+12H+6O
(6x12)+(12x1)+(6x16)
72+12+96=180
|
C:H:O
72:12:96
6:1:8
|
|
|
MgSO4
|
Mg+S+4O
24+32+(4x16)
24+32+64=120
|
Mg:S:O
24:32:64
3:4:8
|
|
|
Ca(OH)2
|
Ca+2O+2H
40+(2x16)+(2x1)=74
40+32+2
|
Ca:O:H
40:32:2
20:16:1
|
|
|
KMnO4
|
K+Mn+4O
39+55+(4x16)=158
39+55+64
|
K:Mn:O
39:55:64
|
|
|
(NH4)2SO4
|
2N+8H+S+4O
(2x14)+(8x1)+32+(4x16)=128
28+8+32+64
|
N:H:S:O
28:8:32:64
7:2:8:13
|
|
3. Determine the fraction and percent composition of each element below (answer to one decimal place): (จงหาร้อยละโดยมวลของแต่ละธาตุที่เป็นองค์ประกอบในสารที่กำหนดให้ต่อไปนี้
คิดทศนิยม 1ตำแหน่ง) ; (H=1 C=12 N=14 O=16 Na=23 Al=27 S=32 Cl=35.5 Ca=40)
|
H2SO4
|
ร้อยละโดยมวลของ H
|
ร้อยละโดยมวลของ S
|
ร้อยละโดยมวลของ O
|
|
Ca(OH)2
|
ร้อยละโดยมวลของ Ca
|
ร้อยละโดยมวลของ O
|
ร้อยละโดยมวลของ H
|
|
HC2H3O2
|
ร้อยละโดยมวลของ H
|
ร้อยละโดยมวลของ C
|
ร้อยละโดยมวลของ O
|
|
CO2
|
ร้อยละโดยมวลของ C
|
ร้อยละโดยมวลของ O
|
|
|
N2O
|
ร้อยละโดยมวลของ N
|
ร้อยละโดยมวลของ O
|
|
|
NaOCl
|
ร้อยละโดยมวลของ Na
|
ร้อยละโดยมวลของ O
|
ร้อยละโดยมวลของ Cl
|
|
Al2S3
|
ร้อยละโดยมวลของ Al
|
ร้อยละโดยมวลของ S
|
|
4. Which of the following ores containingcopper have the highest copper content on a weight percentage basis? (Atomic weights: C = 12.01, O = 16.00, H =1.008,
Cu = 63.55, Fe = 55.85, S =32.06). (Ans.b) (สินแร่ทองแดงแต่ละชนิดต่อไปนี้ ชนิดใดมีร้อยละโดยมวลของทองแดงมากที่สุด)
a) CuFeS2 b) Cu2(CO3)(OH)2 c) Cu3(CO3)2(OH)2
5. Which of the following compounds has the smallest percent of sulfur by mass? (Atomic weights: S = 32.06, O = 16.00, Li = 6.94, Na = 22.99, Mg =24.30). (Ans.e)
(สารประกอบต่อไปนี้ชนิดใดมีร้อยละโดยมวลของซัลเฟอร์น้อยที่สุด)
a) SO2 b) Na2S c) SO3 d) Li2S e) MgSO4
6. The average mass of a molecule ofpenicillin G is 5.55 x 10-22 g. Calculate the molecular weight of penicillin G.(Ans.a) ( ยาเพนิซิลลิน จี 1
โมเลกุล มีมวลเฉลี่ย = 5.55 x 10-22 g จงคำนวณหามวลโมเลกุล ของยานี้)
a) 334 b) 321 c) 242 d) 265 e) 289
7. The average mass of a molecule of vitamin B12 is 2.24 x 10-21 g. Calculate the molecular weight of
vitamin B12.(Ans.a) (วิตามิน บี 12 จำนวน 1 โมเลกุล มีมวลเฉลี่ย = 2.24 x 10-21 g จงคำนวณหา มวลโมเลกุลของ วิตามินบี 12)
a) 1.35 x 103 b) 1.00 x 103 c) 1.35 x 104 d) 2.24 x 103 e) 1.00 x 104
8. The mass of a molecule of the artificial sweetener Aspartame is 4.89 x 10-22 g. Calculate the molecular weight
of Aspartame. (Ans.a) ( แอสปาเทมซึ่งใช้เป็นน้ำตาลเทียม จำนวน 1 โมเลกุล มีมวลเฉลี่ย = 4.89 x 10-22 g จงคำนวณหา
มวลโมเลกุลของแอสปาเทม)
a) 294 b) 364 c) 242 d) 269 e) 321
9. The controversial artificial sweetener saccharin has the molecular formula C3H5O3NS. What is the mass in grams
of one molecule? (Atomic weights: C = 12.01, H = 1.008, O = 16.00, N = 14.01, S =32.06). (Ans.b)
(ซัคคารินซึ่งใช้เป็นน้ำตาลเทียมอีกชนิดหนึ่งแต่เป็นสารควบคุม มีสูตรโมเลกุล C3H5O3NS อยากทราบว่าซัคคาริน 1 โมเลกุล
มีมวลกี่กรัม)
a) 3.85 x 10-22 b) 2.24 x 10-22 c) 2.24 x 10-21 d) 5.55 x 10-21 e) 5.55 x 10-22
10. The molecular formula of vitamin B12 is C63H84N14O14PCo. What is the mass in grams of one
molecule? (Atomic weights: C = 12.01, O = 16.00, N = 14.01, H = 1.008, P = 30.97, Co = 58.93)(Ans.b)
(สูตรโมเลกุลของวิตามินบี 12 คือ C63H84N14O14PCo. อยากทราบว่าวิตามินบี 12 จำนวน 1 โมเลกุล มีมวลกี่กรัม)
a) 3.85 x 10-22 b) 2.24 x 10-21 c) 2.24 x 10-22 d) 4.87 x 10-22 e) 5.55 x 10-21
11. Morphine, an addictive drug, has the molecular formula C17H19NO3. What is the mass in grams
of one molecule?(Atomic weights: C = 12.01, H =1.008, N = 14.01, O = 16.00). (Ans.b)
(สูตร โมเลกุลของมอร์ฟีน ซึ่งเป็นยาเสพติดคือ C17H19NO3 อยากทราบว่ามอร์ฟีนจำนวน 1 โมเลกุลมีมวลกี่กรัม)
a) 3.85 x 10-22 b) 4.74 x 10-22 c) 3.58 x 10-21 d) 2.24 x 10-22 e) 4.74 x 10-21