สมดุลเคมี (ตอนที่ 1) ความหมาย การเข้าสู่สมดุลและสมบัติของระบบในภาวะสมดุล
สมดุลเคมี (Chemical Equilibrium)(ตอนที่ 1)
ภาวะสมดุลและค่าคงที่สมดุล
กระบวนการเปลี่ยนแปลงวิทยาศาสตร์มี 3 รูปแบบ คือ การเปลี่ยนสถานะ การละลาย และการเกิดปฏิกิริยาเคมี จำแนกเป็น 2 ลักษณะคือ
1. การเปลี่ยนแปลงที่เกิดขึ้นทางเดียวไม่ย้อนกลับ (Inreversible reaction) หมายถึงเมื่อสิ่งหนึ่งเปลี่ยนแปลงไปเป็นอีกสิ่งหนึ่งแล้ว สิ่งที่เกิดขึ้นจากการเปลี่ยนแปลงนี้จะไม่สามารถเปลี่ยนกลับมาสู่ภาวะเดิมได้โดยทันที เช่น การเผาไหม้ของสิ่งต่าง ๆ เราไม่สามารถทำให้สิ่งที่เกิดจากการเผาไหม้ เปลี่ยนกลับไปเป็นสารเดิมเหมื่อนก่อนการเผาไหม้ได้อีก การเปลี่ยนแปลงลักษณะนี้ไม่มีภาวะสมดุล
(คลิ้ก ชมการเปลี่ยนแปลงไม่ผันกลับ)
2. การเปลี่ยนแปลงที่ผันกลับได้หรือย้อนกลับได้ (Reversible reaction) มีลักษณะที่สำคัญคือเมื่อสิ่งหนึ่งเปลี่ยนแปลงไปเป็นสิ่งใหม่แล้ว สิ่งใหม่ที่เกิดขึ้นก็สามารถเปลี่ยนกลับมาเป็นสิ่งเดิมได้ทันที การเปลี่ยนแปลงลักษณะนี้จะเกิดภาวะสมดุลขึ้นได้ เช่น การผลิต ก๊าซแอมโมเนีย (NH3) จากปฏิกิริยาระหว่างก๊าซไฮโดรเจน (H2) กับก๊าซไนโตรเจน (N2) ดังสมการ
3 H2(g) + N2(g) ↔ 2NH3(g)
ในการเกิดปฏิกิริยานี้ ก๊าซ H2 และ N2 เป็นสารตั้งต้น ทำปฏิกิริยากันกลายเป็นก๊าซ NH3 และในทันทีที่เกิดก๊าซ NH3 ก๊าซ NH3 ที่เกิดขึ้นจะสลายตัวกลับไปเป็นก๊าซ H2 และ N2 อย่างเดิม ฉะนั้นในเวลาเดียวกันจึงมีการเปลี่ยนแปลงเกิดขึ้น 2 กระบวนการพร้อมกัน ได้แก่
2.1 ก๊าซ H2 กับ N2 ทำปฏิกิริยากันกลายเป็นก๊าซ NH3 ดังสมการ
3 H2(g) + N2(g) → 2NH3(g)
กระบวนการนี้เกิดขึ้นก่อน เรียกว่าการเปลี่ยนแปลงไปข้างหน้า (forward change หรือ forward reaction)
2.2 ก๊าซ NH3 บางส่วนสลายตัวกลับมาเป็นก๊าซ H2 กับ N2 ตามเดิม ดังสมการ
2NH3(g) → 3H2(g) + N2(g)
กระบวนการนี้เกิดขึ้นทีหลัง เรียกว่าการเปลี่ยนแปลงย้อนกลับ (reverse change หรือ reverse reaction)
เมื่อนำการเปลี่ยนแปลงทั้ง 2 มาเขียนไว้ในสมการเดียวกัน รูปของสมการจะเป็นดังนี้
2NH3(g) ↔ 3 H2(g) + N2(g)
(คลิ้ก ชมการเปลี่ยนแปลงที่ผันกลับได้)
(คลิ้ก ชมการเปลี่ยนแปลงที่ผันกลับได้ พร้อมอธิบาย)
การดำเนินเข้าสู่ภาวะสมดุลของระบบ
การเปลี่ยนแปลงที่ผันกลับได้เมื่อเกิดขึ้นในระบบปิดและอุณหภูมิคงที่จะเข้าสู่ภาวะสมดุลได้ และมีอยู่ 3 ชนิด คือสมดุลระหว่างสถานะ สมดุลในสารสารละลายอิ่มตัว และสมดุลในปฏิกิริยาเคมี
การเข้าสู่ภาวะสมดุลเกี่ยวข้องกับอัตราเร็วของการเกิดฏิกิริยา เริ่มต้นที่ปฏิกิริยาไปข้างหน้า เพราะเป็นปฏิกิริยาที่เกิดขึ้นก่อน ขณะเริ่มต้นอัตราเร็วของปฏิกิริยาก็จะมาก แต่เมื่อเวลาผ่านไปอัตราเร็จจะค่อย ๆ ลดลง คามความเข้มข้นของสารตั้งต้นที่ลดลงเพราะถูกใช้ไป จากนั้นพิจารณาที่ปฏิกิริยาย้อนกลับ ซึ่งจะต้องเข้าใจว่าผลิตภัณฑ์ที่เกิดจากปฏิกิริยาไปข้างหน้า จะเป็นสารตั้งต้นของปฏิกิริยาย้อนกลับ ถ้าปฏิกิริยาไปข้างหน้ายังไม่เกิดขึ้น ปฏิกิริยาย้อนกลับก็จะยังไม่เกิดขึ้นเช่นกัน
ทันทีที่เกิดปฏิกิริยาไปข้างหน้า ก็จะเป็นเวลาที่ปฏิกิริยาย้อนกลับเริ่มเกิดขึ้น แต่อัตราเร็วของปฏิกิริยาย้อนกลับจะตรงข้ามกับปฏิกิริยาไปข้างหน้า คือขณะเริ่มต้นอัตราเร็วจะต่ำแต่จะเพิ่มขึ้นเมื่อเวลาผ่านไป ตามการเพิ่มขึ้นของสารผลิตภัณฑ์ที่เกิดจากปฏิกิริยาไปข้างหน้า ในที่สุดเมื่ออัตราเร็วของปฏิกิริยาทั้ง 2 ด้าน เท่ากัน ระบบก็จะเข้าสู่ภาวะสมดุล ณ เวลานั้น เช่น ปฏิกิริยาดังสมการ H2(g) + I2(g) ↔ 2HI(g) การเข้าสู่ภาวะสมดุลจะเป็นดังกราฟ
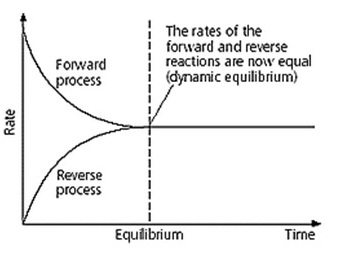
สมบัติของระบบในภาวะสมดุล
เมื่อระบบเข้าสู่ภาวะสมดุลแล้วก็จะมีสมบัติดังนี้
1. ระบบจะนิ่งและคงที่ สังเกตไม่เห็นว่ามีการเปลี่ยนแปลงทางกายภาพ เช่น ถ้าเป็นระบบที่มีสี ความเข้มของสีก็
จะคงที่ ถ้าวัดอุณหภูมิของระบบก็จะพบว่าอุณหภูมิคงที่ ถ้าวัดความเข้มข้นของสารละลายก็จะพบว่ามีความ
เข้มข้นคงที่เช่นกัน
2. ยังคงมีปฏิกิริยาหรือการเปลี่ยนแปลงทั้งไปข้างหน้าและย้อนกลับเกิดขึ้นอยู่ตลอดเวลา ด้วยอัตราเร็วที่เท่ากัน
ฉะนั้นภาวะสมดุลที่เห็นว่านิ่งและคงที่นั้น เป็นความนิ่งทางกายภาพที่เกิดจากภาวะสมดุล แต่ความจริงยังมีการ
เปลี่ยนแปลงอยู่ตลอดเวลา จึงเรียกว่าสมดุลไดนามิก (dynamic equilibrium , dynamic = การเคลื่อนที่ )
3. ไม่มีสารใดถูกใช้หมด ฉะนั้นจึงสามารถตรวจพบสารทุกชนิดที่เกี่ยวข้องกับสมดุลได้พร้อมกันอยู่ตลอดเวลา
สัดส่วนของปริมาณของสารตั้งต้นและผลิตภัณฑ์ในภาวะสมดุลต่าง ๆ เป็นไปได้หลายแบบ บางสมดุลมีสารตั้ง
ตันมากกว่าผลิตภัณฑ์ แต่บางสมดุลมีผลิตภัณฑ์มากกว่าสารตั้งต้น ดังแสดงในกราฟ
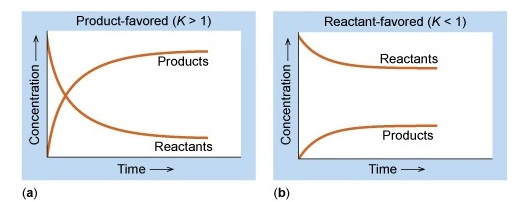
กราฟ a เป็นภาวะสมดุลที่มีผลิตภัณฑ์มากกว่าสารตังต้น เป็นเพราะปฏิกิริยาไปข้างหน้าเกิดได้ดีกว่าปฏิกิริยาย้อนกลับ จึงได้ผลิตภัณฑ์มากในขณะที่สารตั้งต้นเหลือน้อย สมดุลลักษณะนี้จะมีค่าคงที่สมดุล (K) สูง
กราฟ b เป็นภาวะสมดุลที่มีสารตังต้นมากกว่าผลิตภัณฑ์ เป็นเพราะปฏิกิริยาย้อนกลับเกิดได้ดีกว่าปฏิกิริยาไปข้างหน้าจึงได้ผลิตภัณฑ์น้อย ในขณะที่สารตั้งต้นเหลืออยู่มาก สมดุลลักษณะนี้จะมีค่าคงที่สมดุล (K) ต่ำ
ค่าคงที่สมดุล (equilibrium constant , K)
ดังได้ทราบแล้ว่าเมื่อระบบอยู่ภาวะสมดุล อัตราเร็วของปฏิกิริยาไปข้างหน้ากับอัตราเร็วของปฏิกิริยาย้อนกลับจะ
เท่ากัน เช่น
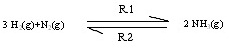
R1 คืออัตราเร็วของปฏิกิริยาไปข้างหน้า ได้แก่ 3 H2(g) + N2(g) → 2NH3(g) ซึ่งเราสามารถเขียนแสดงกฎอัตราเร็วของปฏิกิริยาได้ดังนี้ R1 = k1[H2]3[N2]
R2 คืออัตราเร็วของปฏิกิริยาย้อนกลับ ได้แก่ 2NH3(g) → 3 H2(g)+ N2(g) ซึ่งเราสามารถเขียนแสดงกฎอัตราเร็วของปฏิกิริยาได้ดังนี้ R2 = k2[NH3]2
เนื่องจากระบบอยู่ในภาวะสมดุล R1 = R2
ฉะนั้น k1[H2]3[N2] = k2[NH3]2
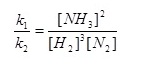
ให้เรียก 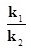 ว่าค่าคงที่สมดุลหรือ K ; ว่าค่าคงที่สมดุลหรือ K ; 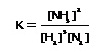
ถ้าปฏิกิริยาทั่วไปเป็นดังนี้
สารตั้งต้น ผลิตภัณฑ์
ถ้าสมดุลทั่วไปคือ aA + bB cC
ค่าคงที่สมดุล (K) จะเป็นดังนี้
K =
หมายเหตุ สารที่มีสถานะเป็นของแข็ง (s) และของเหลว (l) ไม่ต้องนำมาคำนวณค่า K
รูปภาพที่เกี่ยวข้อง

Size : 25.16 KBs
Upload : 2013-07-20 23:13:15
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|