โครงสร้างอะตอม ตอนที่ 13 ไฮบริไดเซชัน (Hybridization)
ไฮบริไดเซชัน (Hybridisation)
คือ การที่ออร์บิทัลต่างชนิดใน subenergy level หรือ
subshell ของ energylevel เดียวกัน เกิดการรวมตัวกันเป็นออร์บิทัลลูกผสม (hybrid
orbitals) ทำให้มีรูปร่างของออร์บิทัลต่างไปจากเดิม
และมีการจัดตำแหน่งของออร์บิทัลที่เกิดขึ้นใหม่ให้เกิดความสมดุลมากที่สุด จึงเกิดรูปทรงเรขาคณิตขึ้นมาใหม่ด้วย
ไฮบริไดเซชั่นจะเกิดขึ้นเมื่ออะตอมถูกกระตุ้นให้มีพลังงานสูง
(เกิดขึ้นได้กับธาตุบางธาตุเท่านั้น) กล่าวคือขณะที่อะตอมมีพลังงานต่ำ
(Ground state) การจัดอิเล็กตรอนจะเป็นแบบปกติ แต่เมื่อมีพลังงานสูง (Excited state) อิเล็กตรอนบางตัวในบางออร์บิทัลของ subshell หรือ subenergy
level ที่มีพลังงานต่ำกว่า จะย้ายที่ไปอยู่ในออร์บิทัลของ subshell หรือ subenergy
level ที่มีพลังงานสูงกว่า โดย
subshell หรือ subenergy level ดังกล่าวต้องอยู่ใน energy level เดียวกัน จากนั้นจึงรวมตัวกันหรือเรียกว่าเกิด
hybridisation เป็น orbitals ชุดใหม่ เรียกว่า hybrid orbitals อิเล็กตรอนทุกตัวใน hybrid
orbitals มีพลังงานเท่ากัน ให้สังเกตว่าจำนวนออร์บิทัลเดิมกับจำนวน hybrid
orbitals ที่เกิดขึ้นจะมีเท่ากัน ในที่นี้จะกล่าวเฉพาะไฮบริไดเซชันที่มีชื่อว่า sp sp2 sp3 sp3d และ
sp3d2 เท่านั้น พิจารณาจากตัวอย่างต่อไปนี้
ตัวอย่าง
การเกิดไฮบริไดเซชัน sp
ธาตุที่จะเกิดไฮบริไดเซชันชนิดนี้ได้
อย่างน้อยต้องเป็นธาตุคาบที่
2 ขึ้นไป ธาตุคาบที่
1 เกิดไฮบริไดเซชันไม่ได้เพราะไม่มี subenergy level p ธาตุที่จะเกิดไฮบริไดเซชันแบบนี้การจัดอิเล็กตรอนใน subshell หรือ subenergy level
s จะเป็นแบบจัดเต็ม แต่ใน
subshell หรือ
subenergy level p ยังมีออร์บิทัลว่างเหลืออยู่ ดังรูป
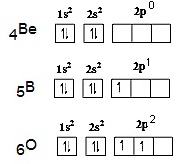
พิจารณาการจัดอิเล็กตรอนของ Be ในภาวะปกติหรือพลังงานต่ำ (ground state) จะเป็น
1s2 2s2 ไม่มีอิเล็กตรอนใน 2p
แต่เมื่อพลังงานสูง (excited state) อิเล็กตรอน
1 ตัวจาก 2s2 จะย้ายไปอยู่ในออร์บิทัล 2px จึงเกิดออร์บิทัลที่มีอิเล็กตรอนเดี่ยว 2
ออร์บิทัล คือ 2s1 และ
( 2py 2pz ยังว่างอยู่) จากนั้นรวมตัวกัน (เกิดไฮบริไดเซชัน) เป็นไฮบริดออร์บิทัลชื่อ sp (พลังงานเท่ากัน) ดังรูป
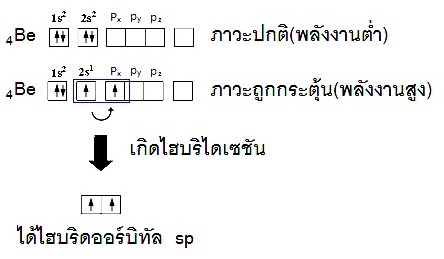 ถ้าแสดงด้วยรูปร่างออร์บิทัลจะเป็นดังนี้ ถ้าแสดงด้วยรูปร่างออร์บิทัลจะเป็นดังนี้
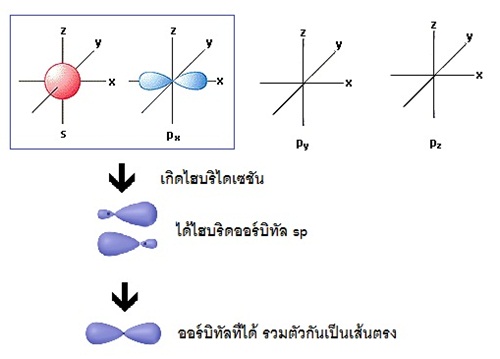
รูปทรงเรขาคณิตของไฮบริดออร์บิทัล sp มีรูปร่างเป็นเส้นตรง (linear) ทำมุม 180
องศา เมื่อทำปฏิกิริยากับธาตุอื่น
โมเลกุลของสารประกอบที่เกิดขึ้นจะมีรูปร่างเป็นเส้นตรงเช่นกัน เช่น BeCl2 ดังรูป
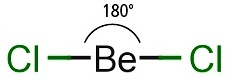
(คลิ้ก ชมการเกิดไฮบริไดเซชัน sp)
ตัวอย่าง การเกิดไฮบริไดเซชั่น sp2
ให้สังเกตว่าอะตอมที่จะเกิดไฮบริไดเซชันชนิดนี้จะจัดอิเล็กตรอนเต็มใน subshell
s เต็ม แต่
subshell p
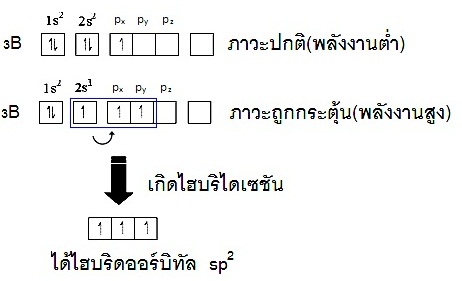
มีอิเล็กตรอนเดี่ยวอยู่บ้างแต่ยังมีออร์บิทัลว่างเหลืออยู่ เช่น การเกิดไบริไดเซชันของ 5B ขณะที่อะตอมอยู่ในภาวะปกติ (ground
state พลังงานต่ำ) การจัดอิเล็กตรอนจะเป็นดังนี้ ;
5B 1s2 2s2 2px1
2py0 2pz0
แต่เมื่อยู่ในภาวะถูกกระต้น (excited state พลังงานสูง)
อิเล็กตรอน 1 ตัวจาก
2s2
จะย้ายไปอยู่ที่ 2py ดังนี้
5B 1s2 2s1
2px1
2py1
2pz0
จากนั้น
2s1 2px1 2py1 จึงเกิด hybridisation กลายเป็น hybridorbital ชื่อ sp2 ดังรูป
ถ้าแสดงด้วยรูปร่างออร์บิทัลจะเป็นดังนี้
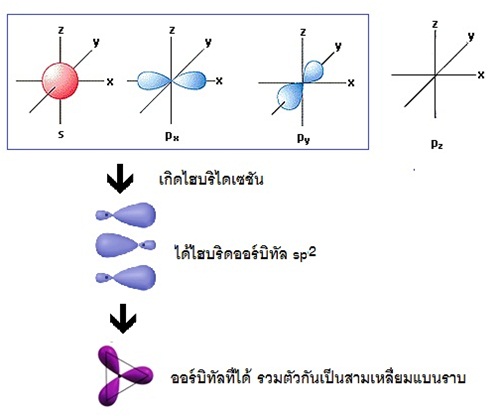
จะเห็นได้ว่ามีการผสมระหว่างออร์บิทัล 2s กับ 2px และ 2py ในขณะที่ 2pz ยังว่างอยู่ รูปทรงเรขาคณิตของไฮบริดออร์บิทัล sp2 เป็นสามเหลี่ยมแบนราบ (trigonal
plana) ทำมุม 120 องศา เมื่อทำปฏิกิริยากับธาตุอื่น โมเลกุลของสารประกอบที่เกิดขึ้น เช่น BCl3 จะมีรูปทรงเรขาคณิตเป็นสามเหลี่ยมแบนราบเช่นกัน ดังรูป
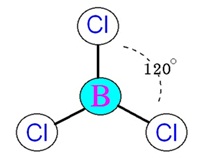
(คลิ้ก
ชมการเกิดไฮบริไดเซชัน sp2 )
ตัวอย่าง การเกิดไฮบริไดเซชั่น sp3
ให้สังเกตว่าอะตอมที่จะเกิดไฮบริไดเซชันชนิดนี้จะจัดอิเล็กตรอนเต็มใน subshell
s เต็ม แต่
subshell p มีอิเล็กตรอนเดี่ยวอยู่ 2
ออร์บิทัล ว่าง 1
ออร์บิทัล เช่น
6C
ถ้าเกิด ไฮบริไดเซชัน
sp3
จะเป็นดังนี้
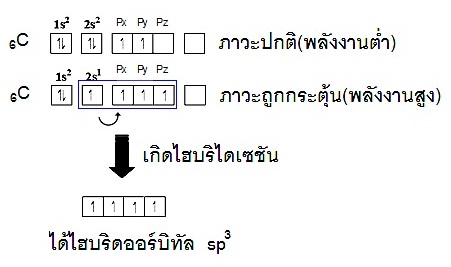
ถ้าแสดงด้วยรูปร่างออร์บิทัลจะเป็นดังนี้
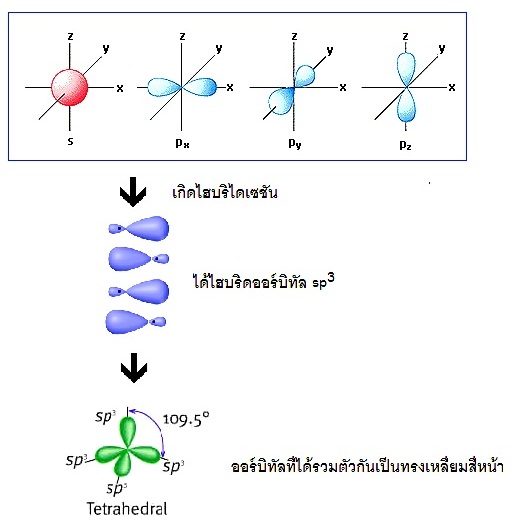
จะเห็นได้ว่าเป็นการผสมระหว่าง ออร์บิทัล
2s 2px 2py และ 2pz รูปทรงเรขาคณิตของไฮบริดออร์บิทัล sp3
เป็นทรงเหลี่ยมสี่หน้า (tetrahedral) ทำมุม 109.5
องศา เมื่อทำปฏิกิริยากับธาตุอื่น โมเลกุลของสารประกอบที่เกิดขึ้นจะเป็นทรงเหลี่ยมสี่หน้าเช่นกัน เช่น CH4 ดังรูป
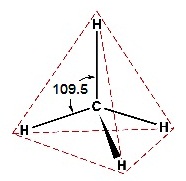
(คลิ้ก
ชมการเกิดไฮบริไดเซชัน sp3)
** กรณีของ
C มีสมบัติพิเศษในการเกิดไฮบริไดเซชัน คือเกิดได้
3 แบบ ทั้ง sp sp2
และ sp3
ตัวอย่าง
การเกิดไฮบริไดเซชั่น sp3d
ไฮบริไดเซชันชนิดนี้จะเกิดขึ้นได้เมื่ออะตอมมี subshell d ที่ยังว่างเหลืออยู่ ซึ่งอย่างน้อยจะต้องเป็นธาตุตั้งแต่คาบที่ 3 ในตารางธาตุ เพราะธาตุคาบที่ 1 และ 2
ไม่มี subshell d พิจารณาการเกิดไฮบริไดเซชันของธาตุ 15P (คาบที่ 3 หมู่ 5A ) ดังรูป
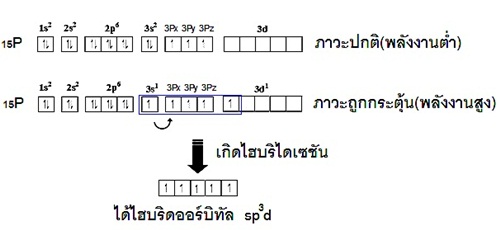
แสดงด้วยรูปร่างออร์บิทัลจะเป็นดังนี้
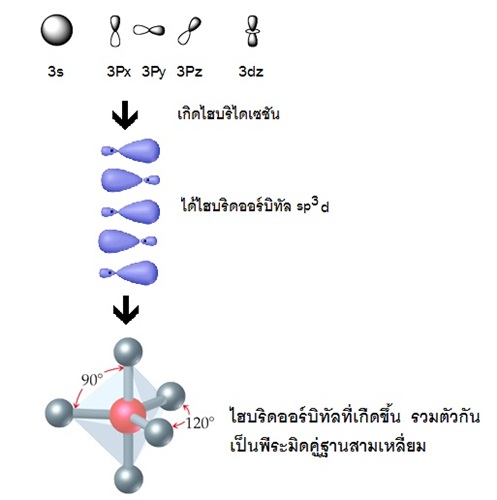
รูปทรงเรขาคณิตของไฮบริดออร์บิทัล sp3d
มีรูปร่างเป็นพีระมิดคู่ฐานสามเหลี่ยม (trigonal bipyramidal) ทำมุม 120 และ 90 องศา เมื่อทำปฏิกิริยากับธาตุอื่น
โมเลกุลของสารประกอบที่เกิดขึ้นจะมีรูปร่างเป็นพีระมิดคู่ฐานสามเหลี่ยมเช่นกัน PCl5 ดังรูป
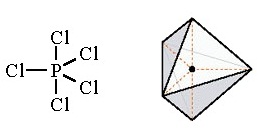
ตัวอย่างการเกิดไฮบริไดเซชั่น sp3d2
ไฮบริไดเซชันชนิดนี้จะเกิดขึ้นได้เมื่ออะตอมมี
subshell d
ที่ยังว่างเหลืออยู่ ซึ่งอย่างน้อยจะต้องเป็นธาตุตั้งแต่คาบที่ 3
ของตารางธาตุ เพราะธาตุคาบที่ 1 และ 2
ไม่มี subshell d พิจารณาการเกิดไฮบริไดเซชันของธาตุ 16S (คาบที่ 3 หมู่ 6A) ดังรูป
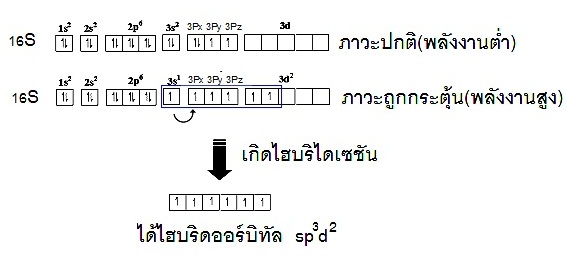
แสดงด้วยรูปร่างออร์บิทัลจะเป็นดังนี้
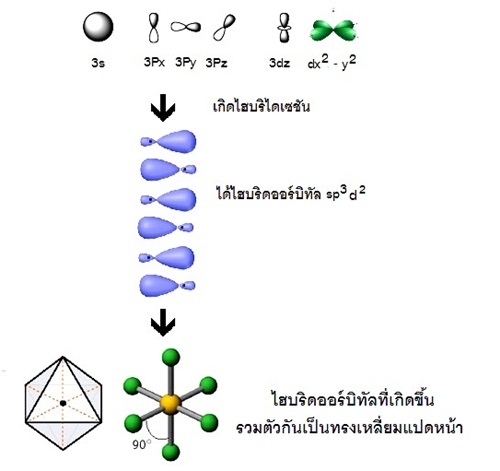
รูปทรงเรขาคณิตของไฮบริดออร์บิทัล sp3d2
มีรูปร่างเป็นทรงเหลี่ยมแปดหน้า ( octrahedral) ทำมุม 90 องศา เมื่อทำปฏิกิริยากับธาตุอื่น
โมเลกุลของสารประกอบที่เกิดขึ้นจะมีรูปร่างเป็นทรงเหลี่ยมแปดหน้าเช่นกัน SF6
ดังรูป
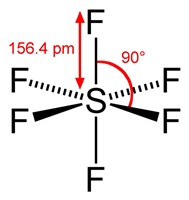
(คลิ้ก
ชมการเกิดไฮบริไดเซชัน sp
sp2 sp3 sp3d sp3d2 )
การเกิดไฮบริไดเซชัน มีผลต่อการทำปฏิกิริยาของธาตุต่าง ๆ ธาตุบางธาตุมีการจัดอิเล็กตรอนคล้ายกันแต่ทำปฏิกิริยาได้สารประกอบแตกต่างกัน เช่น N กับ P
เป็นธาตุหมู่ 5A มีเวเลนซ์อิเล็กตรอนเท่ากับ 5
ทั้ง 2 ธาตุ
ดังนี้
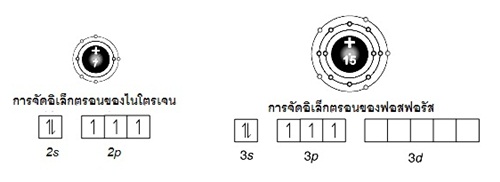
7N ; 2 ,
5 (คาบที่ 2 หมู่ 5A)
15P ; 2 , 8 , 5
(คาบที่ 3 หมู่ 5A)
เมื่อให้ธาตุทั้งสองนี้ทำปฏิกิริยากับ
Cl2 พบว่าได้ผลต่างกันคือ ไนโตรเจนจะเกิดสารประกอบ NCl3 เพียงชนิดเดียว ในขณะที่ฟอสฟอรัสเกิดสารประกอบ 2
ชนิดคือ PCl3 และ PCl5 นอกจาก 2
ธาตุนี้แล้วยังมีธาตุอื่น ๆ อีกมากมายที่มีลักษณะทำนองเดียวกันนี้ ความแตกต่างนี้อธิบายได้ด้วยการเกิดไฮบริไดเซชัน คือ ธาตุ N เป็นธาตุคาบที่ 2 ไม่มี subshell d (subenergy level d) จึงไม่เกิดไฮบริไดเซชัน จึงเกิด NCl3 ได้ชนิดเดียว ในขณะที่ P เป็นเป็นธาตุคาบที่ 3
จึงมี subshell d (subenergy
level d) ทำให้เกิดไฮบริไดเซชันได้ จึงเกิดปฏิกิริยาได้ 2
แบบ คือในภาวะปกติจะได้ PCl3 ในภาวะถูกกระตุ้นจะได้ PCl5 ดังรูป
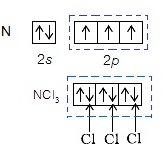
- กรณีของ
N จะเกิด NCl3 ได้ชนิดเดียว
ดังรูป
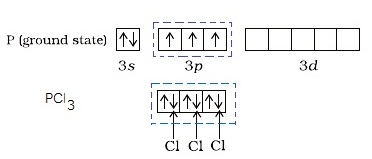
- กรณีของ P
ในภาวะปกติเกิด PCl3 ดังรูป
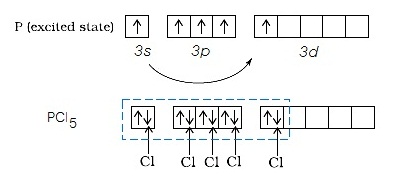
ในภาวะถูกกระตุ้นเกิด PCl5 ดังรูป
การเกิดไฮบริไดเซชันยังใช้ในการอธิบายถึงเหตุผลที่ทำให้แก๊สมีตระกูล
(แก๊สเฉื่อย) สามารถเกิดปฏิกิริยาได้
ซึ่งในยุคแรก ๆ เชื่อว่าเกิดปฏิกิริยาไม่ได้
เพราะการจัดอิเล็กตรอนของแก๊สมีตระกูลเป็นการจัดเต็มทุกออร์บิทัล เช่น การจัดอิเล็กตรอนของ Xe เป็นดังรูป
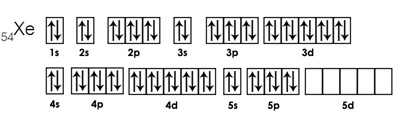
ปัจจุบันพบว่า Xe ทำปฏิกิริยาเกิดสารประกอบ
XeF4
และ XeF6 ได้
เหตุผลของการเกิดปฏิกิริยาอธิบายด้วยการเกิดไฮบริไดเซชัน
(แต่รูปแบบอาจต่างจากที่กล่าวมาในตอนต้นเล็กน้อย)
กรณีเกิดสารประกอบ XeF4 เกิดจากไฮบริไดเซชัน sp3d2 ดังรูป
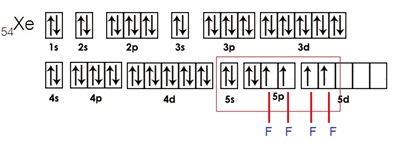
กรณีเกิดสารประกอบ XeF6 เกิดจากไฮบริไดเซชัน sp3d3 ดังรูป
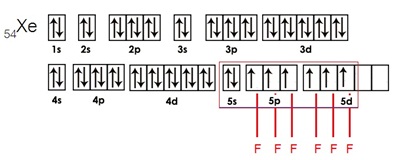
รูปภาพที่เกี่ยวข้อง

Size : 80.58 KBs
Upload : 2012-11-01 05:41:14
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|