โครงสร้างอะตอม ตอนที่ 12 รูปร่างของออร์บิทัล (Shape of orbital)
รูปร่างของออร์บิทัล (shape of
atomic orbitals)
จากการตรวจสอบหาตำแหน่งของอิเล็กตรอนในออร์บิทัลต่าง
ๆ พบว่าอิเล็กตรอนของแต่ละออร์บิทัลจะมีความหนาแน่นอยู่ในบริเวณใดบริเวณหนึ่ง
รอบนิวเคลียสทั้ง 3 มิติ เป็นรูปทรงต่าง ๆ ทำให้ทราบว่าแต่ละออร์บิทัลมีรูปร่างอย่างไร ดังรูป
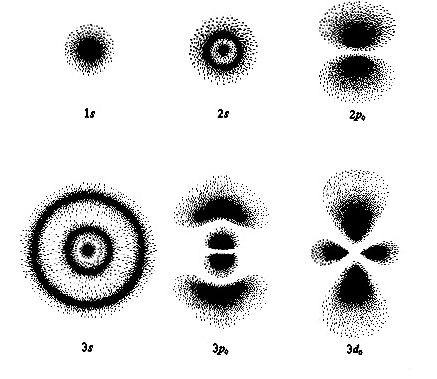

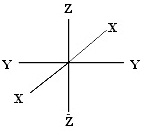
เพื่อให้เกิดความชัดเจนในการระบุตำแหน่งของพื้นที่ซึ่งมีโอกาสพบอิเล็กตรอนของออร์บิทัลต่าง
ๆ จึงกำหนดแกน X , Y และ Z ผ่านจุดศูนย์กลางของนิวเคลียส ซึ่งแนวแกน X Y และ Z อาจมีทิศทางต่ากันได้ ดังรูป
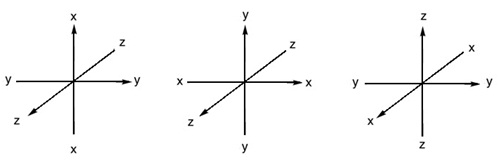
รูปร่างของ s orbital
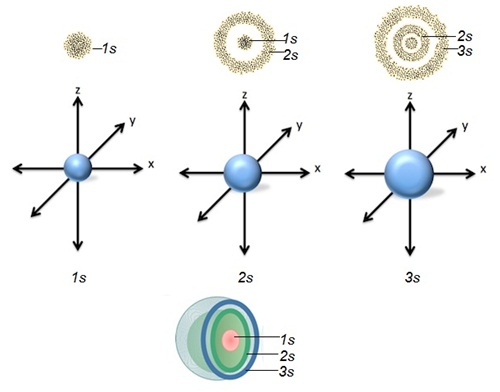
ความหนาแน่นในการพบอิเล็กตรอนของออร์บิทัล S
จะอยู่รอบนิวเคลียสเป็นกลุ่มหมอกรูปทรงกลม
จึงกล่าวได้ว่าออร์บิทัล s มีรูปร่างเป็นทรงกลม
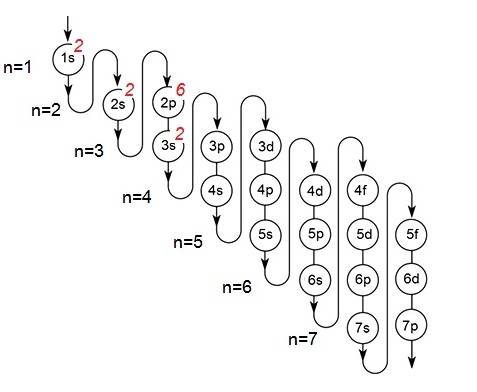
จากความรู้เรื่องระดับพลังงานของ อิเล็กตรอนเราทราบว่า ออร์บิทัล s มีอยู่ทุกระดับพลังงาน ตั้งแต่
1s ถึง 7s... ทุกออร์บิทัลมีรูปร่างเป็นทรงกลมเช่นเดียวกัน หุ้มซ้อนกันอยู่เป็นชั้น ๆ โดย 1s มีขนาดเล็กที่สุดและอยู่ในสุด 2s
3s 4s 5s 6s 7s ...
มีขนาดใหญ่ขึ้นตามลำดับ หุ้มซ้อนกัน ดังรูป
รูปร่างของ p orbital
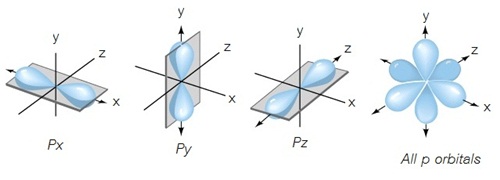
สำหรับอิเล็กตรอนในระดับพลังงานย่อย p หรือ p orbitas ประกอบด้วย 3 ออร์บิทัลคือ px py และ pz แต่ละออร์บิทัลมีอิเล็กตรอน 1 คู่ พบความหนาแน่น
ของอิเล็กตรอนแต่ละคู่ อยู่ตามแนวแกน X Y และ Z คล้ายรูปดัมเบลล์ รูปร่างของ p orbital จึงมีลักษณะคล้ายดัมเบลล์ 3 อัน ไขว้กันอยู่ ดังรูป
(คลิ้ก
ชมลักษณะของ s และ p orbitals )
ตัวอย่าง การจัดอิเล็กตรอนของ 10Ne แสดงในรูปแบบต่าง ๆ
1. แสดงใน
shell หรือ energy level
10Ne ; 2 , 8
2. แสดงใน subshell หรือ
subenergy level
10Ne 1s2 2s2 2p6
3. แสดงในออร์บิทัล
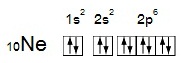
4. แสดงด้วยรูปร่างออร์บิทัล
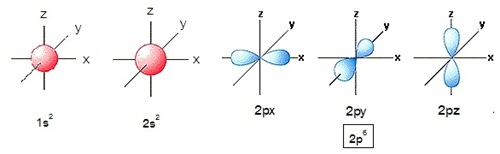
รูปร่างของ d orbital
อิเล็กตรอนใน subshell d หรือ
d orbitals มีจำนวน 10
อิเล็กตรอน จึงมี 5
ออร์บิทัล (อิเล็กตรอน 5 คู่)
แต่ละออร์บิทัลมีความหนาแน่นของกลุ่มหมอกอิเล็กตรอนดังรูป
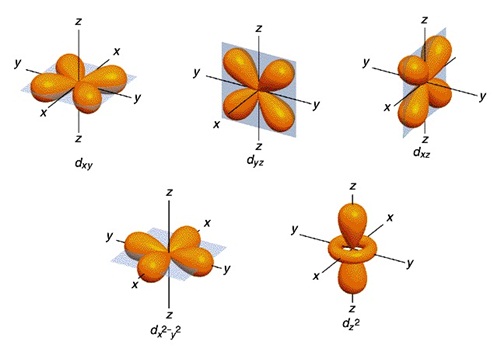
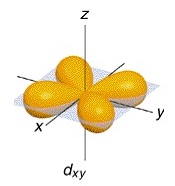
ออร์บิทัลที่ 1 ชื่อ dxy (อิเล็กตรอน 1
คู่)
พบว่ามีความหนาแน่นของกลุ่มหมอกอิเล็กตรอนคล้ายรูปดัมเบลล์ อยู่บริเวณที่ว่างระหว่างแกน X และ
Y จึงเรียกชื่อออร์บิทัลนี้ว่า dxy ดังรูป
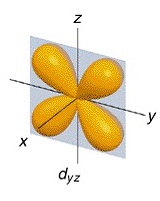
ออร์บิทัลที่
2 ชื่อ dyz
(อิเล็กตรอน 1 คู่)
พบว่ามีความหนาแน่นของกลุ่มหมอกอิเล็กตรอนคล้ายรูปดัมเบลล์ อยู่บริเวณที่ว่างระหว่างแกน Y และ
Z จึงเรียกชื่อออร์บิทัลนี้ว่า dyz ดังรูป
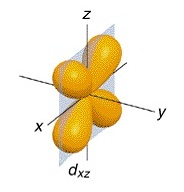
ออร์บิทัลที่ 3 ชื่อ dxz
(อิเล็กตรอน 1 คู่)
พบว่ามีความหนาแน่นของกลุ่มหมอกอิเล็กตรอนคล้ายรูปดัมเบลล์ อยู่บริเวณที่ว่างระหว่างแกน X และ
Z จึงเรียกชื่อออร์บิทัลนี้ว่า dxz ดังรูป
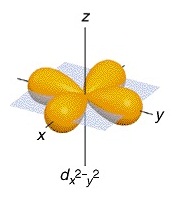
ออร์บิทัลที่ 4 ชื่อ d x2-y2 (อิเล็กตรอน 1
คู่)
พบว่ามีความหนาแน่นของกลุ่มหมอกอิเล็กตรอนคล้ายรูปดัมเบลล์ อยู่ตามแนวแกน X และ Y จึงเรียกชื่อออร์บิทัลนี้ว่า d x2-y2 ดังรูป
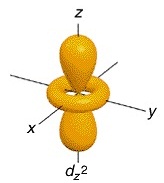
ออร์บิทัลที่ 5 ชื่อ dz2 (อิเล็กตรอน 1
คู่) พบว่ามีความหนาแน่นของกลุ่มหมอกอิเล็กตรอนคล้ายรูปดัมเบลล์อยู่ตามแนวแกน z โดยมีวงกลมคล้าย ๆ โดนัต อยู่ตรงกลาง
จึงเรียกชื่อออร์ บิทัลนี้ว่า dz2 ดังรูป
รูปร่างของ f orbital
อิเล็กตรอนในระดับพลังงานย่อย f มีทั้งหมด 14 ตัว จึงมี 7 ออร์บิทัล มีความซับซ้อนมากกว่า s p และ d ดังรูป
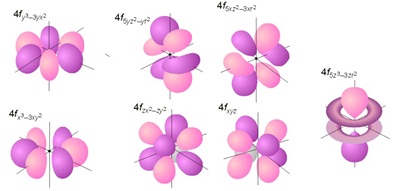
(คลิ้กชม s p และ d orbital)
การจัดอิเล็กตรอนกับตำแหน่งของธาตุในตารางธาตุ
ตารางธาตุที่ใช้อยู่ในปัจจุบันได้รับการพัฒนาต่อเนื่องมาอย่างเป็นระบบ การจัดธาตุแต่ละธาตุเอาไว้ในตารางธาตุนั้น ใช้การจัดอิเล็กตรอนของธาตุเป็นตัวกำหนด เรียกบรรทัดตามแนวนอน ของตารางธาตุว่าคาบ (period)
มีทั้งหมด 7 คาบ และเรียกบรรทัดตามแนวตั้งของตารางธาตุว่าหมู่ (group)
มีทั้งหมด 16 หมู่ แต่มี 18 แถว
(หมู่ 8B มี 3 แถว)
แบ่งออกเป็น 2
พวก คือ หมู่ A เป็นธาตุธรรมดา ประกอบด้วยโลหะและอโลหะ จำแนกเป็น
8 หมู่ย่อย คือ
1A 2A 3A
4A 5A 6A
7A 8A สำหรับธาตุหมู่ B เป็นโลหะแทรนซิชัน ทุกธาตุเป็นโลหะ จำแนกเป็นหมู่ย่อย 8
หมู่เช่นกันคือ 1B 2B
3B 4B 5B
6B 7B 8B (หมู่ 8B มี 3 แถว)
การนับจำนวนหมู่ของธาตุตามระบบเอสไอ
( SI = System International Unit ) จะไม่แยกออกเป็นหมู่ A หรือ B แต่นับเป็นตัวเลขเริ่มจากซ้ายสุดเป็น 1
ไปถึงขวาสุดเป็น 18
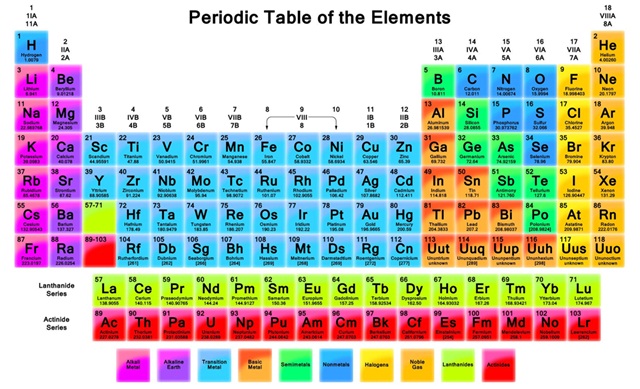
ตำแหน่งของธาตุในตารางธาตุจะสัมพันธ์กับการจัดอิเล็กตรอนของแต่ละธาตุ คือจัดให้ธาตุที่มีจำนวนระดับพลังงาน (shell , energy level) เท่ากันเอาไว้ในคาบเดียวกัน และจำนวนระดับ พลังงาน (energy level) กับลำดับที่ของคาบ (period) ในตารางธาตุจะเท่ากัน ตารางธาตุในปัจจุบันมี 7
คาบ
ฉะนั้นธาตุใดที่จัดเอาไว้ในคาบที่
1 ถึง 7
ก็จะมีจำนวนระดับพลังงาน 1 ถึง
7 ระดับ ตามลำดับ
เฉพาะธาตุหมู่
A จัดให้ธาตุที่มีเวเลนซ์อิเล็กตรอนเท่ากันเอาไว้หมู่
(group) เดียวกัน ธาตุหมู่ A มี 8 หมู่
ฉะนั้นธาตุที่จัดเอาไว้ในหมู่ 1A ถึง 8A จะมีเวเลนซ์อิเล็กตรอนเ ท่ากับ 1
ถึง 8 ตามลำดับ (ยกเว้น
He จัดไว้หมู่ 8A แต่มีเวเลนซ์อิเล็กตรอน =2) เช่น
3Li ; 2 , 1 (อยู่คาบที่ 2 เพราะมีระดับพลังงาน 2 ระดับ
อยู่หมู่ 1A เพราะมีเวเลนซ์อิเล็กตรอน = 1)
12Mg ; 2 , 8 , 2 (อยู่คาบที่ 3 หมู่ 2A )
31Ga ; 2 , 8 , 18 , 3 (อยู่คาบที่ 4
หมู่ 3A )
50Sn ; 2 , 8 , 18 , 8 , 4 (อยู่คาบที่ 5 หมู่ 4A )
56Ba ; 2 , 8 , 18 , 18 , 8 , 2 (อยู่คาบที่ 6 หมู่ 2A )
53I ; 2 , 8 , 18 , 18 , , 7 (คาบที่ 5 หมู่ 7A )
ธาตุหมู่
B
จำนวนเวเลนซ์อิเล็กตรอนจะไม่สัมพันธ์กับหมู่ของธาตุ
คือไม่ว่าจะอยู่หมู่ใดก็จะมีเวเลนซ์อิเล็กตรอนไม่เกิน 1 ถึง 2 ส่วนมากจะมี 2 แต่จำนวนระดับพลังงานกับลำดับที่ของ คาบในตารางธาตุยังสัมพันธ์กันอยู่ เช่น
21Sc
; 2 , 8 , 9 , 2 ( อยู่คาบที่ 4 เพราะมีระดับพลังงาน 4
ระดับ หมู่ 3B เวเลนซ์อิเล็กตรอนกับหมู่ไม่สัมพันธ์กัน)
22Ti ; 2 , 8 , 10 , 2 ( คาบที่ 4 หมู่ 4B )
23V ; 2 ,
8 , 11 , 2 ( คาบที่ 4
หมู่ 5B )
24Cr
; 2 , 8 , 12 , 1 ( คาบที่ 4
หมู่ 6B )
(คลิ้ก ชมการจัดอิเล็กตรอนกับตำแหน่งของธาตุในตารางธาตุ)
ตัวอย่าง ธาตุ X (ธาตุสมมติ) มีการจัดอิเล็กตรอนดังนี้ ; X 2 , 8 , 18 , 3 อยากทราบว่าจัดไว้ส่วนใดของตารางธาตุ
วิธีคิด 1. มีระดับพลังงานของอิเล็กตรอน 4 ระดับ ฉะนั้นจะอยู่คายที่ 4
2. มีเวเลนซ์อิเล็กตรอน = 3 ฉะนั้นจะอยู่หมู่ 3A
* ดูในตารางธาตุจะเป็นธาตุ Ga
ตัวอย่าง จากการจัดอิเล็กตรอนของธาตุที่กำหนดต่อไปนี้ จงพิจารณาว่าจัดไว้ส่วนใดของตารางธาตุ
X ; 2 8 8 1
Y ; 2 8 18 1
วิธีพิจารณา 1. พิจารณาจำนวนระดับพลังงาน (shell)
X และ Y มี 4 ระดับเท่ากัน แสดงว่าอยู่คาบที่ 4 เหมือนกัน
2. พิจารณาจำนวนเวเลนซ์อิเล็กตรอน มีเท่ากับ 1 เท่ากัน แต่จัดให้อยู่หมู่ 1A ทั้ง 2 ธาตุ ได้
* ถ้าเป็นธาตุหมู่ 1A จำนวนอิเล็กตรอนของระดับ (shell) ก่อนถึงเวเลนซ์อิเล็กตรอนต้องเท่ากับ 8 แต่ถ้าไม่เท่ากับ 8 จะเป็นโลหะแทรนซิชัน (กรณีเวเลนซ์อิเล็กตรอนเท่ากับ 2 ก็เช่นกัน)
* ฉะนั้น X เป็นธาตุหมู่ 1A คาบที่ 4 แต่ Y เป็นโลหะแทรนซิชันคาบที่ 4 ที่มีเลขเชิงอะตอม 29 (ดูตารางธาตุจะเป็น Cu)
แบบฝึกหัด
1. จงแสดงการจัดอิเล็กตรอนของอนุภาคต่อไปนี้ โดยแสดงในแผนผังของการจัดอิเล็กตรอน แสดงใน subshell
หรือ subenergy level แสดงใน shell หรือ energy level และแสดงในออร์บิทัล (สังเกตตัวอย่างข้อ 1.1)
1.1 12Mg
*
แสดงในแผนผังของการจัดอิเล็กตรอน
* แสดงใน subshell หรือ subenergy level ; 12Mg ; 1s2 2s2 2p6 3s2
* แสดงใน shell หรือ energy level ; 12Mg ;
2 8 2
* แสดงในออร์บิทัล ;
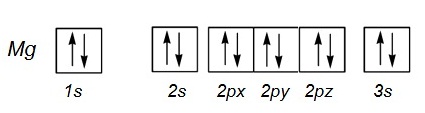
1.2
12Mg2+
*
แสดงในแผนผังของการจัดอิเล็กตรอน
* แสดงใน subshell หรือ subenergy level ;
* แสดงใน shell หรือ energy
level ;
* แสดงในออร์บิทัล ;
1.3
34Se
*
แสดงในแผนผังของการจัดอิเล็กตรอน
* แสดงใน subshell หรือ subenergy level ;
* แสดงใน shell หรือ energy
level ;
* แสดงในออร์บิทัล ;
1.4 34Se2-
* แสดงในแผนผังของการจัดอิเล็กตรอน
*
แสดงใน subshell หรือ subenergy level ;
*
แสดงใน shell
หรือ energy level ;
*
แสดงในออร์บิทัล ;
2. จงเขียนแสดงรูปร่างของออร์บิทัลต่อไปนี้
|
ชื่อออร์บิทัล
|
รูปร่าง
|
ชื่อออร์บิทัล
|
รูปร่าง
|
|
s
|
|
dxy
|

|
|
px
|

|
dyz
|

|
|
py
|

|
dxz
|

|
|
pz
|

|
dz2
|

|
|
dx2-y2
|

|
|

|
รูปภาพที่เกี่ยวข้อง

Size : 4.83 KBs
Upload : 2012-10-31 21:25:50
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|