โครงสร้างอะตอม ตอนที่ 5 แบบจำลองอะตอมของโบห์ร (ต่อ)
สเปกตรัมของแสงขาว (Spectrum of light)
เมื่อแสงขาวผ่านปริซึมหรืออุปการณ์อื่น
เช่นเกรตติ้ง หรือสเปกโตรสโป
จะทำให้แสงขาวเกิดการแยกตัวออกเป็นแสงสีต่าง เรียกว่าสเปกตรัมของแสงขาว ดังรูป
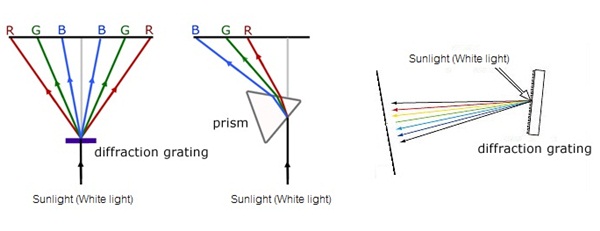
สเปกตรัมของแสงขาวประกอบด้วยสี ม่วง
คราม น้ำเงิน เขียว
เหลือง แสด แดง
ติดต่อกัน เรียกสเปกตรัมประเภทนี้ว่า สเปกตรัมต่อเนื่อง
(continuous spectrum) ดังรูป
สเปกตรัมของอะตอม (atomic
spectrum)
ถ้าเราให้พลังงานจำนวนหนึ่งแก่อะตอม จะทำให้อะตอมมีพลังงานสูงขึ้น การมัพลังงานสูงจะทำให้อะตอมไม่เสถียร (unstable) อะตอมจะต้องคายพลังงานจำนวนหนึ่งออกมาเพื่อให้มีพลังงานต่ำ ลง เป็นการทำให้อะตอมเกิดความเสถียร
(stable) พลังงานที่คายออกมานี้จะอยู่ในรูปของคลื่นแม่เหล็กไฟฟ้า จึงเกืดสเปกตรัมได้เช่นกัน เรียกว่าสเปกตรัมของอะตอม (atomic spectrum) มี ลักษณะของเส้นสีต่าง ๆ เรียกว่าสเปกตรัมแบบเส้น
(line spectrum) เป็นชนิดที่โบห์รใช้ในการเสนอแบบจำลองอะตอมของเขา
ดังรูป
สเปกตรัมของอะตอมเกิดจากการกระตุ้นให้อะตอมของธาตุมีพลังงานสูงขึ้น เช่น
เผาให้ร้อนจัดหรือกระตุ้นด้วยไฟฟ้าที่มีความต่างศักย์สูง เมื่อดูจากภายนอกจะเห็นว่ามีการเปล่งแสงออกมาเป็น แสงสีต่าง
ๆ ถ้าเป็นกรณีการเผาสารประกอบ สีของเปลวไฟที่เกิดขึ้น จะเป็นสีที่เกิดจากอะตอมของโลหะที่อยู่ในสารประกอบนั้น
ๆ เมื่อส่องดูด้วยสเปกโตรสโคป (คลิ้ก ดูรูป) หรือสเปกโตรมิเตอร์(คลิ้ก ชมการใช้สเปกโตรมีเตอร์) หรือให้ส่องผ่านปริซึ่มจะเห็นเป็นเส้นสเปกตรัม
(คลิ้กชมภาพ สีของเปลวไฟของธาตุบางชนิดจากการเผาสารประกอบ)
(คลิ้ก ชมวีดีทัศน์
Flame test คือแสดงสีของเปลวไฟเมื่อเผาสารประกอบ)
การจำแนกลักษณะของสเปกตรัม
สเปกตรัม แบ่งออกเป็น 3 ลักษณะ คือ
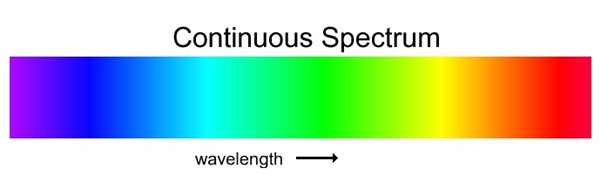
1) สเปกตรัมต่อเนื่อง (continuous spectrum)
มีลักษณะเป็นแถบสว่างของแสงสีต่าง ๆ
ต่อเนื่องกัน ไปตลอด เช่น สเปกตรัมของแสงขาว ดังรูป

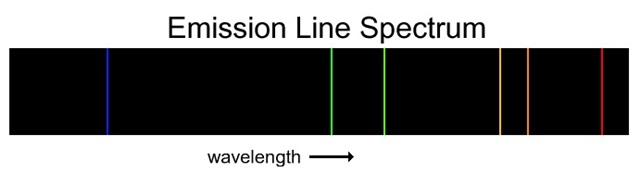
2) สเปกตรัมแบบเส้นชนิดดูดกลืน (line
absorption spectrum) มีลักษณะเป็นเส้นสีดำอยู่ในแถบสว่าง
ของสเปกตรัมต่อเนื่องของแสงขาว หรือจะมองว่าเป็นลักษณะของการที่สเปกตรัมบางส่วนของแสงขาว
หายไปก็ได้ เกิดจากอิเล้กตรอนของอะตอมดูดพลังงานจากส่วนนั้น
ๆ ไป สเปกตรัมลักษณะนี้เป็น
สเปกตรัมของอะตอม ซึ่งจะมีลักษณะเฉพาะของธาตุแต่ละชนิด ดังรูป
 3)
สเปกตรัมแบบเส้นชนิดแปล่งแสง (line
emission spectrum) มีลักษณะเป็นเส้นสว่างอยู่บนพื้น 3)
สเปกตรัมแบบเส้นชนิดแปล่งแสง (line
emission spectrum) มีลักษณะเป็นเส้นสว่างอยู่บนพื้น
สีดำ เกิดจากอิเล็กตรอนคายพลังงานออกมา สปกตรัมแบบเส้นทั้ง 2
ชนิดนี้ ถ้าเกิดจากอะตอม
ของธาตุเดียวกันจะมีตำแหน่งตรงกัน ดังรูป

(คลิ้ก
ชมสเปกตรัมทั้ง 3 แบบ)
ตัวอย่างสเปกตรัมแบบเส้นแปล่งแสง ของธาตุบางธาตุ

การทดลองที่นำไปสู่การเสนอแบบจำลองอะตอมของโบห์รก็คือ การพบว่าสเปกตรัมของไฮโดรเจน ซึ่งเป็นอะตอมที่มีอิเล็กตรอนเพียง 1
ตัว แต่เกิดเส้นสเปกตรัมที่มองเห็นจำนวน 4 เส้น ประกอบด้วย
เส้นสีแดง เส้นสีน้ำเงินปนเขียว เส้นสีน้ำเงินม่วง (สีน้ำทะเล ) และเส้นสีม่วง
(ความจริงอาจมีมากกว่า 4 เส้นก็ได้
แต่อยู่ในช่วงที่เรามองไม่เห็น)
ดังรูป
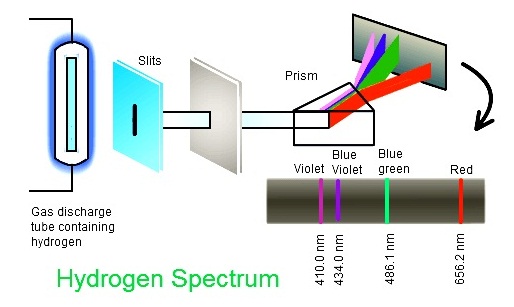
(คลิ้ก ชมการเกิด line spectrum
ของไฮโดรเจน)
โบห์รอธิบายการเกิดสเปกตรัมของอะตอมไฮโดรเจนว่า
เกิดจากพลังงานที่อิเล็กตรอนคายออกมา
กล่าวคือในตอนแรกที่ยังไม่ได้ปล่อยกระแสไฟฟ้าเข้าไปในหลอดซึ่งบรรจุแก๊สไฮโดรเจน อะตอมของไฮโดรเจนยังมีพลังงานต่ำ เรียกว่าภาวะพื้น (ground state)
อิเล็กตรอนของไฮโดรเจนจึงมีพลังงานต่ำเช่นกันและจะโคจรอยู่ใกล้
ๆ นิวเคลียส แต่เมื่อปล่อยกระแสไฟฟ้าเข้าไปจะทำให้
อะตอมมีพลังงานสูงขึ้น เรียกว่าภาวะถูกกระตุ้น
(excited state) อิเล็กตรอนจะดูดพลังงานจำนวนหนึ่งเข้าไป ขั้นตอนนี้ทำให้เกิดเส้นสเปกตรัมชนิดดูดกลืน ซึ่งพลังงานส่วนที่ดูดไปนี้ถ้าดูจากแถบ สเปกตรัมต่อเนื่อง จะเห็นเป็นเส้นสีดำแทรกอยู่ แสดงว่ามีการดูดพลังงานจากบริเวณนั้นไป ดังรูป
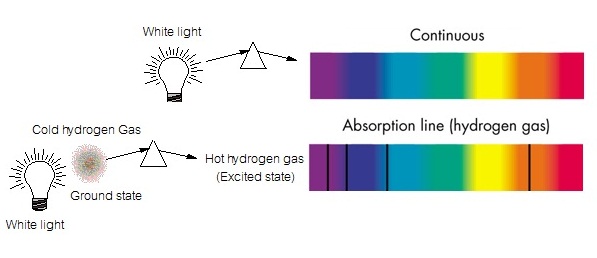
แต่ละส่วนของแถบสเปกตรัมมีพลังงานไม่เท่ากัน ทางด้านสีแดงจะมีพลังงานต่ำกว่าทางด้านสีม่วง ฉะนั้นเมื่ออิเล็กตรอนดูดพลังงานจากด้านสีแดง อิเล็กตรอนจะมีพลังงานน้อยกว่าเมื่อดูด พลังงานจากด้านสีม่วง การที่อิเล็กตรอนมีพลังงานมากขึ้น มีผลให้เคลื่อนที่ออกไปโคจรอยู่ห่างจากนิวเคลียสมากขึ้น ยิ่งมีพลังงานมากเท่าไรก็จะยิ่งออกไปอยู่ห่างจากนิวเคลียสได้มากขึ้นเท่านั้น ฉะนั้นการดูดพลังงานจากบริเวณสีม่วง
จึงมีผลให้อิเล็กตรอนเคลื่อนที่ออกห่างจากนิวเคลียสไปได้ไกลกว่าการดูดพลังงานจากบริเวณสีแดง
ธรรมชาติของสิ่งต่าง ๆ
ถ้ามีพลังงานสูงจะไม่เสถียร (unstable)
หรือไม่อยู่ตัวหรือจะอยู่อย่างนั้นนานๆ
ไม่ได้
ต้องคายพลังงานออกมาเสียบ้างเพื่อให้มีพลังงานต่ำจึงจะเกิดความเสถียร (stable) อิเล็กตรอนก็เช่นเดียวกันเมื่อมีพลังงานสูงจะทำให้ไม่เสถียร
(unstable) จึงต้องปรับตัวให้มีพลังงานต่ำลงด้วยการคายพลังงานออกมา ถ้าคายพลังงานออกมาทั้งหมดเท่าที่ดูดไป อิเล็กตรอนก็จะ เคลื่อนที่จากตำแหน่ง excited
state กลับมายังตำแหน่ง
ground state ตามเดิม พลังงานส่วนที่คายออกมานี้จะอยู่ในรูปของคลื่นแม่เหล็กไฟฟ้าหรือ photon จึงทำให้เกิดเส้นสเปกตรัมชนิดเปล่ง แสง ซึ่งมีสีและตำแหน่งเดียวกับเส้นสเปกตรัมชนิดดูดกลืน ดังรูป
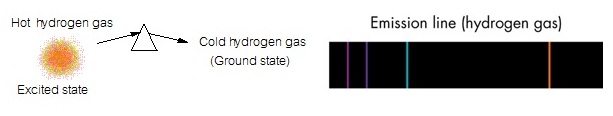
การดูดและคายพลังงานของอิเล็กตรอนดังกล่าวมานี้
เกิดขึ้นอย่างต่อเนื่องตลอดเวลาไม่ใช่เกิดขึ้นเพียงเที่ยวเดียว เราจึงเห็นเส้นสเปกตรัมอยู่ตลอดเวลาเช่นกัน แต่การที่อะตอมของไฮโดรเจน ซึ่งมี อิเล็กตรอนเพียง 1 ตัว แต่พบว่าเกิดเส้นสเปกตรัมที่มองเห็นได้จำนวน 4 เส้น ซึ่งมีสีและตำแหน่งคงที่ แสดงว่าระยะห่างระหว่างตำแหน่ง ground state กับ
excited strat มีอยู่หลายช่วง แต่ละ ช่วงมีระยะห่างคงที่ โบห์รจึงใช้ผลการทดลองนี้เสนอแบบจำลองอะตอมขึ้นมาใหม่ กล่าวว่าอะตอมมีนิวเคลียสซึ่งประกอบด้วยโปรตอน มีอิเล็กตรอนโคจรอยู่รอบ ๆ นิวเคลียส
แบ่งออกเป็น ระดับ พลังงานหลายระดับซ้อนกันเป็นชั้น ๆ อิเล็กตรอนที่มีพลังงานต่ำจะอยู่ใกล้นิวเคลียส อิเล็กตรอนที่มีพลังงานสูงขึ้นจะโคจรอยู่ในชั้นหรือระดับพลังงานที่ห่างออกไป
คล้ายดาวเคราะห์โคจรรอบ ดวง อาทิตย์ ต่อมาจึงเรียกว่า planetary
model ดังรูป
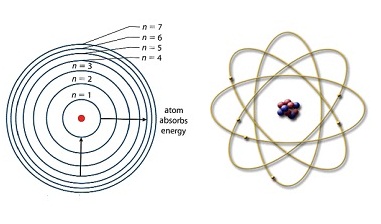
ระยะห่างระหว่างระดับพลังงานจะห่างไม่เท่ากัน ช่วงที่มีระดับพลังงานต่ำจะห่างกันมากกว่าช่วงที่มีระดับพลังงานสูง หมายความว่าระดับพลังงานที่อยู่ใกล้นิวเคลียส จะมีช่วงห่างมากกว่าระดับ พลังงานที่อยู่ไกลออกไป สังเกตภาพแสดงเส้นสเปกตรัมของไฮโดรเจน
จะเห็นได้ว่าทางด้านสีแดงจะมีระยะห่างกันมากกว่าด้านสีม่วง ดังรูป
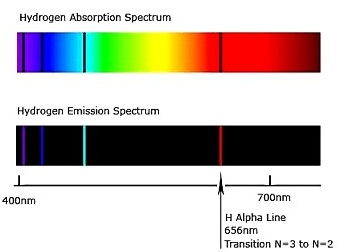
มีการศึกษาเพิ่มอีกมากมายทำให้ทราบต่อมาว่า จำนวนระดับพลังงานของอิเล็กตรอนที่มีอยู่ในปัจจุบันนี้มี 7
ระดับ การเกิดเส้นสเปกตรัม 4 เส้นของไฮโดรเจน ซึ่งเป็นเส้นสเปกตรัมที่มองเห็น เกิดจากการเปลี่ยนระดับพลังงานของอิเล็กตรอน ระหว่างระดับพลังงาน n=2 ถึง n=6 ซึ่งมี
2 ชนิด ได้แก่
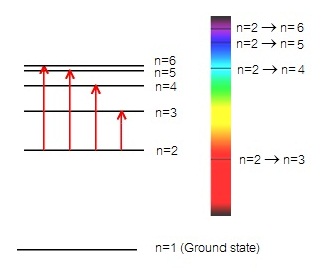
1. เส้นสเปกตรัมชนิดดูดกลืน (absorption line spectrum) เกิดจากอิเล็กตรอนซึ่งอยู่ที่ระดับพลังงาน
n=2 ดูดพลังงานจำนวนหนึ่ง ทำให้เลื่อนขึ้นไปอยู่ที่ระดับพลังงาน n=3 หรือ n=4 หรือ n=5 หรือ
n=6 ดังนี้
n=2 →
n=3 ดูดพลังงานน้อยที่สุด เกิดเส้นสเปกตรัมชนิดดูดกลืน บริเวณสีแดงของสเปกตรัมต่อเนื่อง
n=2 → n=4 ดูดพลังงานมากขึ้น เกิดเส้นสเปกตรัมชนิดดูดกลืน บริเวณสีเขียวของสเปกตรัมต่อเนื่อง
n=2 → n=5 ดูดพลังงานมากขึ้น เกิดเส้นสเปกตรัมชนิดดูดกลืน บริเวณสีน้ำทะเลของสเปกตรัมต่อเนื่อง
n=2 → n=6 ดูดพลังงานมากขึ้น เกิดเส้นสเปกตรัมชนิดดูดกลืน บริเวณสีม่วงของสเปกตรัมต่อเนื่อง
ดังรูป
2.
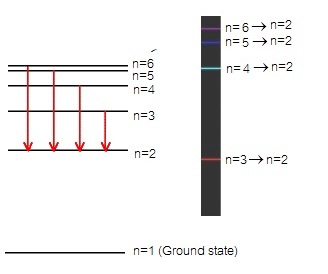
เส้นสเปกตรัมชนิดเปล่งแสง (emision line
spectrum) เกิดจากอิเล็กตรอนซึ่งอยู่ที่ระดับพลังงาน
n=3 หรือ n=4 หรือ
n=5 หรือ n=6 คายพลังงานจำนวนหนึ่ง
ทำให้เลื่อนลงมาอยู่ที่ระดับพลังงาน
n=2 ดังนี้
n = 6 → n = 2
จะเกิดเส้นสเปกตรัมชนิดเปล่งแสง เส้นสีม่วง
n = 5 → n = 2
จะเกิดเส้นสเปกตรัมชนิดเปล่งแสง เส้นสีน้ำทะเล
n = 4 → n = 2
จะเกิดเส้นสเปกตรัมชนิดเปล่งแสง เส้นสีเขียว
n = 3 → n = 2
จะเกิดเส้นสเปกตรัมชนิดเปล่งแสง เส้นสีแดง
ดังรูป
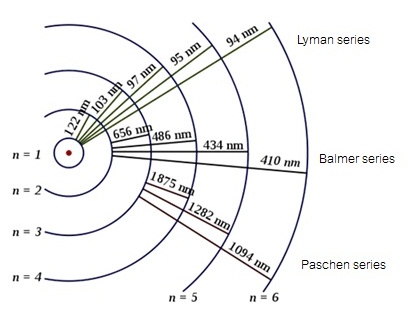
นอกจากเส้นสเปกตรัมที่มองเห็นจำนวน 4
เส้น (Balmer series) ดังกล่าวมานี้
ยังมีเส้นเส้นสเปกตรัมอีกมากมายแต่มองไม่เห็น ได้แก่
Laman series
สเปกตรัมจะอยู่ในช่วง
UV , Paschen series สเปกตรัมจะอยู่ในช่วง IR ดังรูป
แบบฝึกหัด
1. Why could Bohr’s
model be called a planetary model of the atom?
(เหตุใดจึงเรียกแบบจำลองอะตอมของโบห์รว่า
planetary
model )
2. How do electrons in the
same atom differ?
(อิเล็กตรอนของอะตอมเดียวกันมีความแตกต่างกันในเรื่องใด)
3. Would an electron have to
absorb or release energy to jump from the second energy level to the
third energy level?
(การที่อิเล็กตรอนเปลี่ยนที่อยู่จากระดับพลังงานที่ 2
ไปอยู่ระดับพลังงานที่ 3
จะมีการดูดพลังงานหรือ
คายพลังงาน) ...................................................................
4. For an electron to
fall from the third energy level to the second energy level, it must
( เมื่ออิเล็กตรอนเลื่อนจากระดับพลังงานที่ 3
มาอยู่ที่ระดับพลังงานที่ 2
จะมีการ ) ……………
energy. (พลังงาน)
รูปภาพที่เกี่ยวข้อง

Size : 51.82 KBs
Upload : 2014-03-16 05:04:01
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|