ตารางธาตุ ตอนที่ 2
อิเล็กโตรเนกาติวิตี (Electronegativity ,
EN )
คือความสามารถในการดึงดูดอิเล็กตรอนของอะตอม สมบัตินี้ขึ้นอยู่กับขนาดของอะตอมและจำนวนโปรตอนในนิวเคลียสของธาตุนั้น
ๆ อะตอมที่มีขนาดเล็กหรือมีโปรตอนอยู่ในนิวเคลียสมากจะมีค่าอิเล็กโตรเนกาติวิตีสูง ถ้าพิจารณาตำแหน่งของธาตุในตารางธาตุ จะมีแนวโน้มในการเพิ่มขึ้นหรือลดลงเช่นเดียวกับพลังงานไอออไนเซชันอันดับ
1 หรือ IE1
ค่าอิเล็กโตรเนกาติวิตีกำหนดขึ้นโดยพอลิง (Pauling) ในปี ค.ศ.
1932 (พ.ศ. 2475 ตรงกับสมัยรัชกาลที่ 7 ของไทย)
กำหนดให้อิเล็กโตรเนกาติวิตีของธาตุฟลูออรีนมีค่าสูงสุดคือ เท่ากับ 3.98
(ประมาณ 4.00)
ส่วนธาตุที่มีค่าอิเล็กโตรเนกาติวิตี น้อยที่สุดคือ แฟรนเซียมซึ่งมีค่าเท่ากับ
0.7 ธาตุที่เหลือจะมีค่า อิเล็กโตรเนกาติวิตีระหว่าง 0.7 ถึง 3.98 ใช้เครื่องหมาย “δ EN” แทนความแตกต่างของ
อิเล็กโตรเนกาติวิตี ระหว่างอะตอมของธาตุต่างชนิดกัน 2 อะตอมที่มาสร้างพันธะกันหรือรวมตัวกันเป็นสารประกอบ ผลต่างของค่า EN จะมีผลต่อขั้วไฟฟ้าของโมเลกุลที่เกิดขึ้น ซึ่งจะได้ศึกษาในตอนต่อไป ในขณะนั้นยังไม่สามารถทำให้ก๊าซมีตระกูลเกิดสารประกอบขึ้นมาได้ จึงไม่ได้หาค่า EN ของก๊าซมีตระกูลเอาไว้ (คลิ้ก อ่านประวัติพอลิง)
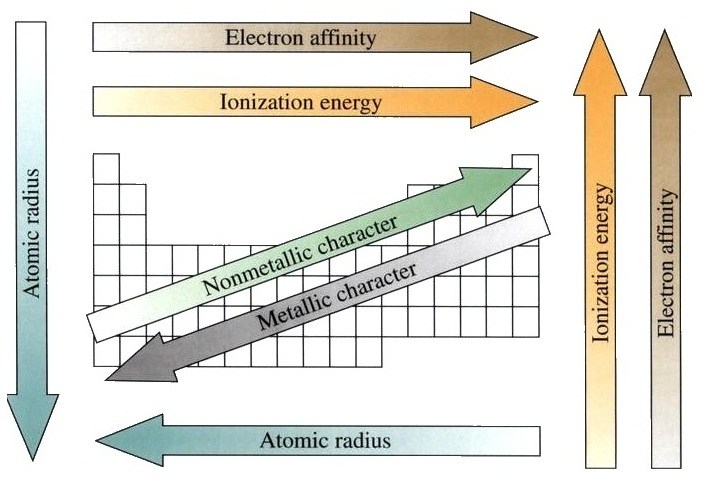
ธาตุใดมีค่าอิเล็กโตรเนกาติวิตีมากก็หมายความว่ามีแรงดึงดูดอิเล็กตรอนเอาไว้อย่างแข็งแรงมาก ฉะนั้นการที่จะทำให้อิเล็กตรอนหลุดออกไปจึงต้องใช้พลังงานงานมาก ธาตุคาบเดียวกันธาตุขวามีค่าอิเล็กโตรเนกาติวิตีมากกว่าธาตุซ้าย
ธาตุหมู่เดียวกันธาตุคาบบนมีค่าอิเล็กโตรเนกาติวิตีมากกว่าธาตุคาบล่าง ดังรูป
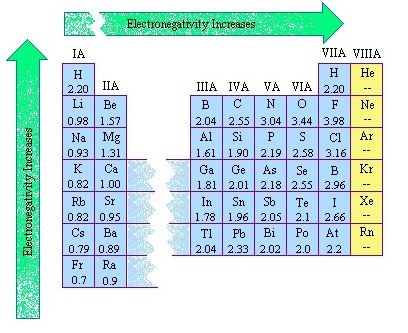
(คลิ้กชมตารางธาตุแสดงค่า EN)
สัมพรรคภาพอิเล็กตรอน
(electron
affinity , EA)
คือ
พลังงานที่อะตอมในสถานะแก๊สคายออกมาเมื่อได้รับอิเล็กตรอน หรือเพื่อการรับอิเล็กตรอนเข้าไปในอะตอม ดังสมการ
A
( g ) + e- → A-
( g ) + พลังงาน
(คลิ้ก
ชมสัมพรรคภาพอิเล็กตรอน)
ค่า EA เป็นค่าพลังงานที่ใช้แสดงความสามารถหรือความว่องไวในการรับอิเล็กตรอนของแต่ละธาตุ ธาตุใดมีค่า EA
สูงหมายความว่ามีความสามารถในการรับอิเล็กตรอนได้ดีกว่าธาตุที่มีค่า
EA ต่ำ เช่น
F (g) +
e- → F-
( g ) ; EA =
333 kJ/mol
O (g)
+ e- → O-(g) ;
EA = 142 kJ/mol
P (g) + e- → P -( g ) ; EA = 74
kJ/mol
จากตัวอย่างแสดงว่า อะตอมของ F
มีแนวโน้มที่จะรับอิเล็กตรอนได้ง่ายกว่า O และ P ตามลำดับ เนื่องจากค่า Ea
เป็นพลังงานที่อะตอมคายออกไป
จึงกำหนดให้ใช้เครื่องหมายเป็นลบ
ธาตุที่อยู่ในหมู่เดียวกันธาตุคาบบนจะมีค่า EA สูงกว่าธาตุคาบล่าง
ส่วนธาตุในคาบเดียวกันธาตุขวาก็จะมีค่า EA สูงกว่าธาตุซ้าย ดังรูป
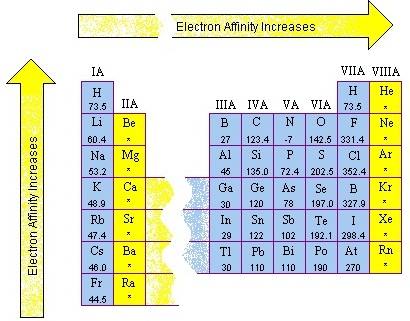
(คลิ้ก ชมค่า AE ตามหมู่และคาบ )
แต่อย่างไรก็ตามมีธาตุบางธาตุที่ค่า EA ไม่เป็นไปตามแนวโน้มของตำแหน่งในตารางธาตุ เช่นธาตุในหมู่ที่ VIIA ธาตุ F อยู่เหนือ
Cl ฉะนั้น F ควรมีค่า EA
สูงกว่า Cl แต่กลับพบว่า Cl มีค่า EA สูงกว่า F
เป็นเพราะการจัดอิเล็กตรอนของ F กับ Cl เปรียบเทียบกันดังนี้
การรับอิเล็กตรอนของ F
จะบรรจุลงในออร์บิทัล 2p
แต่การรับอิเล็กตรอนของ Cl จะบรรจุลงในออร์บิทัล 3p
ถ้าพิจารณาระยะห่างระหว่างออร์บิทัลกับนิวเคลียสแล้ว ออร์บิทัล 2p
อยู่ใกล้นิวเคลียสมากกว่า 3p จึงมีพื้นที่น้อย
ทำให้อิเล็กตรอนที่มีอยู่เดิมอยู่ใกล้กันจึงมีแรงผลักซึ่งกันและกันมาก และจะผลักอิเล็กตรอนตัวที่รับเพิ่มด้วย จึงทำให้รับอิเล็กตรอนยากกว่า Cl เนื่องจากระดับ 3p อยู่ห่างจากนิวเคลียสมากกว่า ทำให้มีที่ว่างมากกว่า อิเล็กตรอนจึงอยู่ห่างกัน แรงผลักจึงมีน้อย การรับอิเล็กตรอนเพิ่มจึงเป็นไปได้ง่ายกว่า
ถ้าเปรียบเทียบระหว่างโลหะกับอโลหะจะเห็นได้ว่า
โลหะมีค่า EA ต่ำ ในขณะที่อโลหะมักมีค่า
EA สูง
แสดงว่าโดยทั่วไปแล้วโลหะจะรับอิเล็กตรอนได้ยากหรือช้ากว่าอโลหะ ซึ่งตรงกันข้ามกับค่า IE1
ที่โลหะส่วนใหญ่จะมีค่า IE1 ต่ำ ในขณะที่อโลหะมีค่า IE1 สูง
แสดงว่าโลหะเสียอิเล็กตรอนง่ายกว่าอโลหะแต่รับอิเล็กตรอนยากกว่า ในขณะที่อโลหะเสียอิเล็กตรอนยากแต่รับอิเล็กตรอนง่าย
หมายเหตุ พลังงานอิเล็กตรอนอัฟฟินิตี (EA) เป็นพลังงานที่อะตอมคายออกไป ทำให้อะตอมเหลือพลังงานน้อยลง กำหนดให้ใช้เครื่องหมายเป็นลบ (แต่ไม่ได้หมายความว่ามีค่าน้อยกว่าศูนย์)
ค่า IE1 EN และ EA ของธาตุต่าง ๆ
กับตำแหน่งของธาตุในตารางธาตุ
มีแนวโน้มของการเพิ่มขึ้นหรือลดลงไปในทางเดียวกัน คือถ้าพิจารณาตามคาบธาตุขวาจะมีค่า IE EA และ EN มากกว่าซ้าย
ถ้าพิจารณาตามหมู่ธาตุคาบบนจะมีค่า IE1 EN และ EA มากกว่าธาตุคาบล่าง
(คลิ้ก ชมแนวโน้มของ IE1 EN และ EA เป็นไปในทางเดียวกัน
)
แนวโน้มความเป็นโลหะของธาตุ (Trends of the metal elements)
การจัดเรียงธาตุในตารางธาตุ ทำให้เราทราบถึงแนวโน้มของความเป็นโลหะของธาตุได้ด้วย
เราจำแนกธาตุจากความเป็นโลหะหรืออโลหะได้ 3
กลุ่ม ดังนี้
1. ธาตุโลหะ (Metal Elements)
เป็นธาตุที่ตัวนำไฟฟ้า
และความร้อนได้ดี ผิวของโลหะที่ขัดเรียบจะมีลักษณะเป็นมันวาว จุดเดือดและจุดหลอมเหลวสูง ส่วนใหญ่มีสถานะเป็นของแข็ง (ยกเว้นปรอทซึ่งสถานะเป็นของเหลว) เมื่อเคาะจะเกิดเสียงดังกังวาน มีความแข็งและเหนียวสามารถทำให้เปลี่ยนรูปร่างได้ จึงมักถูกใช้ในงานโครงสร้างอย่างกว้างขวาง
ธาตุที่มีในทางเคมีธาตุที่เป็นโลหะมากจะเสียอิเล็กตรอนแก่ธาตุอื่นๆ
ได้ง่าย (IE1 ต่ำ) เช่น ลิเทียม (Li), โซเดียม (Na), โพแทสเซียม (K), แมกนิเซียม (Mg), แคลเซียม (Ca) เป็นต้น
ธาตุโลหะมี 2 กลุ่ม คือโลหะธรรมดา
ได้แก่ธาตุหมู่ 1A
2A และธาตุคาบล่าง
ๆ ของหมู่ 3A
4A 5A อีกกลุ่มหนึ่งคือโลหะแทรนซิชัน ได้แก่ธาตุหมู่ B ทั้งหมด
2.
ธาตุอโลหะ (Non-metal Elements)
เป็นธาตุที่อาจพบได้ทั้งสามสถานะ คือ ของแข็ง ของเหลว และแก๊ส ธาตุอโลหะจะมีสมบัติส่วนใหญ่ตรงข้ามกับธาตุโลหะ เช่น ผิวไม่มันวาว ไม่นำไฟฟ้าและความร้อน มีจุดเดือดและจุดหลอมเหลวต่ำ เป็นต้น ในทางเคมีธาตุที่เป็นอโลหะมากจะรับอิเล็กตรอนได้ง่าย
(
EN สูง) ส่วนใหญ่จะเป็นธาตุที่จัดอยู่บริเวณด้านขวามือของตารางธาตุ เช่น คาร์บอน (C), ฟอสฟอรัส (P), กำมะถัน (S), โบรมีน(Br), ออกซิเจน (O), ไนโตรเจน (N), คลอรีน (Cl), ฟลูออกรีน (F) เป็นต้น
* ความเป็นโลหะหรืออโลหะจะมีอยู่ทั้ง 2
อย่างในธาตุเดียวกัน
เมื่อแสดงสมบัติด้านใดได้ชัดเจนกว่าก็จะจัดประเภทไปตามสมบัติที่แสดง เมื่อพิจารณาตำแหน่งของธาตุในตารางธาตุ ธาตุหมู่เดียวกันธาตุคาบบนเป็นอโลหะมากกว่าธาตุคาบล่าง ธาตุคาบเดียวกันธาตุขวาเป็นอโลหะมากกว่าธาตุซ้าย ดังรูป
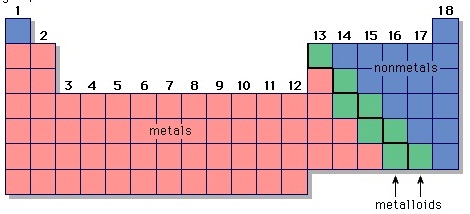
3. ธาตุกึ่งโลหะ (Semi-metal Element หรือ metaloid)
ธาตุกึ่งโลหะเป็นธาตุที่มีสมบัติอยู่กึ่งกลางระหว่างโลหะกับอโลหะ ส่วนใหญ่จะมีสมบัติเป็นสารกึ่งตัวนำ
(semiconductors) คือจะนำไฟฟ้าได้ดีขึ้นเมื่ออุณหภูมิสูงขึ้น (ต่างจากโลหะที่จะนำไฟฟ้าได้น้อยลงเมื่ออุณหภูมิสูง) ธาตุที่มีสมบัติเป็นธาตุกึ่งโลหะจะจัดเอาไว้บริเวณแนวเส้นบันไดในตารางธาตุ หรือเส้นแบ่งความเป็นโลหะกับอโลหะ ธาตุที่อยู่ติดกับเส้นดังกล่าวนี้เป็นธาตุกึ่งโลหะ ยกเว้น
Al และ Po ธาตุกึ่งโลหะจึงมีทั้งหมด
6 ธาตุ (บางแห่งว่ามี 8 ธาตุ) ได้แก่ โบรอน (B) , ซิลิกอน (Si) , เจอร์มาเนียม (Ge) , สารหนู (As) , อัลติโมนี
(Sb)
, เทลลูเรียม (Te) ดังรูป
(คลิ้ก
ชมแนวโน้มของขนาดอะตอม พลังงานไอออไนเซชัน
อิเล็กตรอนอัฟฟินิตีและความเป็นโลหะ)
จุดหลอมเหลวและจุดเดือด
(melting
point and boiling point)
จุดหลอมเหลวและจุดเดือดของธาตุจะสูงหรือต่ำ ขึ้นอยู่กับแรงที่ยึดเหนี่ยวระหว่างอนุภาค (โมเลกุลหรืออะตอมหรือไอออน) ที่เป็นองค์ประกอบของสารนั้น ๆ ว่ามีน้อยหรือมาก สารใดมีแรงยึดเหนี่ยวระหว่างอนุภาคอยู่มาก สารนั้นก็จะต้องใช้ความร้อนมากจึงจะแยกอนุภาคออกจากกันได้ จึงมีจุดหลอมเหลวและจุดเดือดสูง ในโลหะต่าง ๆ อะตอมของโลหะจะยึดเหนี่ยวกันด้วยแรงที่เรียกว่าพันธะโลหะซึ่งมีความแข็งแรงมาก การทำให้โลหะหลอมเหลวเป็นการใช้พลังงานความร้อนไปทำลายพันธะโลหะ
เนื่องจากพันธะโลหะจะมีความแข็งแรงมาก จึงต้องใช้ความร้อนมาก
จุดหลอมเหลวและจุดเดือดของโลหะจึงสูง
แต่เมื่อเปรียบเทียบระหว่างโลหะต่าง ๆ
จำพบว่ามีจุดหลอมเหลวและจุดเดือดไม่เท่ากัน
แสดงว่าพันธะโลหะของโลหะต่าง ๆ มีความแข็งแรงไม่เท่ากัน
สำหรับอโลหะจะมีแรงยึดเหนี่ยงระหว่างอนุภาคเป็นแรงวันเดอร์วาลส์ซึ่งมีค่าน้อย (แต่เพิ่มขึ้นตามมวลโมเลกุล) และแรงชนิดอื่น เช่น แรงระหว่างขั้วซึ่งก็มีค่าน้อยกว่าพันธะโลหะ ฉะนั้นโดยรวม ๆ
แล้วกล่าวได้ว่าโลหะส่วนใหญ่มีจุดหลอมเหลวและจุดเดือดสูงกว่าอโลหะ (มีข้อยกเว้นด้วยเหตุผลเฉพาะอยู่บ้าง)
เมื่อพิจารณาแนวโน้มว่าจุดหลอมเหลวและจุดเดือด มีความสัมพันธ์กับตำแหน่งของธาตุในตารางธาตุอย่างไร ต้องแยกเป็นส่วน ๆ ดังนี้
1. ธาตุคาบเดียวกัน
1.1 เฉพาะธาตุหมู่
1A และ 2A
ธาตุขวามีจุดหลอมเหลวสูงกว่าธาตุซ้าย (แต่ธาตุซ้ายเป็น
โลหะ
มากกว่าธาตุขวา)
1.2 เฉพาะหมู่
3A ถึง 8A
มีแนวโน้มว่าธาตุขวามีจุดหลอมเหลวต่ำกว่าธาตุซ้าย (บางช่วงเป็น
อย่างอื่น)
1.3 เฉพาะธาตุหมู่
B แนวโน้มไม่แน่นอน
2. ธาตุหมู่เดียวกัน
2.1 ธาตุหมู่ 1A
2A ธาตุคาบล่างมีจุดหลอมเหลวต่ำกว่าธาตุคาบบน
(ธาตุล่างเป็นโลหะ
มากกว่า
ธาตุบน)
2.2 ธาตุหมู่ 7A 8A ธาตุคาบล่างมีจุดหลอมเหลวสูงกว่าธาตุคาบบน
(ธาตุบนเป็นอโลหะ
มากกว่า
ธาตุล่าง)
2.3 ธาตุหมู่
3A 4A 5A
6A แนวโน้มไม่แน่นอน เพราะอยู่ในช่วงแนวแบ่งเขตโลหะ-อโลหะ
ธาตุหมู่เดียวกันจึงมีทั้งอโลหะ กึ่งโลหะและโลหะ
2.4 ธาตุหมู่
B ธาตุล่างมีจุดหลอมเหลวสูงกว่าธาตุบน (ยกเว้นบางช่วง)
อนึ่ง อย่าลืมว่าจุดหลอมเหลว (melting point ,
M.P.) กับจุดเยือกแข็ง (freezing point , F.P.) ของสารใด ๆ จะเป็นอุณหภูมิเดียวกัน
เช่น เหล็ก มีจุดหลอมเหลว
1,530 oC จุดเยือกแข็งของ เหล็กก็คือ 1,530 oC เช่นกัน
ณ จุดหลอมเหลวของสารใด ๆ สารดังกล่าวเป็นได้ทั้ง 2 สถานะพร้อมกัน (กลับไปทบทวนแผนผังวัฏภาค) จุดหลอมเหลวของธาตุต่าง ๆ เป็นดังนี้
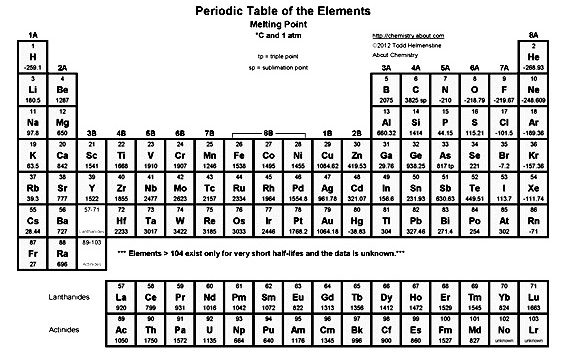
สมบัติต่าง ๆ ของธาตุตามหมู่และคาบ แสดงโดยสรุปดังนี้
ตำแหน่งของธาตุไฮโดรเจนในตารางธาตุ
การจัดธาตุให้อยู่ในหมู่ใดของตารางธาตุจะใช้สมบัติที่คล้ายกันเป็นเกณฑ์
ตารางธาตุปัจจุบันได้จัดให้ธาตุไฮโดรเจนให้อยู่ในคาบที่
1 ระหว่างหมู่ IA กับหมู่ VIIA เพราะไฮโดรเจนมีสมบัติบาง อย่างคล้ายธาตุหมู่ 1A ขณะเดียวกันสมบัติบางอย่างคล้ายธาตุ
หมู่ VIIA แต่ตารางธาตุแบบเดิมที่ให้ธาตุไฮโดรเจนอยู่หมู่ 1A ก็ยังใช้ได้อยู่
ตารางสมบัติบางประการของธาตุไฮโดรเจนเปรียบเทียบกับกับธาตุหมู่ 1A และ 7A
|
สมบัติ
|
ธาตุหมู่ 1
|
ธาตุไฮโดรเจน
|
ธาตุหมู่ 7
|
|
1. จำนวนเวเลนต์อิเล็กตรอน
|
1
|
1
|
7
|
|
2. เลขออกซิเดซันในสารประกอบ
|
+1
|
+1 และ -1
|
+1 +3 +5 +7 –1
|
|
3. ค่า IE
(kJ/mol)
|
382-526
|
1318
|
1015 – 1687
|
|
4. อิเล็กโตรเนการทีวิตี
|
1.0-0.7
|
2.1
|
4.0-2.2
|
|
5. สถานะ
|
ของเเข็ง
|
แก๊ส
|
แก๊ส
/ของเหลว/ของแข็ง
|
|
6. การนำฟ้า
|
นำ
|
ไม่นำ
|
ไม่นำ
|
|
7. พันธะในสารประกอบ
|
ไอออนิก
|
ไอออนิก/โคเวเลนต์
|
ไอออนิก/โคเวเลนต์
|
|
8.
สูตรโมเลกุลเมื่อเป็นธาตุบริสุทธิ์
|
-
|
H2
|
F2 Cl2 Br2 I2
|
จากข้อมูลในตาราง ไฮโดรเจนมีเวเลนซ์อิเล็กตรอน = 1 และมีเลขออกซิเดชัน +1 สมบัติส่วนนี้คล้ายธาตุหมู่ 1A จึงควรอยู่ในหมู่ IA คาบที่
1 แต่ขณะเดียวกันไฮโดรเจนมีสมบัติคล้ายธาตุหมู่ VIIA หลายประการคือ มีเลขออกซิเดชัน
-1 มีพลังงานไอออไนเซชันลำดับที่ 1 และอิเล็กโตรเนกาติวิตีสูง
มีสถานะเป็นแก๊ส ไม่นำไฟฟ้า มีสูตรโมเลกุลลักษณะเดียวกัน จึงจัดไฮโดรเจนไว้ในตำแหน่งพิเศษ ระหว่างหมู่ IA กับ VIIA
ดังปรากฏในตารางธาตุ
แบบใหม่ ดังรูป

(ติดตามตอนที่ 3 ทำแบบฝึกหัด)
รูปภาพที่เกี่ยวข้อง

Size : 260.42 KBs
Upload : 2014-08-09 05:30:55
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|