ของแข็ง ของเหลว แก๊ส (ตอนที่ 7 ) กฎรวมของแก๊ส
กฎรวมแก๊ส (Combined gas law)
เป็นการนำกฎของบอยล์และกฎของชาร์ลมารวมกัน มีผลให้หาปริมาตรของแก๊สที่มีจำนวนโมล (หรือมวล) คงที่ แต่มีการเปลี่ยนแปลงทั้งอุณหภูมิและความดันพร้อมกัน
*บอยล์ ; n,T คงที่ V แปรผกผันกับ P
*ชาร์ล n , P คงที่ V แปรผันตรงกับ T เคลวิน
*กฎรวมแก๊ส n คงที่ V จะเป็นอย่างไรเมื่อ P และ T เปลี่ยนแปลงพร้อมกัน
จากการทดลองทำให้ทราบว่าเมื่อให้จำนวนโมล (n) ของแก๊สคงที่ จากนั้นทำให้ P และ T เปลี่ยนแปลงไปพร้อม ๆ กัน ปริมาตรของแก๊สก็จะเปลี่ยนแปลงไปค่าหนึ่ง แต่พบว่าอัตราส่วนระหว่าง PV : T หรือ
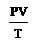
เป็นค่าคงที่ เมื่อทดลองหลาย ๆ ครั้ง เขียนแสดงได้ดังนี้
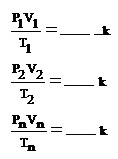
สมการที่ใช้ในการคิดคำนวณด้วยกฎรวมของแก๊สคือ
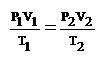
* P1 กับ P2 ต้องเป็นหน่วยเดียวกัน
* V1 กับ V2 ต้องเป็นหน่วยเดียวกัน
*T1 กับ T2 ต้องเป็นเคลวินเสมอ
(คลิ้ก ชมการอธิบายกฎรวมของแก๊ส)
ตัวอย่าง ใช้ Mg จำนวน 1.00 โมล ทำปฏิกิริยากับสารละลายกรด HCl ซึ่งมากเกินพอ เกิดปฏิกิริยาดังสมการ
Mg(s) + 2HCl(aq) → MgCl2(aq) + H2(g)
- ถ้าทดลองที่ภาวะ STP จะได้ H2 กี่ dm3
- ถ้าทดลองที่อุณหภูมิ 27 oC ความดัน 0.80 atm จะได้ H2 กี่ dm3
วิธีทำ จากสมการ ; จำนวนโมลของ H2 ที่ได้ = จำนวนโมลของ Mg ที่ใช้
= 1.00 โมล
- ถ้าทดลองที่ภาวะ STP จะได้ H2 1.00 x 22.4 = 22.4 dm3 ตอบ
- ถ้าทดลองที่อุณหภูมิ 27 oC ความดัน 0.80 atm จะได้ H2 กี่ dm3 ต้องคิดด้วยกฎรวมของแก๊ส โดยเปรียบเทียบกับภาวะ STP
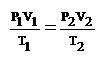

แบบฝึกหัด
1. A high altitude balloon is filled with 1.41 x 104 L of helium at 21oC and 745 torr. What is the volume
(L) of the balloon at 20 Km where the temperature is -48oC and 63.1 torr? (ans.b) (บัลลูนตรวจ
อากาศระดับสูง มีปริมาตร 1.41 x 104 L บรรจุด้วยแก๊ส helium ที่อุณหภูมิ 21oC ความดัน 745 torr เมื่อ
ลอยขึ้นไปสูง 20 กิโลเมตร ซึ่งมีอุณหภูมิ -48oC ความดัน 63.1 torr บัลลูนจะมีปริมาตรกี่ลิตร)
a) 1.58 x 105 b) 1.27 x 105 c) 2.18 x 105 d) 1.89 x 105 e) 1.10 x 105
2. A 2.00 L sample of air at -50oC has a pressure of 700 torr. What will be the new pressure (torr) if
the temperature is raised to 50oC and the volume is increased to 4.00 L? (ans.b) (อากาศ 2.00 ลิตร
ที่อุณหภูมิ -50oC มีความดัน 700 torr ถ้าเพิ่มอุณหภูมิเป็น 50 oC และเพิ่มปริมาตรเป็ร 4.00 ลิตร จะมี
ความดันกี่ torr)
a) 552 b) 507 c) 410 d) 440 e) 485
3. At STP a gas has a volume of 5.00 L. What volume (L) will the gas occupy at 80oC and 800 torr?
(ans.b) (ที่ STP แก๊สจำนวนหนึ่งมีปริมาตร 5.00 L ถ้าเปลี่ยนอุณหภูมิเป็น 80 oC ความดัน 800 torr จะมี
ปริมาตรกี่ลิตร)
a) 5.56 b) 6.14 c) 6.98 d) 6.75 e) 6.37
4. A gas occupies 2.0 L at 127oC and 2.0 atm. At what temperature (oC) will the gas occupy 3.0 L at
1.0 atm? (ans.c) (แก๊สจำนวนหนึ่งมีปริมาตร 2.00 ลิตร ที่อุณหภูมิ 127 oC ความดัน 2.0 atm ถ้าต้องการ
ให้มีปริมาตร 3.0 ลิตร ความดัน 1.00 atm จะต้องใช้อุณหภูมิกี่ oC)
a) -7.0 b) -16.3 c) 27 d) 97 e) 63
5. Gas evolved in the fermentation of sugar in wine making occupies a volume of 0.75 L at 20oC at
720 mm Hg. What volume (L) would the gas occupy at 39oC and 1.00 atm? (ans.c) (แก๊สที่ได้จาก
การหมักน้ำตาลในการผลิตไวน์ มีปริมาตร 0.75 ลิตร ที่อุณหภูมิ 20 oC ความดัน 720 mmHg ถ้าอยู่ที่
อุณหภูมิ 39 oC ความดัน 1.00 atm จะมีปริมาตรกี่ลิตร)
a) 0.85 b) 0.73 c) 0.76 d) 0.67 e) 0.80
รูปภาพที่เกี่ยวข้อง

Size : 3.06 KBs
Upload : 2014-02-13 21:06:46
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|