อัตราเร็วของปฏิกิริยา ตอนที่ 2 พลังงานกับการดำเนินไปของปฏิกิริยา
อัตราเร็วของการเกิดปฏิกิริยาเคมี (Rate of chemical reaction , R,r)
ตอนที่ 2 พลังงานกับการดำเนินไปของปฏิกิริยา
การเกิดปฏิกิริยาเคมีต่าง ๆ
ต้องเกี่ยวข้องกับพลังงานอยู่เสมอ
จำแนกเป็น 2 ขั้นตอน
ดังนี้
ขั้นที่ 1 ดูดพลังงานเข้าไปเพื่อสลายพันธะในสารตั้งต้น ( ในที่นี้ใช้สัญลักษณ์ H1) กำหนดให้ใช้เครื่องหมายบวก
( + ) แสดงการดูดพลังงาน พลังงานส่วนนี้เรียกว่าพลังงานก่อกัมมันต์ หรือพลังงานกระตุ้น ( Activation energy , Ea) ของปฏิกิริยา โดยแต่ละปฏิกิริยาจะมีค่า Ea เฉพาะตัว และค่า Ea เป็นตัวบ่งชี้ว่าปฏิกิริยาจะเกิดง่ายหรือยาก กล่าวคือปฏิกิริยาที่มีค่า Ea ต่ำจะเป็นปฏิกิริยาที่เกิดได้ง่าย จึงทำให้มีอัตราเร็วของปฏิกิริยาสูง ในทางกลับกันปฏิกิริยาใดมีค่า Ea สูง
ปฏิกิริยานั้นจะเกิดยาก จึงทำให้มีอัตราเร็วของปฏิกิริยาต่ำ
ปัจจัยที่ทำให้ค่า Ea ลดลงได้คือตัวเร่ง (catalyst) เท่านั้น
ปัจจัยอื่นเช่นอุณหภูมิ
ความดัน ความเข้มข้น ไม่ทำให้ค่า Ea ของปฏิกิริยาลดลง
ขั้นที่ 2 คายพลังงานออกมาเมื่อมีการสร้างพันธะในผลิตภัณฑ์ ( ในที่นี้ใช้สัญลักษณ์ H2) กำหนดให้ใช้เครื่องหมายลบ ( - )
แสดงการคายพลังงาน
ผลต่างของพลังงานขั้นที่ 1 กับ 2
เรียกว่าพลังงานของปฏิกิริยา (ΔH) หรือ Enthalpy
ΔH =
H1 + H2
ตัวอย่าง กำหนดพลังงานพันธะ ดังนี้
A-A =
10 kJ/mol B-B = 20 kJ/mol A-B =
30 kJ/mol
จงคำนวณหาพลังงานที่เกี่ยวข้องในปฏิกิริยาต่อไปนี้
A2(g) + B2(g) →
2AB(g)
A-A + B-B → 2(A-B)
10 kJ/mol + 20 kJ/mol → 2(30) kJ/mol
30 kJ/mol 60 kJ/mol
แสดงเครื่องหมาย +30 kJ/mol -60 kJ/mol
ΔH = H1 + H2
= +30 kJ/mol
+ (-60 kJ/mol)
= - 30 kJ/mol
ตอบ.
*** ให้สังเกตที่พลังงาน 3
ค่า คือ
ค่าที่ 1; +30 kJ/mol เป็นพลังงานที่ดูดเข้าไปเพื่อสลายพันธะในสารตั้งต้น พลังงานนี้ก็คือค่า Ea ของปฏิกิริยา
พลังงานนี้จะมากหรือน้อยขึ้นอยู่กับความแข็งแรงของพันธะ ถ้าพันธะแข็งแรงมากพลังงานนี้ก็มาก หรือที่เรียกว่ามีค่า Ea สูง ทำให้ปฏิกิริยาเกิดได้ยาก
ค่าที่ 2; -60
kJ/mol
เป็นพลังงานที่คายออกมาเมื่อสร้างพันธะในผลิตภัณฑ์
ค่าที่
3 ; -30 kJ/mol เป็นพลังงานของปฏิกิริยา หรือ enthalpy
, ΔH
พลังงานของปฏิกิริยามี 2 แบบ
คือ
1.
ปฏิกิริยาดูดความร้อน
( Endothermic reaction) ΔH มีค่าเป็น
+ เกิดจากพลังงานที่ดูดพลังงานเข้าไปเพื่อใช้สลายพันธะในสารตั้งต้นมากกว่าที่คายออกมาเพื่อสร้างพันธะในผลิตภัณฑ์
หรือ H1 > H2 มีผลให้สารผลิตภัณฑ์จะมีพลังงานสูงกว่าสารตั้งต้น ความเสถียรของผลิตภัณฑ์จึงน้อยกว่าสารตั้งต้น ทำให้ผลิตภัณฑ์สามารถสลายตัวกลับมาเป็นสารตั้งต้นได้ง่าย ดังกราฟ
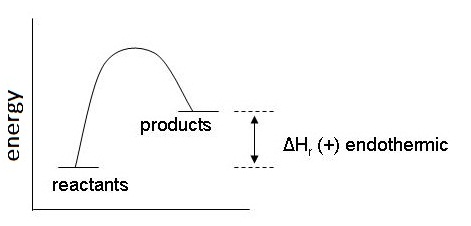
ตัวอย่าง 2HCl(g) →
H2(g) + Cl2(g)
กำหนดพลังงานพันธะดังนี้ H-H
= 430 kJ/mol
Cl-Cl = 240
kJ/mol H-Cl =
430 kJ/mol
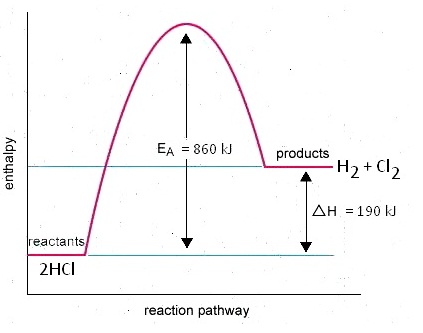
พลังงานที่เกี่ยวข้องกับการเกิดปฏิกิริยาเป็นดังนี้
2(H-Cl) →
H-H + Cl-Cl
2x430 → 430 +
240
860
kJ → 670 kJ
(H1) (H2)
พลังงานของปฏิกิริยา ; ΔH = H1
+ H2
=
+860 + (-670)
= + 190
kJ (เป็นปฏิกิริยาดูดความร้อน)
กราฟแสดงความสัมพันธ์ระหว่างพลังงานกับการดำเนินไปของปฏิกิริยาเป็นดังนี้
2. ปฏิกิริยาคายความร้อน ( Exothermic reaction) มีค่าเป็น
- เกิดจากพลังงานที่ดูดพลังงานเข้าไปเพื่อใช้สลายพันธะในสารตั้งต้นน้อยกว่าที่คายออกมาเพื่อสร้างพันธะในผลิตภัณฑ์
หรือ H1 < H2 มีผลให้สารผลิตภัณฑ์จะมีพลังงานต่ำกว่าสารตั้งต้น ความเสถียรของผลิตภัณฑ์จึงมากกว่าสารตั้งต้น ทำให้ผลิตภัณฑ์สามารถสลายตัวกลับมาเป็นสารตั้งต้นได้ยาก ดังกราฟ
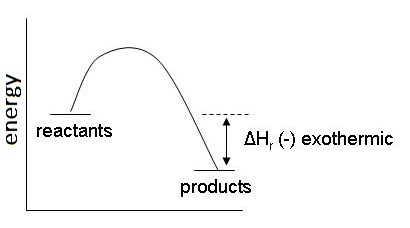
ตัวอย่าง H2(g)
+ Cl2(g) →
2HCl(g)
กำหนดพลังงานพันธะดังนี้ H-H
= 430 kJ/mol
Cl-Cl = 240
kJ/mol H-Cl =
430 kJ/mol
พลังงานที่เกี่ยวข้องกับการเกิดปฏิกิริยาเป็นดังนี้
H-H +
Cl-Cl → 2(H-Cl)
430 + 240 → 2x430
670 kJ → 860
kJ
(H1) (H2)
พลังงานของปฏิกิริยา ; ΔH =
H1 + H2
=
+670 + (-860)
= - 190
kJ (เป็นปฏิกิริยาคายความร้อน)
กราฟแสดงความสัมพันธ์ระหว่างพลังงานกับการเกิดปฏิกิริยาเป็นดังนี้
หมายเหตุ สำหรับปฏิกิริยาที่มีขั้นตอนมากกว่า 1
ขั้นตอน แต่ละขั้นตอนจะมีค่า Ea ไม่เท่ากัน
ขั้นตอนที่มีค่า Ea สูงที่สุด
จะเป็นขั้นตอนที่เกิดยากที่สุดหรือมีอัตราเร็วต่ำสุด ให้ถือว่าเป็นขั้นกำหนดอัตราเร็วของปฏิกิริยานั้น
ๆ ( Rate determining step ) ดังกราฟ
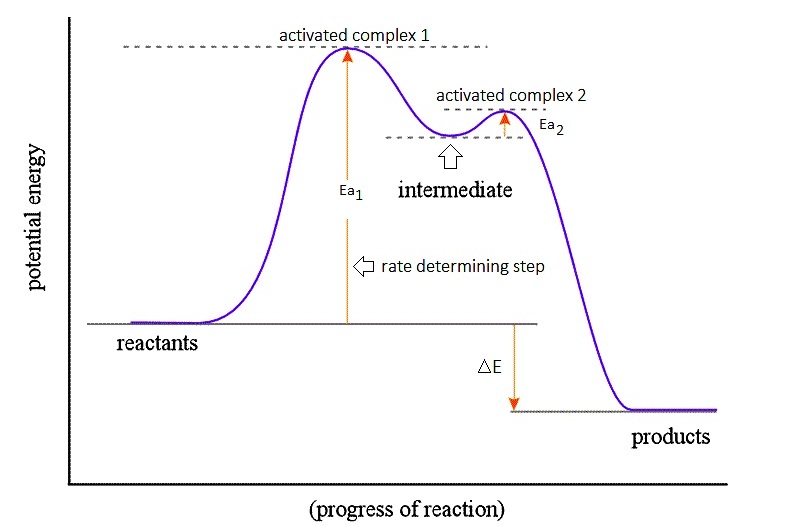
(คลิ้ก ชมพลังงานกับการดำเนินไปของปฏิกิริยา)
จากกราฟแสดงให้เห็นว่าปฏิกิริยามี
2 ขั้น โดยขั้นที่
1 เกิดยากกว่าขั้นที่ 2
สังเกตที่ค่า Ea1 มากกว่า Ea2 ฉะนั้นขั้นที่ 1
จึงเป็นขั้นกำหนดอัตราเร็วของปฏิกิริยา (rate determining step) นอกจากนั้นยังเรียกผลิตภัณฑ์ที่เกิดจากขั้นตอนย่อย
ๆ ว่าสารมัธยันตร์ (intermediate) สารนี้จะเกิดขึ้นเพียงชั่วคราวแล้วเปลี่ยนเป็นสารอื่นในขั้นตอนต่อไป
แบบฝึกหัด
จงใช้ข้อมูลในกราฟต่อไปนี้ตอบคำถามข้อ 1-9
1. Which of the
letters a–f in the diagram represents the potential energy of the products? ___e__
(จากตำแหน่งของตัวอักษร
a-f ในแผนภาพ จงพิจารณาว่าตัวอักษรใดแสดงพลังงานของผลิตภัณฑ์)
2. Which letter
indicates the potential energy of the activated complex? __c____
(ตัวอักษรใดแสดงพลังงานของสารเชิงซ้อนกัมมันต์มันต์)
3. Which letter
indicates the potential energy of the reactants? ___a___
(ตัวอักษรใดแสดงพลังงานของสารตั้งต้น)
4. Which letter
indicates the activation energy? __b__
(ตัวอักษรใดแสดงพลังงานก่อกัมมันต์ของปฏิกิริยา)
5. Which letter
indicates the heat of reaction? __f__
(ตัวอักษรใดแสดงพลังงานของปฏิกิริยา)
6. Is the reaction
exothermic or endothermic? _endo_
(ปฏิกิริยานี้เป็นชนิดดูดความร้อนหรือคายความร้อน)
7. Which letter
indicates the activation energy of the reverse reaction? ___d___
(ตัวอักษรใดแสดงพลังงานก่อกัมมันต์ของปฏิกิริยาย้อนกลับ)
8. Which letter
indicates the heat of reaction of the reverse reaction? ___f___
(ตัวอักษรใดแสดงพลังงานของปฏิกิริยาย้อนกลับ)
9. Is the reverse reaction exothermic or
endothermic? __exo__
(ปฏิกิริยาย้อนกลับเป็นชนิดดูดความร้อนหรือคายความร้อน)
จงใช้ข้อมูลในกราฟต่อไปนี้ตอบคำถามข้อ 1-12
**
PE = Potential Energy
1. The PE of the
reactants of the forward reaction is about __80__
kilojoules.
(สารตั้งต้นของปฏิกิริยาไปข้างหน้ามีพลังงานกี่กิโลจูล)
2. The PE of the
products of the forward reaction is about __160___
kilojoules.
(ผลิตภัณฑ์ของปฏิกิริยาไปข้างหน้า มีพลังงานกี่กิโลจูล)
3. The PE of the
activated complex of the forward reaction is about __240_
kilojoules.
(สารเชิงซ้อนกัมมันต์ของปฏิกิริยาไปข้างหน้ามีพลังงานกี่กิโลจูล)
4. The activation
energy of the forward reaction is about__160_
kilojoules.
(ปฏิกิริยาไปข้างหน้ามีพลังงานก่อกัมมันต์กี่กิโลจูล)
5. The heat of
reaction (ΔH) of the forward reaction is about __+80_
kilojoules.
(พลังงานของปฏิกิริยา สำหรับปฏิกิริยาไปข้างหน้ามีค่ากี่กิโลจูล)
6. The forward
reaction is ____endothermic______(endothermic or exothermic).
(ปฏิกิริยาไปข้างหน้าเป็นชนิดดูดความร้อนหรือคายความร้อน)
7. The PE of the
reactants of the reverse reaction is about __160___
kilojoules.
(สารตั้งต้นของปฏกิริยาย้อนกลับมีพลังงานกี่กิโลจูล)
8. The PE of the
products of the reverse reaction is about ___80__
kilojoules.
(สารผลิตภัณฑ์ของปฏิกิริยาย้อนกลับมีพลังงานกี่กิโลจูล)
9. The PE of the
activated complex of the reverse reaction is about __240__kilojoules.
(สารเชิงซ้อนกัมมันต์ของปฏิกิริยาย้อนกลับมีพลังงานกี่กิโลจูล)
10. The activation
energy of the reverse reaction is about __80__
kilojoules.
(พลังงานก่อกัมมันต์ของปฏิกิริยาย้อนกลับมีค่ากี่กิโลจูล)
11. The heat of
reaction (ΔH) of the reverse reaction is about __-80__
kilojoules.
(พลังงานของปฏิกิริยา (ΔH) ของปฏิกิริยาย้อนกลับมีค่ากี่กิโลจูล)
12. The reverse reaction is ____exothermic_____ (endothermic or
exothermic
(ปฏิกิริยาย้อนกลับเป็นชนิดดูดความร้อนหรือคายความร้อน)
13.
Consider the following mechanism:
(พิจารณากลไกของปฏิกิริยาต่อไปนี้)
Step 1: H2O2
+ I- è H2O + IO-
(slow)
Step 2: H2O2
+ IO- è H2O + O2
+ I- (fast)
a) Give the equation for the
overall reaction. (จงเขียนสมการแสดงปฏิกิริยารวม)
b)
What acts as a catalyst in this mechanism?
_________________________________
(สารใดเป็นตัวเร่งของปฏิกิริยา)
c) What acts as an intermediate
in this mechanism? ____________________________
(สารใดเป็นสารมัธยันตร์)
14. What is meant by the rate
determining step in a reaction mechanism?
(คำว่า rate determining step หมายความว่าอะไร)
15. Given the following steps for
a mechanism: (กำหนดขั้นตอนของปฏิกิริยาดังต่อไปนี้)
Step 1: Br2 è 2Br
(fast)
Step 2: Br + OCl2
è
BrOCl + Cl (slow)
Step 3: Br + Cl è BrCl
(fast)
a. Write the equation for the overall
reaction.
(จงเขียนสมการแสดงปฏิกิริยารวม)
b) A substance is added that decreases
the activation energy for step 1. Will this speed up,
slow down, or have no effect on the rate of the overall
reaction?________________
(ถ้าเติมตัวเร่งลงไปในขั้นตอนที่
1
จะมีผลให้ปฏิกิริยารวมเกิดได้เร็วขึ้น
หรือช้าลง หรือไม่มีผลอะไรเลย)
Give a reason for your answer.
___________________________________________
(จงอธิบายเหตุผลด้วย)
c) Is there a catalyst in
this mechanism? __________. If so, what is it? ____________
(ในกระบวนการนี้มีตัวเร่งอยู่ด้วยหรือไม่)...(ถ้ามี..จงบอกด้วยว่าเป็นสารใด)
d) Is there an intermediate
in this mechanism?________. If so, what is it? __________
(ในกระบวนการนี้มีสารมัธยันตร์หรือไม่)...(ถ้ามี จงบอกด้วยว่าเป็นสารใด)
e) Which step is the rate
determining step? __________________________________
(ขั้นตอนใดเป็นขั้นกำหนดอัตราเร็วของปฏิกิริยา)
รูปภาพที่เกี่ยวข้อง

Size : 18.69 KBs
Upload : 2013-08-12 06:11:21
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|