ปริมาณสารสัมพันธ์ ตอนที่ 9/3 การคำนวณจากสมการขั้นตอนเดียวแต่เกิดขึ้นไม่สมบูรณ์
ปฏิกิริยาขั้นตอนเดียวแต่เกิดขึ้นไม่สมบูรณ์
ปฏิกิริยาในลักษณะนี้ประกอบด้วยสมการเคมีเพียง 1 สมการ แต่ปริมาณสารตั้งต้นที่กำหนดมาให้มีปริมาณไม่สมดุลกัน ทำให้เมื่อเกิดปฏิกิริยาไประยะหนึ่งแล้วจะมี
สารใดสารหนึ่งถูกใช้หมดไปก่อน ทำให้ปฏิกิริยาสิ้นสุดลง สารตั้งต้นชนิดที่เหลือก็จะยังคงเหลืออยู่ในสภาพนั้นต่อไปไม่สามารถเปลี่ยนไปเป็นผลิตภัณฑ์ได้อีก ปริมาณของผลิตภัณฑ์
ที่เกิดขึ้นจะมากหรือน้อยจะขึ้นอยู่กับปริมาณของสารตั้งต้นชนิดที่ถูกใช้หมด จึงเรียกสารตั้งต้นชนิดที่ถูกใช้หมดว่า “สารกำหนดปริมาณผลิตภัณฑ์” (Limiting reagent หรือ Limit agent
หรือ Limiting reactant) สิ่งที่เป็นข้อสังเกตว่าจะเป็นปฏิกิริยาประเภทนี้ก็คือ จะมีการกำหนดปริมาณของสารตั้งต้นมาให้ทุกชนิด แต่เมื่อเปรียบเทียบปริมาณสารตามที่กำหนด
กับปริมาณสารตามอัตราส่วนที่ใช้จากสมการเคมีแล้วจะพบว่าทำปฏิกิริยากันไม่พอดี หรือสังเกตคำบางคำที่ทำให้ทราบว่าทำปฏิกิริยาไม่พอดีกัน เช่น คำว่า มากเกินพอ
(ezcess , large excess, sufficient) เช่น ให้ก๊าซ H2 และ O2 ชนิดละ 1 โมล ทำปฏิกิริยากันจะมีน้ำเกิดขึ้นกี่โมล และจะมีสารตั้งต้นชนิดใดเหลืออยู่กี่โมล
ปฏิกิริยาที่เกิดขึ้นเป็นดังนี้ 2H2 + O2 → 2H2O
จากสมการ จำนวนโมลของ H2 ที่ใช้จะเป็น 2 เท่าของจำนวนโมลของ O2 หรือจำนวน
โมลของ O2 ที่ใช้จะเป็นเพียงครึ่งหนึ่งของจำนวนโมลของ H2 แต่กำหนดมาว่ามีจำนวนโมล H2 = O2 คือชนิดละ 1 โมล ฉะนั้น H2 ย่อมถูกใช้หมดไปก่อนและปฏิกิริยาสิ้นสุดทันที
โดยที่ยังมี O2 เหลืออยู่ เมื่อเป็นเช่นนี้แล้ว H2 จึงเป็นสารกำหนดปริมาณผลิตภัณฑ์ของปฏิกิริยานี้
(คลิ้ก เพื่อชมแอนิเมชันแสดงสารกำหนดปริมาณผลิตภัณฑ์)
เมื่อต้องการทราบว่าจะมี H2O เกิดขึ้นกี่โมล ให้ดูที่ความสัมพันธ์ระหว่าง H2 กับ O2 ในสมการเคมี
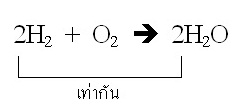
จากสมการจะเห็นได้ว่าจำนวนโมลของ H2 ที่ใช้ = จำนวนโมลของ H2O ที่ได้ ฉะนั้นเมื่อใช้ H2 ไป 1 โมล ก็จะมี H2O เกิดขึ้น 1 โมลด้วยเช่นกัน
(H2O ที่เกิดขึ้น 1 โมลนี้ สามารถเปลี่ยนให้เป็นปริมาณในรูปอื่นก็ได้ เช่น มีน้ำหนัก = 18 กรัม หรือมีจำนวนโมเลกุล = 6.02 x 1023 โมเลกุล
หรือถ้าเป็นไอน้ำที่ STP ก็จะมีปริมาตร 22.4 ลิตร)
การที่ H2 ถูกใช้หมด แสดงว่าสารตั้งต้นที่เหลือก็จะต้องเป็น O2 แต่จะเหลือกี่โมลให้ดูจากสมการได้เช่นกัน
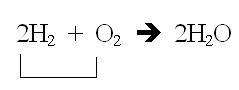
จากสมการ จะใช้ O2 เพียงครึ่งหนึ่งของ H2 ที่ใช้ไป ซึ่งขณะนี้เราทราบว่าใช้ H2 ไป 1 โมล ฉะนั้น O2 ก็จะใช้เพียง 0.5 โมล จึงยังมีเหลืออยู่ 0.5 โมลเช่นกัน
( ปริมาณของ O2 ที่เหลืออยู่นี้สามารถคิดเป็นปริมาณในรูปอื่นได้เช่น หนัก = 16 กรัม หรือมีจำนวนโมเลกุล = 3.01 x 1023 โมเลกุล หรือมีปริมาตร = 11.2 dm3 ที่ STP )
นอกจากนี้แล้วอาจสังเกตจากข้อกำหนดว่า มีสารใดสารหนึ่งทำปฏิกิริยากับอีกสารหนึ่งที่มากเกินพอ หรืออย่างเพียงพอ (excess , sufficient ) สารที่มากเกินพอคือสารที่
มีมากจนใช้ไม่หมด ในขณะที่อีกสารหนึ่งถูกใช้หมดไปก่อนจึงเป็นสารกำหนดปริมาณผลิตภัณฑ์ การเผาไหม้ของสารใด ๆ ในอากาศ ไม่จำเป็นต้องบอกว่ามีออกซิเจนมากเกินพอหรืออย่าง
เพียงพอ แต่ต้องทราบได้เองว่าความจริงแล้วในอากาศมีออกซิเจนมีมากมายจึงมากเกินพอสำหรับการเผาไหม้สารต่าง ๆ ในการทดลอง ฉะนั้นจึงถือว่าสารที่ถูกเผาไหม้เป็นสารกำหนด
ปริมาณผลิตภัณฑ์
ตัวอย่าง โลหะ Mg จำนวนหนึ่งทำปฏิกิริยากับ HCl ที่มากเกินพอ ได้สารละลาย MgCl2 และแก๊สไฮโดรเจน 2.24 dm3 ที่ STP อยากทราบว่าโลหะ Mg ที่ใช้มีน้ำหนักกี่กรัม
(H=1 Mg=24 Cl=35.5)
วิธีทำ ก่อนอื่นต้องพิจารณาให้ทราบแน่ชัดก่อนว่า โจทย์ต้องการทราบสิ่งใด โจทย์กำหนดสิ่งใดมาให้ และสิ่งที่โจทย์กำหนดมานั้นสามารถทำปฏิกิริยากันได้พอดีหรือไม่ สำหรับกรณีนี้
ปฏิกิริยาเป็นชนิดทำปฏิกิริยาไม่พอดี เพราะโจทย์กำหนดชัดเจนว่ามี HCl มากเกินพอ แสดงว่า HCl จะมีเหลือ ขณะที่ Mg ถูกใช้หมด Mg จึงเป็นสารกำหนดปริมาณผลิตภัณฑ์
ปฏิกิริยาที่เกิดขึ้นเป็นดังสมการต่อไปนี้
Mg + 2HCl → MgCl2 + H2
เมื่อต้องการทราบว่าจะมี H2 เกิดขึ้นเท่าไร ให้ดูความสัมพันธ์ระหว่าง Mg กับ H2 ในสมการเคมี
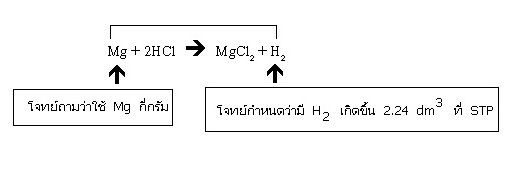
จากสมการ จำนวนโมลของ Mg ที่ใช้ = จำนวนโมลของ H2 ที่เกิดขึ้น
จากปริมาตรของ H2 ที่โจทย์กำหนดให้ เราเปลี่ยนให้เป็นจำนวนโมล เมื่อทราบจำนวนโมล ของ H2 ทำให้เราทราบจำนวนโมลของ Mg ที่ใช้
เพราะมีจำนวนโมลเท่ากัน จากนั้นจึงเปลี่ยนจำนวนโมลของ Mg ให้เป็นน้ำหนัก (กรัม) ก็จะได้คำตอบ

ใช้สูตร
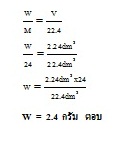
(คลิ้ก ทดลองทำแบบฝึกหัดจากแอนิเมชัน)
แบบฝึกหัด
1. เมื่อเผา Al จำนวน 0.36 โมล กับ O2 จำนวน 0.36 โมล จะเกิด Al2O3 กี่โมล (Al=27)
1. 0.72 2. 0.36 3. 0.18 4. 0.12
2. จากปฏิกิริยาดังสมการ ; CaCO3(s) + 2HCl(aq) → CaCl2(aq) + H2O(l) + CO2(g) ถ้าใช้ CaCO3 หนัก 50 กรัม ทำปฏิกิริยากับสารละลาย HCl ความเข้มข้น 1 mol/dm3
จำนวน 500 cm3 จะเหลือ CaCO3 กี่กรัม
1. 15 2. 25 3. 35 4. 45
3. จากข้อ 2 ขณะที่ปฏิกิริยาเกิดขึ้นจนเกิด CO2 จำนวน 448 cm3 ที่ STP ความเข้มข้นของสารละลาย HCl จะ เป็นกี่โมล/ลิตร
1. 0.92 2. 0.88 3. 0.75 4. 0.55
4. ปฏิกิริยาระหว่างสารละลาย Na2CO3 ความเข้มข้น 0.1 mol/dm3 จำนวน 0.55 dm3 กับสารละลายกรดไฮโดรคลอริก ความเข้มข้น 0.1 mol/dm3 จำนวน 0.2 dm3
จะมีแก๊สคาร์บอนไดออกไซด์เกิดขึ้นกี่โมล
Na2CO3 + HCl → NaCl + H2O + CO2
1. 0.01 2. 0.0055 3. 0.2 4. 0.5
5. ถ้าผสมสารละลายโซเดียมไฮโดรเจนคาร์บอเนต (NaHCO3) 0.12 mol/dm3 จำนวน 25 cm3 กับสารละลายกรดแอซิติก 0.10 mol/dm3 จำนวน 25 cm3
จะได้เกลือโซเดียมอะซิเตต (CH3COONa) มีความเข้มข้นกี่โมล/ลิตร
1. 0.028 2. 0.05 3. 0.07 4. 0.10
6. เมื่อนำโลหะแมกนีเซียม 2.4 กรัม มาทำปฏิกิริยากับกรดไฮโดรคลอริกเข้มข้น 0.8 mol/dm3 ปริมาตร 200 cm3 จะมีโลหะโซเดียมเหลืออยู่กี่กรัม
1. 0.02 2. 0.24 3. 0.48 4. 1.44
7. โลหะ M หนัก 0.56 กรัม ทำปฏิกิริยากับ HCl ที่มากเกินพอ ได้สารละลาย MCl2 และแก๊สไฮโดรเจน 112 cm3 ที่ STP โลหะ M 1 โมล หนักกี่กรัม
1. 11.2 2. 28.0 3. 56.0 4. 112.0
8. เมื่อนำ NaCl 5.85 กรัม มาละลายน้ำ แล้วนำสารละลายที่ได้ไปผสมกับสารละลาย AgNO3 ความเข้มข้น 0.2 mol/dm3 ปริมาตร 100 cm3 อยากทราบว่า
จะมีตะกอนของ AgCl เกิดขึ้นกี่กรัม (Ag=108)
1. 1.17 2. 2.87 3. 5.58 4. 14.87
9. นำ Na2CO3 หนัก 53 กรัมมาละลายน้ำจนได้สารละลาย 100 cm3 แล้วเทผสมกับสารละลาย MgCl2 ความเข้มข้น 0.2 mol/dm3 อยากทราบว่าจะมีตะกอน MgCO3
เกิดขึ้นกี่กรัม
1. 3.36 2. 6.72 3. 16.8 4. 42.0
10. ในการผลิตแก๊ส CO2 จากหินอ่อนชนิดหนึ่งซึ่งประกอบด้วย CaCO3 80% โดยน้ำหนัก โดยให้ทำปฏิกิริยากับกรด HCl ที่มากเกินพอ ถ้าต้องการแก๊ส CO2 จำนวน 112 dm3
ที่ STP จะต้องใช้หินอ่อนกี่กรัม
1. 500 2. 625 3. 112 4. 896
11. เมื่อเผาแมกนีเซี่ยมคาร์บอเนต จะสลายตัวเป็นแมกนีเซียมออกไซด์และคาร์บอนไดออกไซด์ ถ้ามีของผสมระหว่าง MgCO3 และ MgO หนัก 8.0 กรัม เมื่อเผาไปจนสลายตัว
อย่างสมบูรณ์ ปรากฏว่าได้แก๊ส CO2 1.12 dm3 ที่ STP อยากทราบว่า MgO ที่มีอยู่ก่อนการเผามีน้ำหนักกี่กรัม
1. 2 2. 3.8 3. 4.2 4. 5.8
12. นำ MCl2 บริสุทธิ์หนัก 0.475 กรัม มาละลายน้ำจนเป็นสารละลาย 30 cm3 จากนั้นเติมสารละลาย AgNO3 ความเข้มข้น 1 mol/dm3 จำนวน 20 cm3
ทำให้เกิดตะกอน AgCl หนัก 1.435 กรัม จงพิจารณาว่าหลังปฏิกิริยาสิ้นสุด ข้อใดถูกต้อง (Ag=108)
ก. มี Ag+ เหลืออยู่ในสารละลาย 0.01 โมล
ข. [Ag+] ที่เหลืออยู่ในสารละลายผสมเท่ากับ 0.2 mol/dm3
ค. มวลอะตอมของ M = 40
ง. [M2+] = 0.16 mol/dm3
1. ก ข ค 2. ก ข ง 3. ก ค ง 4. ข ค ง
13. นำเกลือซัลเฟตสูตร MSO4.nH2O หนัก 5.0 กรัม มาละลายน้ำจนหมด จากนั้นเติมสารละลาย BeCl2 ลงไปมากเกินพอ เกิดปฏิกิริยาได้ตะกอน BaSO4 หนัก 4.0 กรัม
ถ้ามวลโมเลกุลของ MSO4 เท่ากับ 161.5 อยากทราบว่า n มีค่าเท่าไร ( Ba=137 )
1. 4 2. 5 3. 6 4. 7
14. (เคมีโอลิมปิค 48) จากการวิเคราะห์สารประกอบ AB2 พบว่าอัตราส่วนโดยมวลของ A:B = 3:8 ถ้านำ A มา 18 กรัม ทำปฏิกิริยากับ B มากเกินพอ จะได้ AB2
มากที่สุดกี่กรัม
1. 48 2. 66 3. 51 4. 72
เฉลย
1.2 2.2 3.1 4.2 5.2 6.3 7.4 8.2 9.2 10.3 11.2 12.3
13.4 14.2
Appendix
1. Calculate the number of moles of H2 produced from 0.78 moles Ga and 1.92 moles HCl? (Ans.b) ; (จากปฏิกิริยาต่อไปนี้
ถ้าใช้ Ga 0.78 โมล ทำปฏิกิริยากับ HCl 1.92 โมล จะได้ก๊าซ H2 กี่โมล)
2 Ga + 6 HCl → 2 GaCl3 + 3 H2
a) 0.75 b) 0.96 c) 1.17 d) 0.64 e) 0.45
2. How many moles of ammonia may be produced from 1.20 moles of nitrogen assuming that sufficient hydrogen is available.
(Ans.b) ; (ถ้าใช้ไนโตรเจน 1.20 โมล ทำปฏกิริยากับไฮโดรเจนอย่างเพียงพอ จะมีก๊าซแอมโมเนียเกิดขึ้นกี่โมล)
N2 + 3 H2→ 2 NH3
a) 0.60 b) 2.40 c) 1.20 d) 3.60 e) 4.80
3. How many moles of carbon tetrachloride may be produced from 2.4 moles of chlorine assuming that sufficient methane is available. (Ans.b) ; (ถ้าใช้คลอรีน 2.4 โมล ทำปฏกิริยากับก๊าซมีเทนอย่างเพียงพอ จะมีคาร์บอนเตตระคลอไรด์เกิดขึ้นกี่โมล)
CH4 + 4 Cl2 → CCl4 + 4 HCl
a) 4.8 b) 0.60 c) 9.60 d) 0.15 e) 0.30
4. Hydrogen chloride can be prepared in the laboratory by the following reaction. If 10.0 g of NaCl and 10.0 g of H2SO4
are used, how many g of HCl can be produced? (Atomic weights: Cl = 35.45, O = 16.00, H = 1.008, S = 32.06, Na = 22.99).
(Ans.c) ; (การเตรียมก๊าซไฮโดรเจนคลอไรด์ในห้องปฏิบัติการ โดยปฏิกิริยาระหว่าง NaCl กับกรด H2SO4 ชนิดละl 10 กรัม อยากทราบว่า
จะได้ก๊าซ HCl กี่กรัม)
NaCl + H2SO4 → NaHSO4 + HCl
a) 5.76 b) 6.20 c) 3.72 d) 4.98 e) 4.32
5. How many grams of HClO3 are produced when 4.72 g of ClO2 reacts with 0.947 g H2O?
(Atomic weights: Cl = 35.45, H = 1.008, O = 16.00). (Ans.c) ; (เมื่อ ClO2 4.72 g ทำปฏิกิริยากับ H2O 0.947 g จะมี HClO3
เกิดขึ้นกี่กรัม)
6 ClO2 + 3 H2O → 5 HClO3 + HCl
a) 4.48 b) 4.10 c) 4.93 d) 5.32 e) 5.91
6. A lab locker contains 8 test tubes, 3 beakers, 4 flasks, and 2 graduated cylinders. How many drawers can be stocked from
a supply of 2250 test tubes, 750 beakers, 1100 flasks, and 525 graduated cylinders. (Ans.c) ; (ถ้า lab locker แต่ละหน่วยประกอบ
ด้วยหลอดทดลอง 8 หลอด บีกเกอร์ 3 ใบ ชวดรูปชมพู่ 4 ใบ และกระบอกตวง 2 อัน ถ้ามีหลอดทดลองทั้งหมด 2250 หลอด บีกเกอร์ 750 ใบ
ขวดรูปชมพู่ 1100 ใบ และกระบอกตวง 525 อัน จะจัด lab locker ได้ทั้งหมดกี่หน่วย)
a) 262 b) 270 c) 250 d) 275 e) 281
7. Zinc metal can be obtained by the following reaction. What is the maximum amount of Zn that can be obtained from 75.0 g
of ZnO and 50.0 g of CO?(Atomic weights: C = 12.01, O = 16.00, Zn = 65.38). (Ans.d) ; (การเตรียมโลหะสังหะสีจากปฏิกิริยาดังสมการ
ถ้าใช้ ZnO 75.0 g และ CO 50.0 g จะเตรียมสังกะสีได้อย่างมากที่สุดเท่าไร)
ZnO + CO → Zn + CO2
a) 117 b) 125 c) 45.1 d) 60.3 e) 81.3
8. What mass of Ca(NO3)2 can be prepared by the reaction of 18.9 g of HNO3 with 7.40 g of Ca(OH)2?
(Atomic weights: Ca = 40.08; N = 14.01; O = 16.00; H = 1.008). (Ans.d); (ปฏิกิริยาระหว่าง HNO3 18.9 g กับ Ca(OH)2 7.40 g
ดังสมการ จะมี Ca(NO3)2 เกิดขึ้นกี่กรัม)
2 HNO3 + Ca(OH)2 → Ca(NO3)2 + 2 H2O
a) 14.5 b) 13.4 c) 15.8 d) 16.4 e) 14.9
9. Calcium carbide is produced by heating calcium oxide and carbon. If a reaction mixture contains 1.00 kg each of CaO and C,
how many kg of CaC2 can be prepared? (Atomic weights: C = 12.01, O = 16.00, Ca = 40.08).(Ans.d) ; (แคลเซียมคาร์ไบน์เตรียมได้
จากการเผาแคลเซียมออกไซด์กับคาร์บอน ถ้าใช้แคลเซี่ยมออกไซด์กับคาร์บอนชนิดละ 1 กิโลกรัม จะเตรียมแคลเซียมคาร์ไบน์ได้กี่กิโลกรัม)
CaO + 3 C → CaC2 + CO2
a) 1.85 b) 2.00 c) 1.54 d) 1.14 e) 1.78
10. How many grams of ClF3 can be produced from 12.4 g of chlorine and 14.0 g of fluorine?
(Atomic weights: Cl = 35.45, F = 19.0). (Ans.b) ; (ถ้าใช้คลอรีน 12.4 กรัม ทำปฏิกิริยากับฟลูออรีน 14.0 กรัม จะมี ClF3 เกิดขึ้นกี่กรัม)
Cl2 + 3 F2 → 2 ClF3
a) 26.4 b) 22.7 c) 20.1 d) 19.3 e) 21.3
11. The Widget Manufacturing Company requires one bolt, three washers and two nuts per widget. Their current inventory is
4,000 bolts, 12,000 washers and 7,000 nuts. How many widgets can be produced? (Ans.b)
a) 4,000 b) 3,500 c) 3,700 d) 3,600 e) 3,200
12. What is the limiting reagent and what quantity of SbCl3 results from the reaction of 3.00 g of antimony and 2.00 g of chlorine?
(Atomic weights: Sb = 121.8, Cl = 35.45). (Ans.b) ; (ปฏิกิริยาระหว่างอันติโมนี 3.00 g กับคลอรีน 2.00 g จงพิจารณาว่าสารใดเป็นสารกำหนด
ปริมาณผลิตภัณฑ์ และมี SbCl3 เกิดขึ้นกี่กรัม)
Sb4 + 6 Cl2 → 4 SbCl3
a) Sb, 3.87 b) Cl, 4.29 c) Cl, 4.44 d) Cl, 5.79 e) Sb, 5.62
13. For the following reactions, find the following: 3 NH4NO3 + Na3PO4 → (NH4)3PO4 + 3 NaNO3
Answer the questions above, assuming we started with 30 grams of ammonium nitrate and 50 grams of sodium phosphate. (จากปฏิกิริยาดังที่กำหนด
จงตอบคำถามในแต่ละข้อ โดยให้ถือว่าขณะเริ่มต้นมีแอมโมเนียมไนเตรต 30 กรัม และโซเดียมฟอสเฟต 50 กรัม เสมอ)
a) Which of the reagents is the limiting reagent? (Ans .ammonium nitrate) (สารใดเป็นสารกำหนดปริมาณผลิตภัณฑ์)
b) What is the maximum amount of each product that can be formed? (Ans. 18.6 grams of ammonium phosphate, 31.9 grams of sodium nitrate)
(จะได้ผลิตภัณฑ์แต่ละชนิดอย่างมากที่สุดอย่างละกี่กรัม)
c) How much of the other reagent is left over after the reaction is complete? (Ans. 29.5 grams of sodium phosphate) (เมื่อปฏิกิริยาสิ้นสุดจะมีสารตั้งต้น
ชนิดใดเหลืออยู่และเหลืออยู่กี่กรัม)
14. Consider the following reaction:
3 CaCO3 + 2 FePO4 → Ca3(PO4)2 + Fe2(CO3)3
Answer the questions above,, assuming we start with 100 grams of calcium carbonate and 45 grams of iron (III) phosphate. (จงพิจารณาปฏิกิริยาดังที่กำหนดให้
แล้วตอบคำถามแต่ละข้อ โดยเริ่มต้นจากใช้แคงเซียมคาร์บอร์เนต 100 กรัม ทำปฏิกิริยากับ ไออณออน (III) ฟอสเฟต 45 กรัม)
a) Which of the reagents is the limiting reagent? (Ans. iron (III) phosphate) (สารตั้งต้นชนิดใดเป็นสารกำหนดปริมาณผลิตภัณฑ์)
b) What is the maximum amount of each product that can be formed? (Ans. 46.3 grams of calcium phosphate, 43.8 grams of iron (III) carbonate)
(จะได้ผลิตภัณฑ์แต่ละชนิดอย่างมากที่สุดชนิดละกี่กรัม)
c) How much of the other reagent is left over after the reaction is complete? (Ans. 54.0 grams of calcium carbonate) (เมื่อปฏิกิริยาสิ้นสุดจะมีสารตั้งต้นชนิดใดเหลืออยู่
และเหลืออยู่กี่กรัม)
15. consider the following equation: (จงพิจารณาปฏิกิริยาต่อไปนี้)
Ca(OH)2(s) + 2 HCl(aq) → CaCl2(aq) + 2 H2O(l)
15.1 What type of chemical reaction is taking place? _____________________ (Ans. acid-base reaction)
(เป็นปฏิกิริยาประเภทใด)
15.2 How many liters of 0.100 M HCl would be required to react completely with 5.00 grams of calcium hydroxide? (Ans. 0.135 L) (ถ้าใช้แคลเซียมไฮดรอกไซด์
5.00 กรัม จะต้องใช้สารละลาย HCl ซึ่งเข้มข้น 0.100 M จำนวนกี่ลิตรจึงจะทำปฏิกิริยาพอดีกัน)
16. If I combined 15.0 grams of calcium hydroxide with 75.0 mL of 0.500 M HCl, how many grams of calcium chloride would be formed? (Ans. 2.08 grams)
(ถ้าเรานำแคลเซียมไฮดรอกไซด์ 15.0 กรัม ผสมกับสารละลายกรดไฮโดรคลอริกซึ่งเข้มข้น 0.500 M จำนวน 75.0 mL อยากทราบว่าจะมีแคลเซียมคลอไรด์เกิดขึ้นกี่กรัม)
17. What is the limiting reagent from the reaction in problem __________ (Ans. HCl) (จากจ้อ 16 สารใดเป็นสารกำหนดปริมาณผลิตภัณฑ์)
18. How many grams of the excess reagent will be left over after the reaction in problem is complete? (Ans.13.6 grams of Ca(OH)2) (จากข้อ 16
เมื่อปฏิกิริยาสิ้นสุดจะมีสารตั้งต้นชนิดใดเหลืออยู่และเหลืออยู่กี่กรัม)
รูปภาพที่เกี่ยวข้อง

Size : 15.94 KBs
Upload : 2013-08-07 05:35:51
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|