พันธะเคมี ตอนที่ 5 พันธะโคเวเลนต์ (Covalent bonds)
พันธะโคเวเลนต์ (Covalent bond)
เป็นการสร้างพันธะระหว่างอะตอมของอโลหะกับอโลหะ (รวมทั้งธาตุ Be ซึ่งเป็นโลหะ) ธาตุที่เป็นอโลหะนั้นส่วนใหญ่มีเวเลนซ์อิเล็กตรอนตั้งแต่
4 ขึ้นไป คือคาร์บอน ( C ) แต่ธาตุที่มีเวเลนซ์อิเล็กตรอนเท่ากับ 4 อีก 2 ธาตุ คือ Sn กับ
Pb เป็นโลหะ
นอกจากนั้นยังมีอโลหะอีกชนิดหนึ่งที่มีเวเลนซ์อิเล็กตรอนเท่ากับ 1
คือไฮโดรเจน ( H ) โดยทั่วไปแล้วอโลหะเป็นธาตุที่มีค่าอิเล็กโตรเนกาติวิตี (EN) และพลังงานไอออไนเซชัน (IE) สูง ทำให้เสียอิเล็กตรอนยาก
จึงไม่สามารถให้หรือรับอิเล็กตรอนกันอย่างสมบูรณ์ ไม่เหมือนกรณีของการสร้างพันธะไอออนิก อะตอมของอโลหะที่เวเลนซ์อิเล็กตรอนยังไม่เป็นไปตามกฎออกเต็ตจะมีอิเล็กตรอนเดี่ยวอยู่ในบางออร์บิทัล จะใช้วิธีนำอิเล็กตรอนเดี่ยวที่ต่างฝ่ายต่างก็มีอยู่มาใช้ร่วมกันเป็นคู่
ๆ เกิดการซ้อนทับ (overlap) ของออร์บิทัลซึ่งกันและกัน ถ้าซ้อนทับกันที่ส่วนปลายของออร์บิทัลเรียกว่าซิกมาบอน
( sigma bond ,) ถ้าซ้อนทับกันทางด้านข้างเรียกว่าไพบอนด์
( pi bond ,bonb) ดังรูป
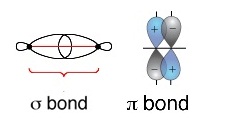
การใช้อิเล็กตรอนร่วมกันนี้เป็นไปเพื่อทำให้ทั้ง 2
ฝ่ายมีเวเลนซ์อิเล็กตรอนเป็นไปตามกฎออกเต็ตคือครบ 8 แต่มีข้อยกเว้นอยู่บ้างในบางกรณีที่อาจจะน้อยกว่า 8
หรือมากกว่า 8 ได้
และการใช้อิเล็กตรอนร่วมกันเป็นคู่ ๆ
ดังกล่าวมานี้เรียกว่าเป็นการสร้างพันธะโคเวเลนต์ ( Covalent bonding ) จะมีได้ตั้งแต่ 1
ถึง 3 คู่ แต่ละอะตอมจะใช้อิเล็กตรอนร่วมกับอะตอมอื่นกี่คู่ ให้สังเกตดูว่าแต่ละอะตอมยังขาดอิเล็กตรอนอีกกี่ตัวจึงจะครบ
8
หรือเป็นไปตามกฎออกเตต (octet rule) อะตอมก็จะใช้เวเลนซ์อิเล็กตรอนเท่ากับจำนวนที่ยังขาดร่วมกับอิเล็กตรอนของอะตอมอื่น โดยอาจเป็นอะตอมของธาตุเดียวกันหรือเป็นธาตุต่างชนิดกันก็ได้
ในกรณีที่เป็นธาตุเดียวกันจะไม่ยุ่งยาก เพราะแต่ละอะตอมมีการจัดอิเล็กตรอนเหมือนกัน จำนวนอิเล็กตรอนที่แต่ละอะตอมขาดไปจึงเท่ากัน เช่น Cl
O และ N จะมีเวเลนซ์อิเล็กตรอนดังนี้
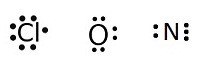 Cl ทุกอะตอมมีเวเลนซ์อิเล็กตรอน = 7 ขาดอีก 1
อิเล็กตรอนจะครบ 8 ถ้า
Cl 2 อะตอม
อยู่ร่วมกัน
แต่ละอะตอมจะใช้เวเลนซ์อิเล็กตรอน
1 ตัว ร่วมกับอีกอะตอมหนึ่ง จึงเป็นการใช้อิเล็กตรอนร่วมกัน 1 คู่ เรียกว่าพันธะเดี่ยว (single bond)
ดังรูป Cl ทุกอะตอมมีเวเลนซ์อิเล็กตรอน = 7 ขาดอีก 1
อิเล็กตรอนจะครบ 8 ถ้า
Cl 2 อะตอม
อยู่ร่วมกัน
แต่ละอะตอมจะใช้เวเลนซ์อิเล็กตรอน
1 ตัว ร่วมกับอีกอะตอมหนึ่ง จึงเป็นการใช้อิเล็กตรอนร่วมกัน 1 คู่ เรียกว่าพันธะเดี่ยว (single bond)
ดังรูป

ออกซิเจน (O) ทุกอะตอมมีเวเลนซ์อิเล็กตรอน = 6 ขาดอีก 2 อิเล็กตรอนจะครบ 8 ถ้าออกซิเจน 2
อะตอม อยู่ร่วมกัน แต่ละอะตอมจะใช้เวเลนซ์อิเล็กตรอน 2
ตัว ร่วมกับอีกอะตอมหนึ่ง จึงเป็นการใช้อิเล็กตรอนร่วมกัน 2 คู่ เรียว่าพันธะคู่ (double bond ) ดังรูป
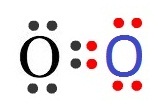
ไนโตรเจน (N) ทุกอะตอมมีเวเลนซ์อิเล็กตรอน = 5 ขาดอีก 3 อิเล็กตรอนจะครบ 8 ถ้าไนโตรเจน 2
อะตอม อยู่ร่วมกัน แต่ละอะตอมจะใช้เวเลนซ์อิเล็กตรอน 3
ตัว ร่วมกับอีกอะตอมหนึ่ง จึงเป็นการใช้อิเล็กตรอนร่วมกัน 3 คู่ เรียกว่าพันธะสาม
(triple bond) ดังรูป

แต่ถ้าเป็นอะตอมของธาตุต่างชนิดกันซึ่งอาจมีเวเลนซ์อิเล็กตรอนเท่ากันหรือไม่เท่ากันก็ได้ การพิจารณาว่าจะ.ใช้อิเล็กตรอนร่วมกันกี่คู่จะมีความยุ่งยากขึ้น เช่น
กรณี Cl กับ
O
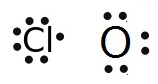
Cl ยังขาดอิเล็กตรอนอีก 1
ตัวจึงจะครบ 8 จึงใช้เวเลนซ์อิเล็กตรอนเพียง 1
ตัวร่วมกับ O
O ยังขาดอิเล็กตรอนอีก 2 ตัวจึงจะครบ
8 จึงต้องใช้เวเลนซ์อิเล็กตรอน 2 ตัวร่วมกับ Cl
กรณีนี้จึงต้องใช้ Cl จำนวน 2
อะตอม แต่ใช้ O เพียง
1 อะตอม ดังรูป
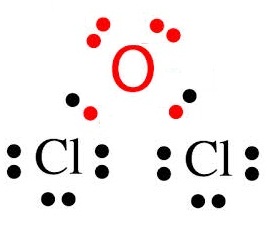
ถ้าเป็นอะตอมของ Cl กับ
N จะเป็นดังนี้

Cl ยังขาดอิเล็กตรอนอีก 1
ตัวจึงจะครบ 8 จึงใช้เวเลนซ์อิเล็กตรอนเพียง 1
ตัวร่วมกับ N
N ยังขาดอิเล็กตรอนอีก 3 ตัวจึงจะครบ 8 จึงต้องใช้เวเลนซ์อิเล็กตรอน 3 ตัวร่วมกับ Cl
กรณีนี้จึงต้องใช้ Cl จำนวน 3 อะตอม
แต่ใช้ N เพียง
1 อะตอม ดังรูป
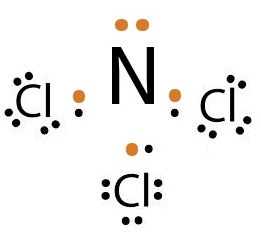
ถ้าเป็นอะตอมของ N กับ
O จะเป็นดังนี้

N ยังขาดอิเล็กตรอนอีก
3 ตัวจึงจะครบ 8 จึงต้องใช้เวเลนซ์อิเล็กตรอน 3 ตัวร่วมกับ O
O ยังขาดอิเล็กตรอนอีก
2 ตัวจึงจะครบ
8 จึงต้องใช้เวเลนซ์อิเล็กตรอน 2 ตัวร่วมกับ N
กรณีนี้การสร้างพันธะเป็นไปได้หลายแบบ
จึงมีสารประกอบหลายชนิด เช่น N2O N2O4 ดังรูป
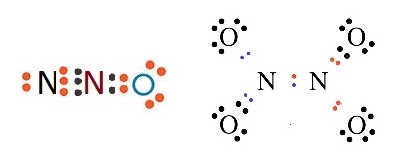
การใช้อิเล็กตรอนร่วมกันเป็นคู่ ๆ ดังกล่าวนี้จะมีตั้งแต่ 1 ถึง 3
คู่
- ถ้าใช้อิเล็กตรอนร่วมกัน 1 คู่เรียกว่า พันธะเดี่ยว (single bond)
- ถ้าใช้อิเล็กตรอนร่วมกัน 2 คู่เรียกว่า พันธะคู่ (double
bond)
- ถ้าใช้อิเล็กตรอนร่วมกัน 3 คู่เรียกว่า พันธะสาม (triple
bond)
การที่อะตอมจะใช้อิเล็กตรอนร่วมกันกี่คู่นั้นเป็นไปตามความเหมาะสมว่า
จะใช้ร่วมกันอย่างไรจึงจะทำให้แต่ละอะตอมมีเวเลนซ์อิเล็กตรอนเป็นไปตามกฎออกเต็ต (แต่มีกรณียกเว้นอยู่บ้าง)
(คลิ้ก ชมการสร้างพันธะโคเวเลนต์ระหว่าง F กับ F
และ H กับ F)
(คลิ้ก ชมการสร้างกันธะโคเวเลต์ระหว่าง H-H , O=O และ H-O )
พันธะเดี่ยว (single bond)
มีอะตอมของธาตุเป็นจำนวนมากที่อยู่รวมกับอะตอมอื่นด้วยการใช้อิเล็กตรอนร่วมกัน 1
คู่ เป็นการสร้างพันธะเดี่ยว เช่น H2 F2 Cl2 Br2 I2
HF HCl HBr HI
H2S CH4 …. จะเห็นได้ว่าการสร้างพันธะสามารถเกิดขึ้นกับอะตอมของธาตุเดียวกัน หรือเกิดขึ้นกับอะตอมของธาตุต่างชนิดกันก็ได้ โดยทั่วไปจะพบว่าอะตอมที่มีเวเลนซ์อิเล็กตรอน
= 7
จะสร้างพันธะเดี่ยวเสมอ ได้แก่ F
Cl Br และ
I รวมทั้ง H ซึ่งมีเวเลนซ์อิเล็กตรอน = 1 ก็จะสร้างพันธะเดี่ยวเช่นกัน พิจารณาอะตอมของ Cl
มีการจัดอิเล็กตรอนดังนี้ ;
17Cl 2 8 7
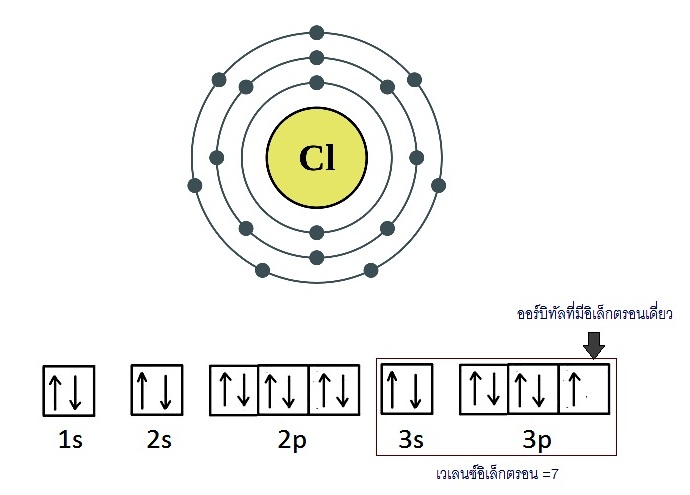
เมื่ออะตอมของ Cl จำนวน 2 อะตอมสร้างพันธะกัน
แต่ละอะตอมก็จะนำอิเล็กตรอนเดี่ยวในออร์บิทัล 3p
มาใช้ร่วมกันโดยซ้อนทับ (overlap) ดังรูป
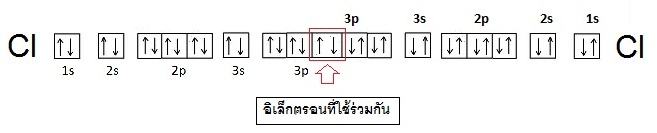
การซ้อนทับของออร์บิทัลเป็นลักษณะของซิกมา บอนด์
ดังรูป
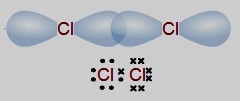
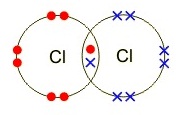
การที่คลอรีน 2 อะตอมใช้อิเล็กตรอนร่วมกัน
1 คู่ มีผลให้คลอรีนทั้ง 2
อะตอมเกิดแรงดึงดูดกับอิเล็กตรอนคู่เดียวกัน จึงทำให้คลอรีนทั้ง 2
อะตอมนี้รวมตัวกันเป็นโมเลกุลของคลอรีน (Cl2) กำหนดให้เรียกอิเล็กตรอนคู่ที่ใช้ร่วมกันว่าอิเล็กตรอนคู่ร่วมพันธะ
(Share pair
electron ; Bond pair electron) กรณีนี้เป็นพันธะเดี่ยวเพราะใช้อิเล็กตรอนร่วมกัน
1 คู่ สำหรับอิเล็กตรอนที่ไม่ได้ใช้ร่วมกันของทั้ง 2
อะตอมเรียกว่าอิเล็กตรอนคู่โดดเดี่ยว (unshared pair electron ; lone pair electron) นับเฉพาะเวเลนซ์อิเล็กตรอนเท่านั้น (มี 6 คู่ )
เราสามารถเขียนแสดงการสร้างพันธะโคเวเลนต์ด้วยสูตรลิวอิส โดยใช้จุด 1
จุดแทนอิเล็กตรอน 1 ตัว แต่ให้แสดงเฉพาะเวเลนซ์อิเล็กตรอนเท่านั้น หรือเขียนย่อโดยใช้เส้น 1
เส้น
แทนอิเล็กตรอนคู่ร่วมพันธะ 1 คู่ก็ได้
ดังรูป
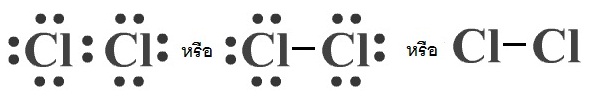
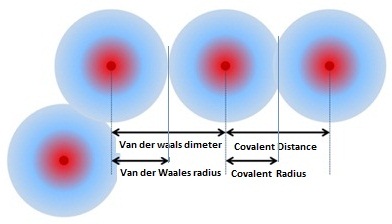
ระยะห่างระหว่างนิวเคลียสของอะตอมที่สร้างพันธะเรียกว่า ความยาวพันธะ (Bond length) และครึ่งหนึ่งของความยาวพันธะคือ รัศมีของอะตอมชนิดรัศมีโคเวเลนต์
(covalent radius) เป็นการบอกขนาดของอะตอมวิธีหนึ่ง ขนาดอะตอมที่เป็นรัศมีโคเวเลนต์
จะเล็กกว่าอะตอมจริงเพราะมีการเหลื่อมซ้อนทับกัน ขนาดจริงของอะตอมที่ไม่มีการซ้อนทับกันเรียกว่ารัศมีแวนเดอร์วาลส์
(Van der Waals radius) ดังรูป
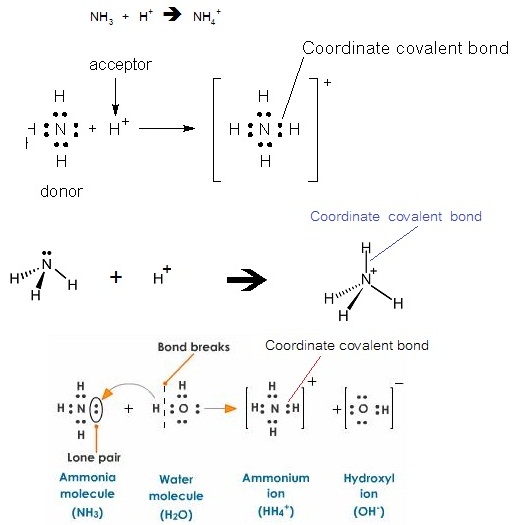
พันธะโคออร์ดิเนตโคเวเลนต์
เป็นพันธะโคเวเลนต์ชนิดพันธะเดี่ยว แต่ตกต่างจากพันธะโคเวเลนต์ธรรมดาคือ อิเล็กตรอนคู่ร่วมพันธะเป็นอิเล็กตรอนของอะตอมใดอะตอมหนึ่งทั้งคู่ ไม่ได้เกิดจากทั้ง 2
อะตอมนำอิเล็กตรอนจำนวนเท่ากันมาใช้ร่วมกัน
( A coordinate covalent bond is a covalent bond in
which both electrons of a shared pair come from one of the two atoms involved
in the bond'.) เช่น NH4+ เกิดจาก NH3 ซึ่งมีอิเล็กตรอนคู่โดดเดี่ยวอยู่ 1
คู่ สร้างพันธะกับ H+ ซึ่งไม่มีอิเล็กตรอนเลย ดังสมการและดังรูป
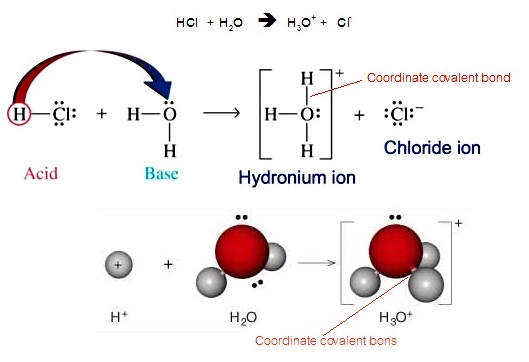
ในสารละลายของกรดชนิดต่าง ๆ กรดจะแตกตัวให้ H+
จากนั้นจะรวมตัวกับ
H2O
โดยเกิดพันธะโคออร์ดิเนตโคเวเลนต์กับอิเล็กตรอนคู่โดดเดี่ยวของ O กลายเป็น H3O+ หรือไฮโดรเนียมไอออน ดังสมการและดังรูป
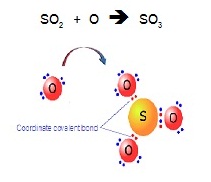
SO3 เกิดจาก SO2 ซึ่งมีอิเล็กตรอนคู่โดดเดี่ยว 1
คู่ อยู่ที่อะตอมของ S จากนั้น O อีก 1อะตอมมาสร้างพันธะโดยใช้อิเล็กตรอนคู่โดดเดี่ยวนี้ ดังรูป
- การสร้างพันธะในลักษณะนี้เป็นปฏิกิริยาระหว่างกรดกับเบสตามทฤษฎีกรด
เบส ของลิวอิส ที่กล่าวว่า กรดคือสารที่รับคู่อิเล็กตรอนจากสารอื่น เบสคือสารที่ให้คู่อิเล็กตรอนแก่สารอื่น ดังรูป
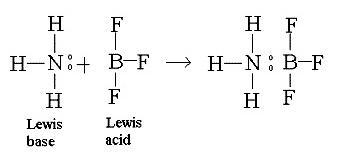
**
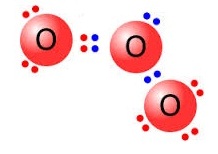
โอโซน (O3) มีการสร้างพันธะดังรูป
จงพิจารณาว่าพันธะโคออร์ดิเนตโคเวเลนต์อยู่ที่ใด
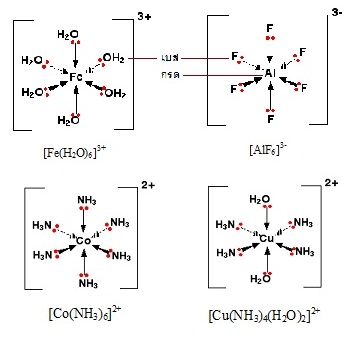
ในสารประกอบเชิงซ้อน (complex compounds)
ชนิดต่าง ๆ ลิแกน (ligands) หรืออนุภาคที่ล้อมรอบอะตอมกลาง จะต้องมีอิเล็กตรอนคู่โดดเดี่ยวอยู่ด้วยจึงจะเป็นลิแกนด์ได้
อนุภาคที่ไม่มีอิเล็กตรอนคู่โดดเดี่ยวจะเป็นลิแกนด์ไม่ได้ เมื่อลิแกนด์ล้อมรอบอะตอมกลาง (central
atom) จะใช้อิเล็กตรอนคู่โดดเดี่ยวดังกล่าวสร้างพันธะโคออร์ดิเนตโคเวเลนต์กัน ลิแกนด์จึงเป็นผู้ให้คู่อิเล็กตรอน (electron
donor) จึงเป็นเบสตามทฤษฎีของลิวอิส ในขณะที่อะตอมกลางเป็นผู้รับคู่อิเล็กตรอน(
electron acceptor ) จึงกรดตามทฤษฎีของลิวอิส ดังรูป
พันธะคู่ (double
bond)
มีอะตอมของธาตุอยู่เป็นจำนวนมากเช่นกันที่อยู่ร่วมกับอะตอมอื่นด้วยการสร้างพันธะคู่ คือใช้อิเล็กตรอนร่วมกับอะตอมอื่นจำนวน 2
คู่ ( 4 อิเล็กตรอน) เช่น O2 CO2 CS2 … การสร้างพันธะคู่ของอะตอมในภาวะปกติจะเกิดขึ้นกับอะตอมที่มีเวเลนซ์อิเล็กตรอนเท่ากับ 6
(ขาดอีก 2 อิเล็กตรอนจะครบ 8 ) พิจารณาการจัดอิเล็กตรอนของออกซิเจน เป็นดังนี้
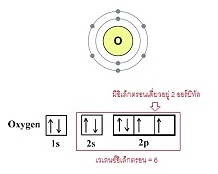
เมื่อออกซิเจน 2 อะตอมสร้างพันธะกัน จะใช้อิเล็กตรอนร่วมกัน 2
คู่ โดยการซ้อนทับ (overlap) ระหว่างออร์บิทัลที่มีอิเล็กตรอนเดี่ยวของแต่ละอะตอม ดังรูป
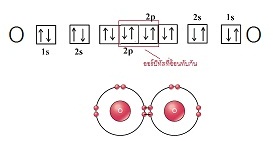
เขียนแสดงด้วยสูตรลิวอิสดังนี้
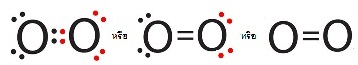
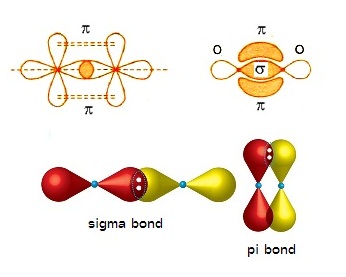
การซ้อนทับของออร์บิทัลในโมเลกุลของ O2 มี
2 แบบ คือ
ซ้อนทับที่ส่วนปลายของออร์บิทัล (sigma
bond) และซ้อนทับทางด้านข้าง
(pi bond) ดังรูป
แต่อย่างไรก็ตามธาตุบางธาตุสามารถสร้างพันธะได้หลายแบบในเวลาเดียวกันโดยขึ้นอยู่กับชนิดของธาตุที่จะสร้างพันธะกัน เช่น CH2O
และ CCl2O พิจารณาที่ C พบว่าสร้างพันธะคู่กับ O จำนวน
1 พันธะ แต่สร้างพันธะเดี่ยวอีก 2
พันธะกับ H จำนวน 2
อะตอม หรือ Cl 2
อะตอมตามลำดับ ดังรูป
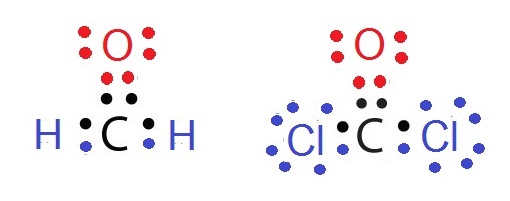
พันธะสาม (triple bond)
อะตอมในภาวะปกติที่จะสร้างพันธะสามกับอะตอมอื่นจะมีเวเลนซ์อิเล็กตรอนเท่ากับ 5 (ขาดอีก
3 จะครบ 8) พิจารณาการจัดอิเล็กตรอนของไนโตรเจนจะเป็นดังนี้
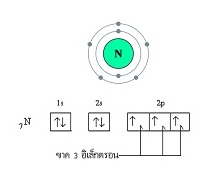
เมื่ออะตอมของไนโตรเจน 2
อะตอมสร้างพันธะกัน
จะสร้างพันธะกันโดยใช้อิเล็กตรอนร่วมกัน
3 คู่ เรียกว่าพันธะสาม (Triple
bond) ดังนี้

เขียนแสดงด้วยสูตรลิวอิสดังนี้

พันธะสามจะประกอบด้วย sigma bond 1 พันธะกับ pi bond 2
พันธะ ดังรูป

(คลิ้ก ชมวีดีทัศน์แสดงการเกิด sigms bond และ pi bond ของ N2)
ซิกมาบอนด์กับไพบอนด์ (Sigma and
pi bond)
การสร้างพันธะโคเวเลนต์มี
2 แบบ คือ
ซิกมาบอนด์ (σ
bond ) และ ไพบอนด์ ( pi bond ,
π
bonds)
ซิกมาบอนด์ (σ bond ) เป็นการซ้อนทับ(overlap)ที่ส่วนปลายของออร์บิทัล
เกิดขึ้นกับออร์บิทัลชนิดเดียวกันหรือต่างชนิดกันก็ได้ ถ้าพันธะเป็นพันธะเดี่ยวจะเป็นซิมาบอนด์เสมอ ดังรูป
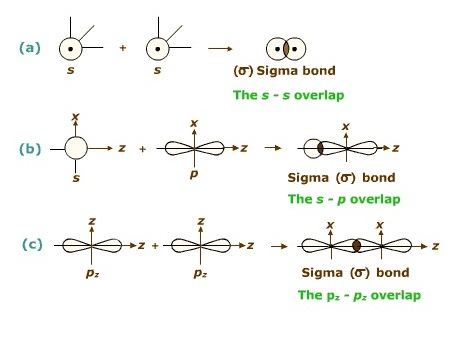
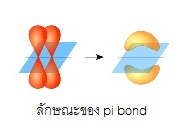
ไพบอนด์ ( pi bond , π bonds) คือการซ้อนทับ (overlap) กันบริเวณด้านข้างของออรบิทัล ไพบอนจะเกิดชึ้นในพันธะคู่และพันธะสาม ไม่มีในพันธะเดี่ยว ถ้าเป็นพันธะคู่จะประกอบด้วย σ bond 1 พันธะ π bonds 1 พันธะถ้าเป็นพันธะสามจะประกอบด้วย σ bond 1 พันธะ
π bonds 2
พันธะ ดังรูป
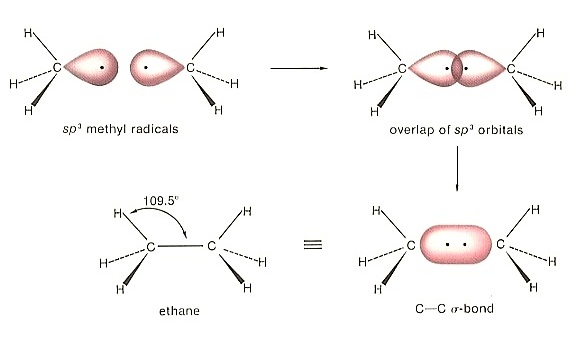
ใน C2H6 พันธะระหว่าง C-C เป็นพันธะเดี่ยว และเป็น σ bond
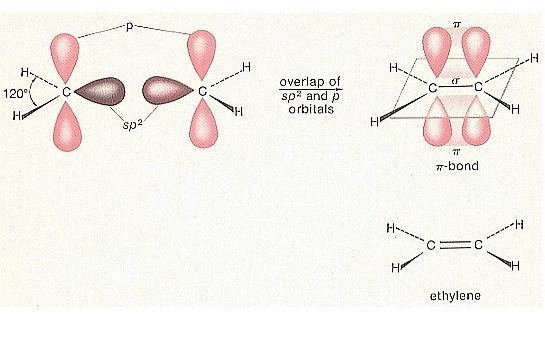
ใน C2H4 พันธะระหว่าง C=C เป็นพันธะคู่ ประกอบด้วยเป็น σ bond 1 พันธะ
π
bonds 1 พันธะ
การกล่าวถึงซิกมาบอนกับไพบอนจะมีมากในเรื่องสารประกอบของคาร์บอน
(เคมีอินทรีย์ , organic chemistry) พันธะดังกล่าวจะเกิดขึ้นระหว่างอะตอมของ C กับ C สัมพันธ์กับการเกิดไฮบริไดเซชันของ C ที่เป็นไปได้
3 แบบ คือ sp sp2 และ sp3 ดังรูป
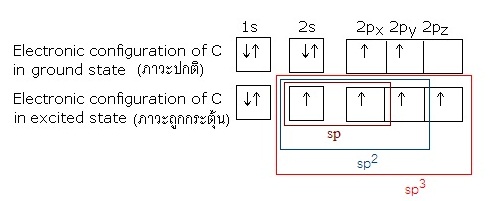
ไฮบริดออร์บิทัล sp sp2 และ sp3 มีรูปทรงเรขาคณิตเป็น เส้นตรง (linear) สามเหลี่ยมแบนราบ (trigonal plana) และทรงเหลี่ยมสี่หน้า (tetrahedral) ตามลำดับ
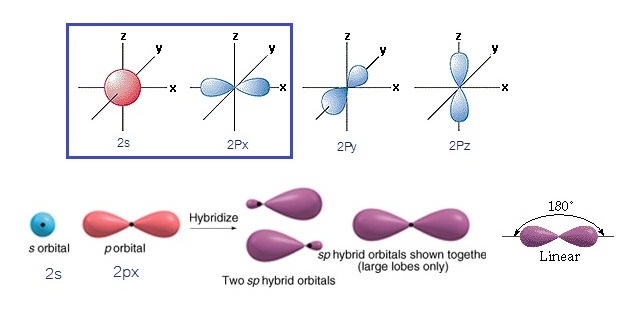
ไฮบริดออร์บิทัล sp เกิดขึ้นจากการรวมตัวระหว่าง orbital
2s กับ orbital 2px ไฮบริดออร์บิทัลที่เกิดขึ้นมีรูปร่างเป็นเส้นตรง
(Linear) ดังรูป
(คลิ้ก ชมเกิดไฮบริไดเซชัน sp ของคาร์บอน)
ไฮบริดออร์บิทัล sp2 เกิดขึ้นจากการรวมตัวระหว่าง
orbital 2s กับ orbital 2px และ 2py ไฮบริดออร์บิทัลที่เกิดขึ้นมีรูปร่างเป็นสามเหลี่ยมแบนราบ
(Trigonal plana) ดังรูป
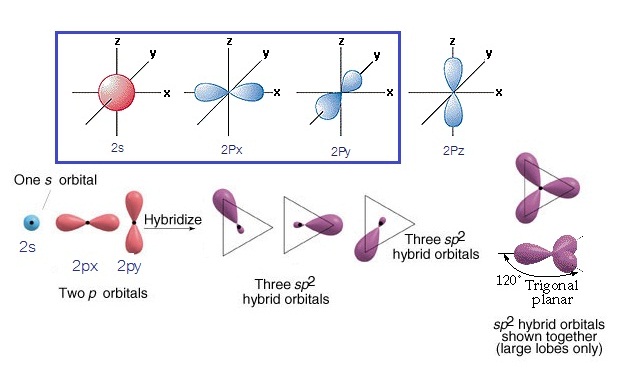
(คลิ้ก ชมการเกิดไฮบริไดเซชัน sp2
ของคาร์บอน)
ไฮบริดออร์บิทัล sp3 เกิดขึ้นจากการรวมตัวระหว่าง orbital 2s กับ orbital 2px 2py และ pz ไฮบริดออร์บิทัลที่เกิดขึ้นมีรูปร่างเป็นทรงเหลี่ยนสี่หน้า (Tetrehedral)
ดังรูป
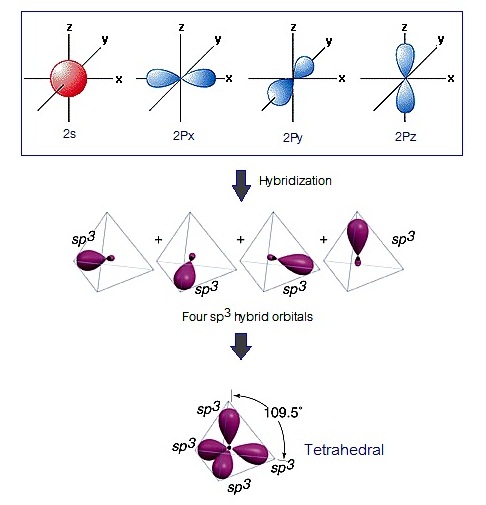
(คลิ้ก
ชมการเกิดไฮบริไดเซชัน
sp3 ของคาร์บอน)
(คลิ้ก ชมไฮบริไดเซชันและรูปทรงเรขาคณิตของไฮบริดออร์บิทัลแบบต่าง
ๆ)
ไฮบริดออร์บิทัลทั้ง 3 แบบดังกล่าวมานี้
เมื่ออะตอมของคาร์บอนอยู่ในสารประกอบไฮโดรคาร์บอนที่โมเลกุลประกอบด้วย C 2
อะตอม เช่น C2H6 C2H4 และ C2H2 พันธะระหว่างอะตอมของ C กับ
C จะแตกต่างกันคือ
* ใน C2H6 พันธะระหว่าง C กับ
C เป็นพันธะเดี่ยวชนิด sigma bond ดังรูป
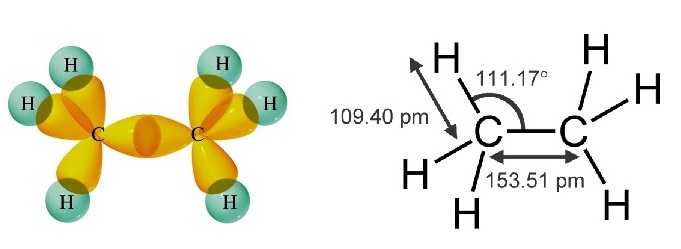
(คลิ้ก
ชมการเกิด sigma bond ใน C2H6 )
* ใน C2H4 พันธะระหว่าง C กับ
C เป็นพันธะเป็นพันธะคู่ ประกอบด้วย sigma bond 1 พันธะ pi
bond 1 พันธะ ดังรูป
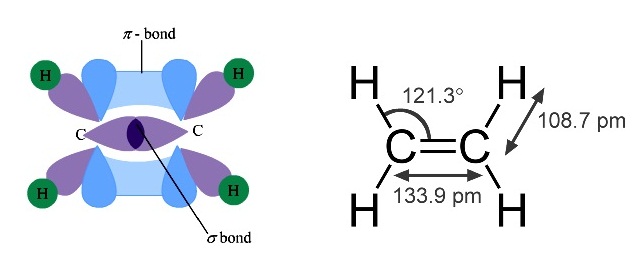
(คลิ้ก ชมการเกิด sigma bond
และ pi bond ใน C2H4)
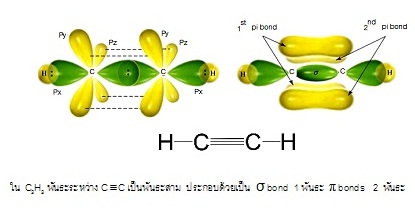
* ใน C2H2 พันธะระหว่าง C กับ
C เป็นพันธะสาม ประกอบด้วย sigma bond
1 พันธะ
pi bond 2 พันธะ ดังรูป
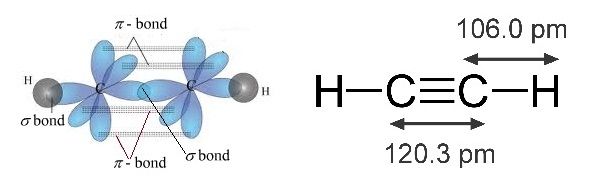
(คลิ้ก ชมการเกิด sigma bond
และ pi bond ใน C2H2)
*** สังเกตความยาวพันธะ C-C > C=C > C C ดังรูป
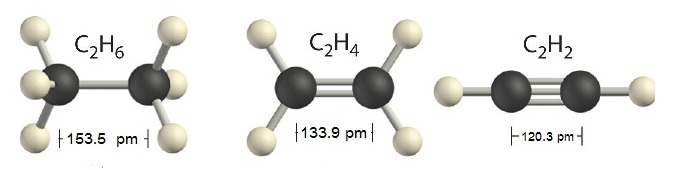
การเขียนสูตรลิวอิสของสารโคเวเลนต์
การเขียนสูตรแสดงการสร้างพันธะโคเวเลนต์ระหว่างอะตอมของธาตุเดียวกันจะไม่ยุ่งยาก เพราะแต่ละอะตอมมีโครงสร้างเหมือนกัน จำนวนอิเล็กตรอนที่ต้องการเพิ่มเพื่อให้เป็นไปตามกฎออกเตตจึงมีจำนวนเท่ากัน ฉะนั้นแต่ละอะตอมจะใช้เวเลนซ์อิเล็กตรอนจำนวนเท่ากันมาสร้างพันธะกัน จะใช้อิเล็กตรอนอะตอมละกี่ตัวก็ขึ้นอยู่กับแต่ละธาตุ ว่าต้องการอิเล็กตรอนอีกกี่ตัวจึงครบ 8 ใช้หลักการง่าย ๆ ว่าแต่ละอะตอมจะใช้เวเลนซ์อิเล็กตรอนเท่ากับจำนวนที่ต้องการเพื่อให้ครบ 8 ร่วมกับอะตอมอื่น เช่น กรณีของ Cl2 O2 และ N2
ที่แสดงเป็นตัวอย่างมาแล้ว
Cl , O และ N ต้องการอิเล็กตรอนเพิ่มอะตอมละ
1 , 2 และ 3
ตัว ตามลำดับ ฉะนั้นแต่ละอะตอมจึงใช้เวเลนซ์อิเล็กตรอนร่วมกับอะตอมอื่นจำนวน 1 , 2 และ 3
ตัว เป็นการใช้อิเล็กตรอนร่วมกัน 1
2 และ 3
คู่ จึงได้พันธะเดี่ยว พันธะคู่
และพันธะสาม ตามลำดับ ดังรูป
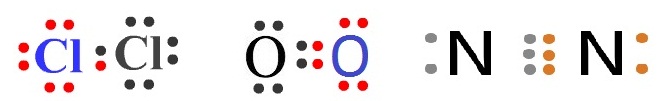
แต่ถ้าเป็นกรณีที่เกิดจากธาตุต่างชนิดมาสร้างพันธะกัน
ถ้าแต่ละธาตุมีจำนวนเวเลนซ์อิเล็กตรอนเท่ากัน
การสร้างพันธะก็จะเป็นทำนองเดียวกับอะตอมของธาตุเดียวกันสร้างพันธะกัน
แต่บางครั้งอาจมีลักษณะพิเศษเพิ่มขึ้นบ้างเช่น ClF มีเวเลนซ์อิเล็กตรอน = 7 เหมือนกัน SO2 มีเวเลนซ์อิเล็กตรอน = 6 เหมือนกัน การสร้างพันธะเป็นดังรูป

แต่ถ้าธาตุมีเวเลนซ์อิเล็กตรอนไม่เท่ากัน การสร้างพันธะก็จะมีความซับซ้อนขึ้นแต่ยังคงใช้หลักการเดิม คือ แต่ละอะตอมจะใช้เวเลนซ์อิเล็กตรอนเท่ากับจำนวนที่ต้องการให้ครบ 8
ในการสร้างพันธะกับอะตอมอื่น อาจเป็นการสร้างพันธะเดี่ยว พันธะคู่หรือพันธะสาม ขึ้นอยู่กับการจัดอิเล็กตรอนของแต่ละธาตุ ต้องพิจารณาเป็นรายกรณีไป แต่เพื่อให้เป็นแนวทางในการเขียนสูตรให้ถูกต้อง ควรพิจารณากฎ
5 ข้อ ดังต่อไปนี้
Lewis (Electron) Dot Formulas – 5
Easy Rules (กฎง่าย ๆ 5
ข้อสำหรับการเขียนสูตรลิวอิส)
1. Determine Arrangement – Place the least electronegative
atom in the center. The halogens and
hydrogen
can never be in the center.
(จัดให้อะตอมที่มีค่า EN ต่ำที่สุดเป็นอะตอมกลาง
ยกเว้นธาตุฮาโลเจนและไฮโดรเจนเป็นอะตอมกลางไม่ได้)
2. Determine total number of valence electrons. Two electrons are represented by one dash.
(add for negative ions, subtract for positive ions)
(พิจารณาจำนวนเวเลนซ์อิเล็กตรอนทั้งหมดของทุกอะตอมว่ามีเท่าไร และอิเล็กตรอน 1
คู่ จะเขียนแทนด้วยขีด 1
ขีดก็ได้ ถ้าเป็นไอออนลบจะมีอิเล็กตรอนเพิ่มขึ้นตามจำนวนของประจุลบ ในขณะที่ไอออนบวกจะมีจำนวน
อิเล็กตรอนลดลงตามจำนวนของประจุบวก)
3. Attach central atom
to surrounding atoms. Molecule should be
symmetrical.
(อะตอมอื่น ๆ
ที่ล้อมรอบอะตอมกลางต้องอยู่ในตำแหน่งที่สมมาตร)
4. Distribute remaining electrons.
(ใส่จุดแสดงอิเล็กตรอนในตำแหน่งต่าง ๆ
อย่างเหมาะสม)
5. Use double or triple bonds if necessary. Hydrogen and the
halogens can never have a double or
triple
bond.
(จะใช้พันธะคู่หรือพันธะสามตามความจำเป็น
แต่ต้องทราบว่าสำหรับธาตุไฮโดรเจนและฮาโลเจนต่าง ๆ จะสร้างพัน
คู่หรือพันธะสามไม่ได้)
เพิ่มเติม
***
สิ่งที่ทำให้เกิดความผิดพลาดได้ง่ายในการเขียนสูตรลิวอิส ของโมเลกุลที่ประกอบอะตอมตั้งแต่ 3
อะตอมขึ้นไปก็คือ
ไม่รู้ว่าจะใช้อะตอมของธาตุใดเป็นอะตอมกลาง
แนะนำว่าให้ใช้อะตอมที่มีเวเลนซ์อิเล็กตรอนน้อยที่สุด หรือมีค่า EN น้อยว่าธาตุอื่น ๆ เป็นอะตอมกลาง
อะตอมที่มีเวเลนซ์อิเล็กตรอนมากกว่าเป็นอะตอมที่ล้อมรอบอะตอมกลาง
***
การพิจารณาว่าจะใช้อิเล็กตรอนร่วมกันกี่คู่ ให้ดูที่อะตอมที่มีเวเลนซ์อิเล็กตรอนมากกว่า
ซึ่งก็คืออะตอมที่ล้อมรอบอะตอมกลางแต่ละอะตอม ว่าขาดอิเล็กตรอนกี่ตัวจึงจะครบ 8
จะใช้อิเล็กตรอนตามจำนวนที่ยังขาดร่วมกับอะตอมกลาง ถ้าขาด
1 ตัว จะใช้อิเล็กตรอนร่วมกัน 1
คู่ สร้างพันธะเดี่ยว ถ้าขาด
2 ตัว จะใช้อิเล็กตรอนร่วมกัน 2 คู่ สร้างพันธะคู่ ถ้าขาด
3 ตัว จะใช้อิเล็กตรอนร่วมกัน 3
คู่ สร้างพันธะสาม
***
สิ่งที่ผิดพลาดบ่อยอีกเรื่องหนึ่งคือ
จำนวนจุดที่ใช้แสดงจำนวนอิเล็กตรอนไม่ตรงกับความเป็นจริง เพื่อป้องกันความผิดพลาด
ให้นับจำนวนเวเลนซ์อิเล็กตรอนของทุกธาตุในโมเลกุลว่ามีเท่าไร จำนวนจุดต้องมีเท่ากัน ถ้ามากกว่าหรือน้อยกว่าจะผิด
(คลิ้ก ชมตัวอย่างการสร้างพันธะโคเวเลนต์)
(คลิ้ก ชมการสร้างพันธะระหว่างอะตอมของธาตุต่าง
ๆ)
(คลิ้ก ชมและอ่านคำอธิบายการเขียนสูตรลิวอิส)
ตัวอย่าง จงเขียนสูตรลิวอิสของ OCl2
วิธีทำ 17Cl กับ 8O
มีการจัดอิเล็กตรอนดังนี้
17Cl 2
8 7 มีเวเลนซ์อิเล็กตรอน 7
ต้องการอีก 1 เพื่อให้ครบ 8 จึงสร้างพันธะเดี่ยวได้อย่างเดียว
8O
2 6 มีเวเลนซ์อิเล็กตรอน 6
ต้องการอีกอีก 2 เพื่อให้ครบ 8
จึงต้องสร้างพันธะเดี่ยวกับ Cl
2 อะตอม ดังรูป

ตัวอย่าง จงเขียนสูตรลิวอิสของ CCl4
วิธีทำ 6C กับ 17Cl มีการจัดอิเล็กตรอนดังนี้
17Cl 2 8
7 มีเวเลนซ์อิเล็กตรอน 7 ต้องการอีก 1 จึงจะครบ
8 สร้างพันธะเดี่ยวได้อย่างเดียว
6C 2 4 มีเวเลนซ์อิเล็กตรอน 4
ต้องการอีก 4 เพื่อให้ครบ
8 ต้องสร้างพันธะเดี่ยวกับ Cl 4
อะตอม
ดังรูป
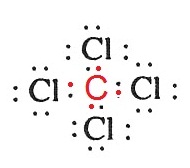
ตัวอย่าง จงเขียนสูตรลิวอิสของ CO2
วิธีทำ 6C กับ 8O จัดอิเล็กตรอนดังนี้
8O 2
6 มีเวเลนซ์อิเล็กตรอน 6
ต้องการอีก 2 จึงจะครบ 8 จึงสร้างคู่ 1
พันธะกับ C
6C
2 4 มีเวเลนซ์อิเล็กตรอน
4 ต้องการอีก 4 จึงจะครบ 8
จึงต้องสร้างพันธะคู่กับ O 2 อะตอม
อะตอมละ 1 พันธะ ดังรูป
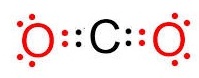
ตัวอย่าง จงเขียนสูตรลิวอิสของ CO
วิธีทำ 6C กับ 8O จัดอิเล็กตรอนดังนี้
8O 2
6 มีเวเลนซ์อิเล็กตรอน 6
ต้องการอีก 2 จึงจะครบ 8
ใช้อิเล็กตรอนร่วมกับ O 2 ตัว
6C
2 4 มีเวเลนซ์อิเล็กตรอน
4 ต้องการอีก 4
จึงจะครบ 8 การสร้างพันธะจะเป็น ดังรูป

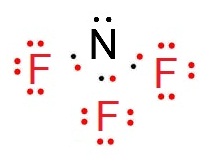
ตัวอย่าง จงเขียนสูตรลิวอิสของ NF3
วิธีทำ
9F กับ 7N
จัดอิเล็กตรอนดังนี้
9F 2
7 มีเวเลนซ์อิเล็กตรอน 7 ต้องการอีก 1
จึงจะครบ 8 จึงสร้างพันธะเดี่ยวกับ N 1 พันธะ
7N 2
5 มีเวเลนซ์อิเล็กตรอน 5 ต้องการอีก 3 จึงจะครบ
8 จึงสร้างพันธะเดี่ยวกับ F
3 อะตอม
ดังรูป
พันธะในไอออนที่เป็นกลุ่มอะตอม (bond in polyatomic ion)
ไอออนที่เป็นกลุ่มอะตอม เช่น NO3- CO32- SO42- PO43- … จำนวนประจุลบเกิดจากการมีอิเล็กตรอนมากกว่าปกติ
มีประจุลบเท่าไรก็หมายความว่ามีอิเล็กตรอนมากกว่าปกติอยู่จำนวนเท่านั้น โดยทั่วไปแล้วอิเล็กตรอนที่มีมากกว่าปกตินี้จะอยู่ที่อะตอมกลาง
(อะตอมที่ขีดเส้นใต้)
การสร้างพันธะจะเป็นดังนี้
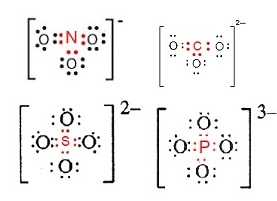
จากรูป ถ้าสังเกตจะเห็นว่า ...
เวเลนซ์อิเล็กตรอนของ N
เพิ่มจาก 5 เป็น
6 คือมีอิเล็กตรอนเพิ่ม 1
ตัว ตามประจุ 1-
เวเลนซ์อิเล็กตรอนของ C
เพิ่มจาก 4 เป็น 6 คือมีอิเล็กตรอนเพิ่ม 2
ตัว ตามประจุ 2-
เวเลนซ์อิเล็กตรอนของ S เพิ่มจาก 6 เป็น
8 คือมีอิเล็กตรอนเพิ่ม 2
ตัว ตามประจุ 2-
เวเลนซ์อิเล็กตรอนของ P เพิ่มจาก 5 เป็น
8 คือมีอิเล็กตรอนเพิ่ม 3
ตัว ตามประจุ 3-
เพิ่มเติม
1. อะตอมของ H และธาตุฮาโลเจนจะสร้างพันธะเดี่ยวกับอะตอมอื่น
ๆ เสมอ และเป็นอะตอมกลางของ
โมเลกุลไม่ได้
2. ธาตุฮาโลเจนจะสร้างพันธะเดี่ยวได้อย่างเดียว
ไม่ว่าจะสร้างพันธะกับธาตุเดียวกันหรือธาตุต่างชนิดกัน
เช่น F-F Cl-Cl
Br-Br I-I Cl-F
Br-Cl Br-I
3. ถ้าอะตอมมีเวเลนซ์อิเล็กตรอน
= 6
3.1
สร้างพันธะกับอะตอมที่มีเวเลนซ์อิเล็กตรอน = 6 เช่นกัน
จะสร้างพันธะคู่ เช่น O=O
3.2 สร้างพันธะกับ H หรือธาตุที่มีเวเลนซ์อิเล็กตรอน = 7 จะสร้างพันธะเดี่ยว 2 พันธะ
เช่น H2O
Cl2O
4. ถ้าอะตอมมีเวเลนซ์อิเล็กตรอน
= 5
3.1 สร้างพันธะกับอะตอมที่มีเวเลนซ์อิเล็กตรอน
= 5 เช่นกัน จะสร้างพันธะสาม เช่น
3.2 สร้างพันธะกับ H หรือธาตุที่มีเวเลนซ์อิเล็กตรอน
= 7 จะสร้างพันธะเดี่ยว 3 พันธะ เช่น NH3
PCl3
5. มีข้อยกเว้นต่าง ๆ อยู่บ้างที่จะกล่าวถึงในตอนต่อ ๆ ไป
การเขียนสูตรและการเรียกชื่อสารโคเวเลนต์
เรามักจะคุ้นเคยกับการเขียนสูตรของสารโคเวเลนต์ตามที่พบเห็น เช่น เขียนว่า
H2O หมายถึงน้ำ
แต่ไม่เขียนว่า OH2 (ยกเว้นในการเขียนแสดงสูตรแสดงโครงสร้างของโมเลกุลที่ซับซ้อนเพื่อแสดงให้เห็นว่าโมเลกุลหันด้านใดเข้าหากัน) ในการเขียนสูตรโมเลกุลของสารโคเวเลนต์นั้นจะเรียงลำดับของธาตุอย่างไร มีหลักการการกว้าง ๆ ว่าให้ดูตำแหน่งของธาตุในตารางธาตุ ให้เขียนสัญลักษณ์ของธาตุที่อยู่ด้านซ้ายของตารางธาตุก่อน แล้วจึงตามด้วยธาตุที่อยู่ทางขวาต่อเนื่องกันไป (คลิ้ก ดูตารางธาตุ)
เช่น
HCl HNO3 PCl3 CCl4 แต่หลักการนี้ใช้กับสารทั้งหมดไม่ได้
เพราะมีบางชนิดที่เขียนธาตุที่อยู่ทางขวาก่อนธาตุทางซ้าย เช่น NH3 HClO3 จึงมีข้อกำหนดในการเรียงลำดับของธาตุก่อน-หลังดังนี้
B
, Si , C , P , H , S , I , Br , Cl , O และ F.
ลำดับก่อนหรือหลังของธาตุในสูตรของการประกอบ มีผลต่อการเรียกชื่อของสารนั้น ๆ เพราะการเรียกชื่อจะเรียกตามลำดับของธาตุที่แสดงอยู่ในสูตรของสาร (ยกเว้นกรณีที่เรียกด้วยชื่อสามัญ) เช่น HCl เรียกชื่อว่า ไฮโดรเจนคลอไรด์ ถ้าเขียนสูตรเป็น ClH จะต้องเรียกว่า คลอรีนไฮไดรด์
ฉะนั้นการกำหนดลำดับของธาตุในการเขียนสูตรของสารโคเวเลนต์ จึงเป็นผลดีในการป้องกันความสับสนของการเรียกชื่อสารเดียวกัน
การเรียกชื่อสารโคเวเลนต์จึงมีความยุ่งยากกว่าการเรียกชื่อสารไอออนิก บางชนิดใช้ชื่อสามัญ (common names ) เช่น CH4 เรียกว่า methane
NH3 เรียกว่า ammonia
H2O
เรียกว่า water แต่อย่างไรก็ตามมีหลักการทั่วไปของการเรียกชื่อดังนี้
1. เริ่มต้นด้วยชื่อของธาตุตัวแรกที่แสดงอยู่ในสูตรของสารประกอบ และถ้ามีจำนวนอะตอมมากกว่า 1
ต้องบอกจำนวนอะตอมด้วยภาษาละติน ( 1 = mono, 2 = di-, 3 = tri-, 4 = tetra-, 5 = penta-,6
= hexa-, 8 = octa- , 9 = nona- , 10 =
deca-)
2. คำลงท้ายจะเป็นชื่อของธาตุที่อยู่ท้ายในสูตรของสารประกอบ แต่ให้เปลี่ยนเสียงคำลงท้ายเป็นสำเนียง
–ide คำว่า mono จะไม่ใช้ในการเรียกชื่อสารทั่ว ๆ
ไป
แต่จะใช้สำหรับสารประกอบออกไซด์เท่านั้น
3. ถ้าธาตุที่อยู่ท้ายเป็น polyatomic ion เช่น CN- , ไซยาไนด์
เสียงคำท้ายจะใช้ชื่อของไอออนนั้น
ตัวอย่าง
|
สารตัวอย่าง
|
การเรียกชื่อ
|
|
NO2
|
ไนโตรเจนไดออกไซด์
|
|
N2O
|
ไดไนโตรเจนออกไซด์
|
|
N2O4
|
ไดไนโตรเจนเตตระออกไซด์
|
|
PCl3
|
ฟอสฟอรัสไตรคลอไรด์
|
|
PCl5
|
ฟอสฟอรัสเพนตะคลอไรด์
|
|
CO
|
คาร์บอนโมโมออกไซด์(คาร์บอนมอนอกไซด์)
|
|
CO2
|
คาร์บอนไดออกไซด์
|
|
HCN
|
ไฮโดรเจนไซยาไนด์
|
แบบฝึกหัด
1. จงเขียนสูตรลิวอิส (Lewis Diagrams
, Lewis structure,
Lewis
electron-dot structure) ทั้งแบบเต็มและแบบย่อ
เพื่อแสดงการสร้างพันธะของสารต่อไปนี้และเรียกชื่อสารดังกล่าวด้วย
|
สาร
|
สูตรแบบเต็ม
|
สูตรแบบย่อแสดงอิเล็กตรอนคู่โดดเดี่ยว
|
สูตรแบบย่อไม่แสดงอิเล็กตรอนคู่โดดเดี่ยว
|
ชื่อสาร
|
|
H2O
|
|
|
|
water ,น้ำ
(common name,
ชื่อสามัญ)
|
|
CO2
|
|
|
|
|
|
HCN
|
|
|
|
|
|
C2H5OH
|
|
|
|
|
|
CH4
|
|
|
|
|
|
C2H6
|
|
|
|
|
|
C2H4
|
|
|
|
|
|
C2H2
|
|
|
|
|
|
CH3COOH
|
|
|
|
|
|
PH3
|
|
|
|
|
|
NCl3
|
|
|
|
|
|
CH2O
|
|
|
|
|
|
CCl4
|
|
|
|
|
|
CS2
|
|
|
|
|
2.
Which of the following is the correct formula for a compound of carbon and
chlorine?
(สูตรของสารประกอบระหว่างคาร์บอนกับคลอรีนข้อใดถูกต้อง)
a) CCl b) CCl4 c) CCl3 d) C2Cl e) C3Cl2
3. Double bonds in molecules: (พันธะคู่
มีความหมายตรงกับข้อใด)
a) occur
in atoms having two valence electrons. (เกิดขึ้นกับอะตอมที่มีเวเลนซ์อิเล็กตรอนเท่ากับ
2)
b) involve sharing two electrons.
(ใช้อิเล็กตรอนร่วมกัน
2 ตัว)
c) must
be ionic. (เป็นสารไอออนิก)
d)
involve sharing four electrons. (ใช้อิเล็กตรอนร่วมกัน
4 ตัว)
e) occur in polyatomic ions. (ต้องอยู่ในไอออนที่เป็นกลุ่มอะตอม)
3. Consider the following elements and select the one which has the largest
number of electrons shown in an
electron dot symbol. Cl
Mg Ga S Si
(จงพิจารณาว่าธาตุใดต่อไปนี้เมื่อเขียนสูตรแสดงอิเล็กตรอนด้วยจุดแล้ว ธาตุใดมีจุดมากที่สุด)
a) Mg b) Cl c) Ga d) Si e) S
4. Which
of the following is an acceptable Lewis structure for NH2NH2? (Ans.III) (โครงสร้างแบบลิวอิสของ
NH2NH2 ที่ยอมรับได้ เป็นดังข้อใด)
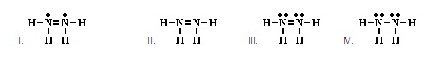
5.
Which of the following is an acceptable
Lewis structure for HOOH? (Ans.III) (โครงสร้างแบบลิวอิสของ
HOOH ที่ยอมรับได้เป็น ดังข้อใด)
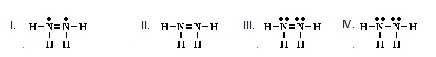
6. Which of the following is an acceptable Lewis
structure for CH3SH?
(Ans.III) (โครงสร้างแบบลิวอิสของ
CH3SH ที่ยอมรับได้เป็นดังข้อใด)
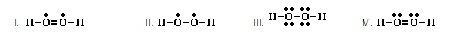
7. Which of the following is the correct Lewis
structure for CS2? (Ans.V) (โครงสร้างแบบลิวอิสของ CS2 ที่ยอมรับ
ได้เป็นดังข้อใด)
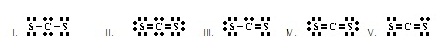
8.
Which of the
following is an acceptable Lewis structure for H2CO? (Ans.IV) (โครงสร้างแบบลิวอิสของ H2CO
ที่ยอมรับได้เป็นดัง ข้อใด)
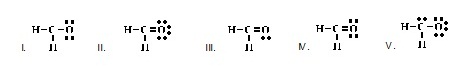
9.
Which of the following is an acceptable Lewis structure for HNNH? (Ans.I) (โครงสร้างแบบลิวอิสของ HNNH
ที่ยอมรับได้เป็นดังข้อใด)
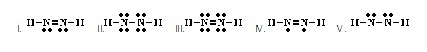
10.
Which of the
following is an acceptable Lewis structure for HCN? (Ans.III) (โครงสร้างแบบลิวอิสของ HCN
ที่ยอมรับได้เป็นดังข้อใด)
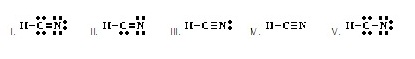
11. Which of the following is an acceptable Lewis
structure for C2H2? (Ans.IV) (โครงสร้างแบบลิวอิสของ C2H2
ที่ยอมรับได้เป็นดังข้อใด)
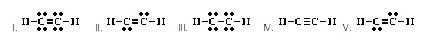
12. Which of the following is an acceptable Lewis
structure for CO? (Ans.II) (โครงสร้างแบบลิวอิสของ CO ที่
ยอมรับได้เป็นดังข้อใด)
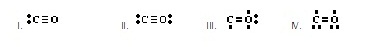
13.
Indicate the # of VALENCE electrons for
each species. Write the correct Lewis
electron-dot structure for each.
(จงบอกจำนวนเวเลนซ์อิเล็กตรอนทั้งหมดของสารแต่ละชนิดตามที่ที่กำหนด และเขียนสูตรโครงสร้างลิวอิสด้วย)
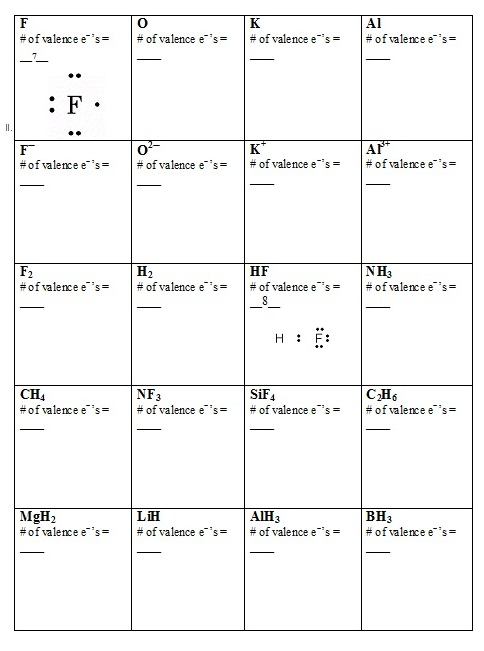
รูปภาพที่เกี่ยวข้อง

Size : 32.31 KBs
Upload : 2014-08-07 22:02:56
|
|
ต้องการให้คะแนนบทความนี้่ ?
|
 
สถานะ : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|