ปริมาณสารสัมพันธ์ ตอนที่ 9/2 การคำนวณจากสมการขั้นตอนเดียวที่เกิดขึ้นโดยสมบูรณ์
การคำนวณปริมาณสารจากสมการเคมี
การเกิดปฏิกิริยาเคมีเป็นไปได้หลายลักษณะ โดยอาจเป็นปฏิกิริยาที่เกิดขึ้นเพียงขั้นตอนเดียว หรือหลายขั้นตอน บางครั้งเกิดขึ้นอย่างสมบูรณ์ บางครั้งเกิดไม่สมบูรณ์
นอกจากนั้นยังต้องคำนึงถึงผลได้ของปฏิกิริยาด้วย การคำนวณปริมาณสารจากสมการเคมีมีความสำคัญอย่างยิ่งทั้งต่อการเรียนรู้เคมีในขั้นต่อไปและในธุรกิจอุตสาหกรรมเคมี
รูปแบบของการเกิดปฏิกิริยาที่พบได้มากมี 4 ลักษณะ ดังนี้
- ปฏิกิริยาขั้นตอนเดียวที่เกิดขึ้นอย่างสมบูรณ์
- ปฏิกิริยาขั้นตอนเดียวแต่เกิดขึ้นไม่สมบูรณ์
- ปฏิกิริยามากกว่า 1 ปฏิกิริยาแต่เกิดขึ้นอย่างอิสระ
- ปฏิกิริยามากกว่า 1 ปฏิกิริยาแบบต่อเนื่องกัน
ปฏิกิริยาขั้นตอนเดียวที่เกิดขึ้นอย่างสมบูรณ์
ปฏิกิริยาลักษณะนี้จะประกอบด้วยสมการเคมีเพียง 1 สมการ โดยมีสารตั้งต้นทุกชนิดอยู่ในปริมาณที่ทำปฏิกิริยากันได้พอดี คือเมื่อปฏิกิริยาสิ้นสุดแล้ว
จะไม่มีสารตั้งต้นชนิดใดเหลืออยู่เลย สารตั้งต้นทั้งหมดเปลี่ยนไปเป็นผลิตภัณฑ์ เช่น 2H2(s) + O2(g) → 2H2O(g) เมื่อปฏิกิริยาเกิดขึ้นอย่างสมบูรณ์
ความสัมพันธ์ของประมาณสารต่าง ๆ ในปฏิกิริยาเป็นดังนี้
|
|
2H2(s)
|
+
|
O2(g)
|
→
|
2H2O(g)
|
|
จำนวนโมล
|
2
|
+
|
1
|
→
|
2
|
|
อัตราส่วนโดยจำนวนโมลระหว่าง H2 : O2 : H2O = 2 : 1 : 2
|
|
จำนวนโมเลกุล
|
2 x 6.02 x 1023
|
+
|
6.02 x 1023
|
|
2 x 6.02 x 1023
|
|
อัตราส่วนโดยจำนวนโมเลกุลระหว่าง H2 : O2 : H2O = 2 : 1 : 2
|
|
มวล (กรัม)
|
4 g
|
+
|
32 g
|
→
|
36 g
|
|
อัตราส่วนโดยมวล (กฎสัดส่วนคงที่)ระหว่าง H2 : O2 : H2O = 1 : 8 : 9
|
|
ปริมาตรที่ STP
(dm3)
|
2 x 22.4 dm3
44.8 dm3
|
+
|
22.4 dm3
22.4 dm3
|
→
|
2 x 22.4 dm3
44.8 dm3
|
|
อัตราส่วนโดยปริมาตรที่ STP ระหว่าง H2 : O2 : H2O = 2 :1 : 2
|
ความหมายของสมการเคมี
สมการเคมีต่าง ๆ จะบอกให้เราทราบความสัมพันธ์ระหว่างปริมาณสารต่าง ๆ ในปฏิกิริยานั้น ๆ จากปฎิกิริยาดังตัวอย่าง 2H2(s) + O2(g) → 2H2O(g)
เราสามารถกล่าวถึงความสัมพันธ์ระหว่างปริมาณสารต่าง ๆ ได้หลายลักษณะ ดังนี้
- ก๊าซ H2 จำนวน 2 โมล ทำปฏิกิริยาพอดีกับก๊าซ O2 จำนวน 1 โมล
- จำนวนโมลของก๊าซ H2 ที่ใช้ในการทำปฏิกิริยานี้จะเป็น 2 เท่าของจำนวนโมลของก๊าซ O2 เสมอ ไม่ว่าจะใช้ในปริมาณมากหรือน้อยเท่าไร
- จำนวนโมลของก๊าซ O2ที่ใช้จะเป็นครึ่งหนึ่งของ H2 เสมอ ไม่ว่าจะใช้ปริมาณมากหรือน้อยเท่าไร
- ถ้าคิดเป็นน้ำหนัก ก็จะใช้ H2 จำนวน 4 กรัม ทำปฏิกิริยาพอดีกับ O2 หนัก 32 กรัม หรือคิดเป็นอัตราส่วน 1 : 8 เสมอ
- หรือกล่าวว่าน้ำหนักของ H ที่ใช้ = ของน้ำหนักของ O2
- หรือกล่าวว่าน้ำหนักของ O2 ที่ใช้จะเป็น 8 เท่าของน้ำหนัก H2 เสมอ
- ถ้าคิดเป็นจำนวนโมเลกุล ก็จะใช้ H2 จำนวน 2x6.02x1023 โมเลกุล ในการทำปฏิกิริยาพอดีกับ O2 จำนวน 6.02 x 1023 โมเลกุล
- ถ้าคิดเป็นปริมาตรของก๊าซที่ STP ก็จะใช้ H2 ปริมาตร 2x22.4 dm3 ทำปฏิกิริยาพอดีกับ O2 จำนวน 22.4 dm3
- ถ้าใช้ H2 จำนวน 2 โมล จะได้ H2O จำนวน 2 โมล
- จำนวนโมลของ H2 ที่ใช้จะ เท่ากับจำนวนโมลของ H2O ที่ได้
- ใช้ H2 จำนวน 4 กรัม จะได้ H2O จำนวน 36 กรัม
- ถ้าใช้ O2 จำนวน 1 โมล จะได้ H2O จำนวน 2 โมล
- จำนวนโมลของน้ำที่ได้จะเป็น 2 เท่าของจำนวนโมลของ O2 ที่ใช้
- จำนวนโมลของ O2 ที่ใช้จะเป็นครึ่งหนึ่งของจำนวนโมลของน้ำที่ได้
- อื่น ๆ .....
***ปริมาณสารที่ใช้ในปฏิกิริยาต่าง ๆ จะใช้มากขึ้นหรือน้อยลงกว่าจำนวนโมลที่แสดงอยู่ในสมการเคมีก็ได้ แต่เมื่อเพิ่มหรือลดปริมาณของสารใด สารอื่น ๆ
ก็จะเพิ่มขึ้นหรือลดลงเป็นอัตราส่วนตามจำนวนโมลของแต่ละสารที่แสดงอยู่ในสมการเคมีนั้น ๆ ที่ดุลแล้ว เนื่องจากการเกิดปฏิกิริยาย่อมเป็นไปตามกฎสัดส่วนคงที่
(คลิ้ก เพื่อชมแอนิเมชันแสดงองค์ประกอบของสมการเคมี)
(คลิ้ก เพื่อชมแอนิเมชันแสดงความสัมพันธ์ระหว่างปริมาณสารในสมการเคมี)
(คลิ้ก เพื่อชมแอนิเมชันแสดงปริมาณสารในรูปแบบต่าง ๆ ในสมการเคมี)
(คลิ้ก เเพื่อชมแอนิเมชันแสดงปริมาณสาร mol , molar mass ในสมการเคมี)
ตัวอย่าง จากสมการเคมี Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g) จะต้องใช้ Zn หนักกี่กรัม ในการเตรียม แก๊ส H2 จำนวน 6.9 dm3 ที่ STP (Zn = 65)
1. 13.3 2. 14.5 3. 18.6 4. 19.5
วิธีทำ ก่อนอื่นต้องติจารณาให้เข้าใจก่อนว่าโจทย์ต้องการทราบสิ่งใด และโจทย์กำหนดสิ่งใดมาให้ ในที่นี้โจทย์ต้องการทราบน้ำหนักของ Zn ว่าจะต้องใช้กี่กรัม โดยกำหนดปริมาตร
H2 ที่ต้องการที่ STP มาให้ กลับไปดูที่สมการเคมีจะเห็นความสัมพันธ์ระหว่างสิ่งที่โจทย์ต้องการทราบกับสิ่งที่โจทย์กำหนดมาให้ ดังนี้
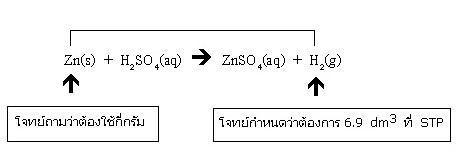
พิจารณาจากสมการเคมีก็จะเห็นว่าสิ่งที่โจทย์กำหนดกับสิ่งที่โจทย์ถามมีจำนวนโมลเท่ากัน การคิดคำนวณควรเริ่มจากเปลี่ยนปริมาตร H2 ที่โจทย์กำหนดมาให้ให้เป็นจำนวนโมล
ได้เท่าไรก็หมายความว่า Zn ที่จะต้องใช้ก็มีจำนวนโมลเท่ากัน แล้วเปลี่ยนจำนวนโมลของ Zn ให้เป็นกรัมก็จะได้คำตอบ
โจทย์กำหนดว่าต้องการ H2 จำนวน 6.9 dm3 ที่ STP ซึ่งคิดเป็นจำนวนโมล
ถ้า H2 มีปริมาตร 22.4 dm3 ที่ STP มีจำนวนโมล = 1 โมล
ถ้า H2 มีปริมาตร 6.9 dm3 ที่ STP มีจำนวนโมล = 1 x 6.9 / 22.4 โมล
= 0.30 โมล
จากสมการ จำนวนโมลของ Zn ที่ใช้ = จำนวนโมลของ H2 ที่ได้
เพราะฉะนั้นจะต้องใช้จำนวนโมลของ Zn = 0.3 โมล
คิดเป็นน้ำหนักของ Zn ดังนี้
ถ้ามี Zn จำนวน 1 โมล จะมีน้ำหนัก = 65 กรัม
ถ้ามี Zn จำนวน 0.3 โมล จะมีน้ำหนัก = 65 x 0.3
= 19.5 กรัม ตอบ
ใช้สูตร

(คลิ้ก ทำแบบฝึกหัดจากแอนิเมชัน)
แบบฝึกหัด
1. ปฏิกิริยาการเผาไหม้ของแก๊สอีเทนเป็นดังนี้ 2C2H6(g) + 7O2(g) → 4CO2(g) + 6H2O(g)
ข้อความใดต่อไปนี้ถูกต้องที่สุด
1. การเผาไหม้ของ C2H6 จำนวน 1 dm3 ที่ STP จะต้องใช้ O2 3.5 dm3 ที่ STP
2. ปริมาตรของ C2H6 และ O2 รวมกันจะเท่ากับปริมาตรของ CO2 และ H2O ที่เกิดขึ้น
3. การเผาไหม้ของ C2H6 จำนวน 1 โมล จะเกิด CO2 22.4 dm3 ที่ STP
4. การเผาไหม้ของ C2H6 จำนวน 10 กรัม จะเกิด H2O 18.3 กรัม
2. จากสมการเคมี Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g) จะต้องใช้ Zn หนักกี่กรัม ในการเตรียม แก๊ส H2 จำนวน 6.9 dm3 ที่ STP (Zn = 65)
1. 13.3 2. 14.5 3. 18.6 4. 19.5
3. แก๊สอะซิติลีน (C2H2) เตรียมได้จากแคลเซียมคาร์ไบน์ (CaC2) ทำปฏิกิริยากับน้ำ ดังสมการ
CaC2(s) + 2H2O → Ca(OH)2(aq) + C2H2(g)
ถ้าใช้ CaC2 จำนวน 1 กรัม จะได้แก๊ส C2H2 กี่ cm3 ที่ STP
1. 0.35 2. 3.5 3. 35 4. 350
4. ถ้าต้องการเตรียมแก๊สคลอรีน 33.6 dm3 ที่ STP จากปฏิกิริยาดังสมการ
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
อยากทราบว่าจะต้องใช้สารละลายกรด HCl ความเข้มข้น 12M อย่างน้อยกี่ cm3
1. 125 2. 200 3. 250 4. 400
5. การเผาแนพทาลีนในอากาศเกิดปฏิกิริยาดังนี้ C10H8 + O2 → CO2 + H2O
ถ้าใช้แนพทาลีน 4 กรัม จะต้องใช้ออกซิเจนอย่างน้อยกี่ dm3 ที่ STP จึงจะทำปฏิกิริยาได้หมดพอดี
1. 2.44 dm3 2. 4.20 dm3 3. 8.40 dm3 4. 16.80 dm3
6. ถ้าเผา KMnO4 จะเกิด O2 MnO2 และ K2O ถ้าต้องการเตรียมก๊าซ O2 จำนวน 67.2 dm3 ที่ STP จะต้อง
ใช้ KMnO4 อย่างน้อยกี่กรัม (K=39 Mn=55.5 O=16)
1. 158.5 2. 317.0 3. 475.5 4. 634.0
7. จากปฏิกิริยาต่อไปนี้ ; BaCl2(aq) + AgNO3(aq) → Ba(NO3)2 + AgCl(s)
ถ้ามีตะกอน AgCl เกิดขึ้น 71.75 กรัม จะต้องใช้สารละลาย BaCl2 ซึ่งมีความเข้มข้น 0.5 mol/dm3 จำนวน กี่ cm3 (Ag=108 Ba=137 Cl=35.5)
1. 250 2. 500 3. 750 4. 1,000
8. เมื่อนำโพแทสเซียมเปอร์แมงกาเนตทำปฏิกิริยากับกรดไฮโดรคลอริกดังสมการ
2KMnO4 + 16HCl → 2KCl + 2MnCl2 + 8H2O + 5Cl2
ใช้สารละลายกรดไฮโดรคลอริกความเข้มข้น 8 mol/dm3 จำนวน 10 cm3 จะต้องใช้ KMnO4 กี่กรัม
(K=38 Mn=55 )
1. 0.58 2. 1.58 3. 2.58 4. 3.58
9. แก๊ส Cl2 ที่เกิดขึ้นในข้อ 8 มีน้ำหนักกี่กรัม
1. 1.7 2. 1.50 3. 1.77 4. 2.13
10. ปฏิกิริยาระหว่างสารละลายแบเรียมไฮดรอกไซด์ Ba(OH)2 ความเข้มข้น 0.05 mol/dm3 จำนวน 30 cm3 กับ สารละลายกรดฟอสฟอริก H3PO4 ความเข้มข้น 0.25 mol/dm3 ดังสมการ จะต้องใช้สารละลายกรดฟอสฟอริกกี่ cm3
Ba(OH)2 + H3PO4 → Ba3(PO4)2 + H2O
1. 0.4 2. 4.0 3. 8.0 4. 12.0
11. เมื่อโลหะโซเดียมทำปฏิกิริยากับน้ำเกิดสารละลาย 500 cm3 ขณะเดียวกันมีก๊าซไฮโดรเจนเกิดขึ้น 33.6 dm3 ที่ STP จงหาความเข้มข้นของสารละลาย NaOH ที่เกิดขึ้น
1. 3.0 mol/dm3 2. 6.0 mol/dm3 3. 1.5 mol/dm3 4. 5.6 mol/dm3
12. ไอร์ออน (II) ซัลไฟด์ (FeS) เมื่อเผาในอากาศจะเปลี่ยนเป็น ไอร์ออน(III)ออกไซด์ (Fe2O3) กับซัลเฟอร์ไดออกไซด์ (SO2) ถ้าใช้ FeS จำนวน 160 mg จะต้องใช้ก๊าซ O2 กี่ cm3 ที่ STP จึงจะทำปฏิกิริยาได้พอดี (Fe=56 S=32 O=16)
1. 54 2. 63 3. 67 4. 71
13. NaOH สามารถเตรียมได้จากปฏิกิริยาระหว่าง Na2CO3 กับ Ca(OH)2 ถ้าใช้ Na2CO3 1,000 กรัม ทำปฏิกิริยากับ Ca(OH)2 จนเกิดปฏิกิริยาอย่างสมบูรณ์จะเกิด NaOH กี่กรัม
1. 80 2. 160 3. 755 4. 1,325
14. ในการเตรียม Na2SO4 โดยปฏิกิริยาระหว่าง NaOH ความเข้มข้น 0.30 mol/dm3 ให้ทำปฏิกิริยาพอดีกับสารละลาย H2SO4 ความเข้มข้น 0.17 mol/dm3 ปริมาตร 0.5 dm3 จะต้องใช้สารละลาย NaOH กี่ cm3
1. 85 2. 142 3. 283 4. 567
15. ยาลดกรดชนิดหนึ่งมี Mg(OH)2 อยู่ร้อยละ 29 โดยมวล/มวล นอกนั้นเป็นแป้ง ถ้ายานี้หนักเม็ดละ 0.2 กรัม จะต้องใช้ยากี่เม็ดจึงจะทำปฏิกิริยาพอดีกับสารละลาย HCl ความเข้มข้น 0.2 mol/dm3จำนวน 300 cm3
1. 20 2. 30 3. 40 4. 50
16. จากการทดลองพบว่าสารตัวอย่าง NaHCO3 มีมลทินปนอยู่ร้อยละ 20 โดยมวล หากนำสารนี้มา 1.05 กรัม ทำเป็นสารละลาย 100 cm3 แล้วนำไปทำปฏิกิริยากับสารละลาย HCl ความเข้มข้น 0.2 mol/dm3 จะต้องใช้สารละลาย HCl จำนวนกี่ cm3 ในการทำปฏิกิริยาพอดีกับ NaHCO3 ดังกล่าว
1. 100 2. 75 3. 50 4. 25
17. สังกะสีไม่บริสุทธิ์มีน้ำหนัก 5.10 กรัม เมื่อเติมกรดไฮโดรคลอริกลงไปทำให้เกิดปฏิกิริยาได้ก๊าซไฮโดรเจนจำนวน 1.62 x 103 cm3 ที่ STP อยากทราบว่าสังกะสีดังกล่าวมีความบริสุทธิ์ร้อยละเท่าไร (Zn=65)
1. 69 2. 74 3. 85 4. 92
18. เมื่อนำแร่เหล็กตัวอย่างหนัก 500 กรัม มาละลายในกรด ทำให้เหล็กทั้งหมดแตกตัวเป็น Fe3+ จากนั้นเติมสารละลาย KI ทำให้เกิดปฏิกิริยามี I2 เกิดขึ้น 2 mol จงหาร้อยละโดยมวลของเหล็กในแร่ตัวอย่าง ปฏิกิริยาที่เกิดขึ้นคือ Fe3+ + I- → Fe2+ + I2 ; (Fe=56)
1. 11 2. 22 3. 33 4. 44
19. ในการแยกโลหะเงินออกจากสารละลายของน้ำทิ้งซึ่งมี AgNO3 ละลายอยู่ โดยเติมสารละลาย BaCl2 ความเข้มข้น 0.5 mol/dm3 จนเกิดตะกอนของ AgCl อย่างสมบูรณ์ ปรากฏว่าต้องใช้สารละลาย BaCl2 จำนวน 24 cm3 อยากทราบว่าตะกอนที่ได้จะมี Ag อยู่กี่กรัม (Ag=108 Ba=137)
1. 1.30 2. 2.59 3. 3.44 4. 2.59
20. สาร A ปะกอบด้วยฟอสฟอรัสและคลอรีน นำสาร A 13.75 กรัม ไปทำปฏิกิริยากับน้ำจนปฏิกิริยาสิ้นสุด ได้กรดฟอสฟอริก 9.8 กรัม และกรดไฮโดรคลอริก 10.95 กรัม สาร A ประกอบคลอรีนร้อยละเท่าไรโดยมวล (P=31 Cl=35.5)
1. 22.5 2. 25.8 3. 29.3 4. 77.5
21. จากปฏิกิริยาดังสมการ ; 2MCln + nH2SO4 → M2(SO4)2 + 2nHCl(g)
ถ้า M คือโลหะที่มีมวลอะตอม 30 ถ้าใช้สารประกอบ MCln หนัก 3.44 กรัม ในการทำปฏิกิริยา จะได้ แก๊สๆไฮโดรเจนคลอไรด์หนัก 2.92 กรัม ค่า n จะเป็นเท่าไร
1. 1 2. 2 3. 3 4. 4
22. เผา CaCO3 จำนวน 60 กรัม สลายตัวได้แก๊สหนัก 22 กรัม เหลือของแข็ง 38 กรัม ข้อสรุปใดถูกต้อง
1. CaCO3 สลายตัวไปน้อยกว่าร้อยละ 70 โดยมวล
2. ของแข็งที่ได้คิดเป็นร้อยละ 51 โดยมวลของของแข็งที่เหลือทั้งหมด
3. ของแข็งกับแก๊สที่เกิดขึ้นที่เกิดขึ้นมีอัตราส่วนโดยมวลเท่ากับ 1:1
4. ของแข็งที่เหลือทั้งหมดมีสารตั้งต้น : ของแข็งที่ได้ = 1:2.8
23. เมื่อเผาสังกะสีบริสุทธิ์ 6.5 กรัม ในบรรยากาศที่มีออกซิเจนมากเกินพอ จะได้ออกไซด์ของสังกะสี 8.1 กรัม อยากทราบว่าถ้าเผาสังกะสีหนัก 13. กรัม จะต้องใช้ปริมาณของออกซิเจนดังข้อใดจึงจะเกิดปฏิกิริยาอย่างสมบูรณ์ (Zn = 65)
1. 0.25 mol 2. 22.4 dm3 ที่ STP 3. 16 g 4. 6.02 x 1022 โมเลกุล
เฉลย
1.4 2.4 3.4 4.4 5.3 6.4 7.2 8.2 9.4 10.2 11.2
12.4 13.3 14.4 15.2 16.3 17.4 18.2 19.4 20.3 21.4 22.4
23.4
Appendix
1. Which statement is false for the balanced equation given below? (Atomic weights: C = 12.01, Cl = 35.45, H = 1.008). (Ans.e) ; (จากสมการเคมีที่ดุลแล้วดังต่อไปนี้ การบอกความหมายของสมการในข้อใดผิด)
CH4 + 4 Cl2 → CCl4 + 4 HCl
a) One mole of CH4 will produce 153.8 g of CCl4 (ใช้ CH4 1 โมล จะได้ CCl4 153.8 g)
b) Two molecules of CH4 react with eight molecules of Cl2
(CH4 2 โมเลกุล ทำปฏิกิริยาพอดีกับ Cl2 8 โมเลกุล)
c) One mole of Cl2 will produce one mole of HCl
(ถ้าใช้ Cl2 1 โมล จะได้ HCl 1 โมล)
d) The reaction of 70.9 g of Cl2 will produce 0.250 moles of CCl4
(ถ้าใช้ Cl2 70.9 g จะได้ CCl4 0.250 moles)
e) 141.8 g of Cl2 will react with 16 g of CH4
(Cl2 141.8 กรัม ทำปฏิกิริยาพอดีกับ CH4 16 g)
2. Which statement is false for the balanced equation given below? (Atomic weights: H = 1.008, S = 32.06, O = 16.00). (Ans.e) (จากสมการเคมีที่ดุลแล้วดังต่อไปนี้ การบอกความหมายของสมการในข้อใดผิด)
2 H2S + SO2 → 3 S + 2 H2O
a) The reaction of 32 g of SO2 will produce 1.5 moles of sulfur
(ถ้าใช้ SO2 32 กรัม จะได้ซัลเฟอร์ 1.5 โมล)
b) Two moles of H2S requires one mole of sulfur dioxide
(H2S 2 โมล ทำปฏิกิริยาพอดีกับ SO2 1 โมล)
c) The reaction of 2 molecules of H2S will produce three atoms of sulfur
(ถ้าใช้ H2S 2 โมเลกุล จะได้กำมะถัน 3 อะตอม)
d) The reaction of 64 g of SO2 will produce two moles of water
(ถ้าใช้ SO2 64 กรัม จะมีน้ำเกิดขึ้น 2 โมล)
e) The reaction of 34 g of H2S requires 64 g of sulfur dioxide
(ถ้าใช้ H2S 34 กรัม จะต้องใช้ SO2 64 กรัม)
3. Which statement is false for the balanced equation given below? (Atomic weights: H = 1.008, O = 16.00). (Ans.e) ; (จากสมการที่ดุลแล้วต่อไปนี้ การกล่าวถึงความหมายของสมการในข้อใดผิด)
2 H2 + O2→ 2 H2O
a) The reaction of one mole of O2 will produce 36.0 g of water
(ถ้าใช้ O2 1 โมล จะมีน้ำเกิดขึ้น 36 กรัม)
b) Ten molecules of O2 require 20 molecules of H2
(ออกซิเจน , O2 10 โมเลกุล ทำปฏิกิริยาพอดีกับ H2 20 โมเลกุล)
c) The reaction of 2.0 g of H2 requires 16.0 g of O2
(H2 2.0 กรัม ทำปฏิกิริยาพอดีกับ O2 16.0 กรัม)
d) One mole of O2 will produce two moles of water
(ถ้าใช้ O2 1 โมล จะได้น้ำ 2 โมล)
e) The reaction of 16.0 g of O2 will produce two moles of water
(ถ้าใช้ O2 16 กรัม จะได้น้ำ 2 โมล)
4. Which of the following setups is correct to calculate the number of moles of Cl2
required to produce 6 moles of PCl5 according to the following equation? (Ans.c) ;
(จากสมการต่อไปนี้ ถ้าต้องการหาจำนวนโมลของ Cl2 เพื่อใช้ในการผลิต PCl5 จำนวน 6 โมล จะคิดได้จากข้อใด)
10 Cl2 + P4 → 4 PCl5
a) 6 moles PCl3 x 4 moles PCl5/10 moles Cl2
b) 6 moles PCl3 x 4 moles Cl2/10 moles PCl5
c) 6 moles PCl3 x 10 moles Cl2/4 moles PCl5
d) 6 moles PCl3 x 10 moles PCl5/4 moles Cl2
5. Which of the following setups is correct to calculate the number of moles of oxygen required to
produce 5 moles of SO2 according to the following equation? (Ans.c); (จากสมการต่อไปนี้ ถ้าต้องการหา
จำนวนโมลของ ออกซิเจน เพื่อใช้ในการผลิต SO2 จำนวน 5 โมล จะคิดได้จากข้อใด)
CS2 + 3 O2 CO2 + 2 SO2
a) 5 moles SO2 x 2 moles SO2/3 moles O2
b) 5 moles SO2 x 2 moles O2/3 moles SO2
c) 5 moles SO2 x 3 moles O2/2 moles SO2
d) 5 moles SO2 x 3 moles SO2/2 moles O2
6. Which of the following setups is correct to calculate the number of moles of N2 required to produce 4 moles
of N2H4 according to the following equation? (Ans.c); (จากสมการต่อไปนี้ ถ้าต้องการหาจำนวนโมลของ N2 เพื่อใช้ในการผลิต

Size : 20.34 KBs
Upload : 2013-08-06 05:44:20
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|