ปริมาณสารสัมพันธ์ ตอนที่ 5 ความเข้มข้น โมล/ลิตร
4. โมล/ลิตร ,mol/l หรือ โมล/ลูกบาศก์เดซิเมตร, mol/dm3หรือ โมลาริตี , molarity หรือ โมลาร์ ,molar, M
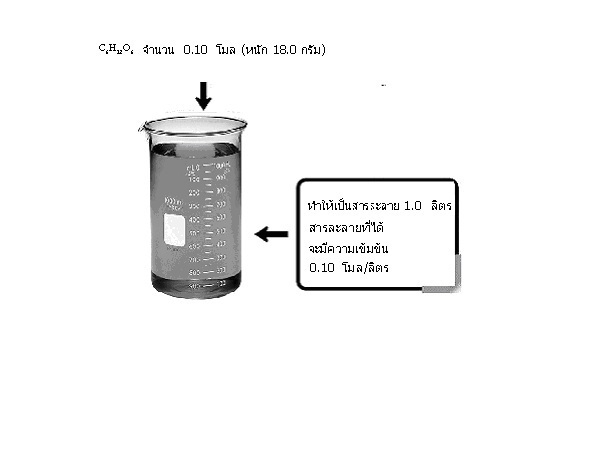
ความเข้มข้นชนิดนี้มีการนำไปใช้อย่างกว้างขวาง มีลักษณะเป็นการบอกจำนวนโมลของตัวละลาย ที่มีอยู่ในสารละลาย 1.0 ลิตร หรือ 1.0 dm3 หรือ 1,000 cm3 เช่น ใช้ C6H12O6 จำนวน 0.10 โมล (หนัก 18.0 กรัม) ทำให้เป็นสารละลาย 1.0 ลิตร สารละลายที่ได้จะมีความเข้มข้น 0.10 โมล/ลิตร ดังรูป
ตัวอย่าง น้ำตาลกลูโคส (C6H12O6) หนัก 18.0 กรัม ทำให้เป็นสารละลาย 200 cm3 สารละลายที่ได้จะมีความเข้มข้นกี่โมล/ลิตร
วิธีทำ นำนวนโมลของ C6H12O6 ; n = W/M =18/C6H12O6 = 18/180 = 0.10 mol
สารละลาย 200 cm3 มี C6H12O6 ละลายอยู่ 0.10 mol
สารละลาย 1,000 cm3 มี C6H12O6 ละลายอยู่ = .050 mol
ความเข้มข้อนของสารละลาย = 0.50 โมล/ลิตร ตอบ
ใช้สูตร กำหนดตัวแปรดังนี้
n = จำนวนโมล
V = ปริมาตรของสารละลาย (cm3)
C = ความเข้มข้นของสารละลาย , โมล/ลิตร
สูตร n = VC/1000
* ถ้า V ใช้หน่วยเป็น dm3 หรือ L ; n = VC
** ถ้า n คงที่ ; n = N/6.02 x 1023 = W/M = VC/1000 (V เป็น cm3) = VC (V เป็น dm3)
จากตัวอย่าง ; n = VC/1000
0.1 = 200C/1000
C = 0.1x1000/200
= 0.50 โมล/ลิตร ตอบ
** ถ้าคิดจาก V เป็น dm3
n = VC
0.1 mol = 0.2 dm3 C
C = 0.1/0.2 = 0.50 mol/dm3 ตอบ
- ความเข้มข้นในหน่วยโมล/ลิตร กับความเข้มข้นในหน่วยร้อยละโดยมวลมีความสัมพันธ์กัน คือถ้าทราบความเข้มข้นในหน่วยร้อยละโดยมวลพร้อมกับความหนาแน่น จะเปลี่ยนเป็นความเข้มข้นโมล/ลิตร ได้
ตัวอย่าง สารละลาย C6H12O6 ความเข้มข้นร้อยละ 10 โดยมวล มีความหนาแน่น 1.10 g/cm3 คิดเป็นความเข้มข้นกี่โมล/ลิตร
วิธีทำ สารละลายมีความหนาแน่น 1.10 g/cm3
สารละลาย 1 cm3 หนัก 1.10 กรัม
สารละลาย 1,000 cm3 หนัก = 1,100 กรัม
สารละลายมีความเข้มข้นร้อยละ 10 โดยมวล
สารละลาย 100 กรัม มี C6H12O6 ละลายอยู่ 10 กรัม
สารละลาย 1,100 กรัม มี C6H12O6 ละลายอยู่ = 110 กรัม
คิดเป็นจำนวนโมลของกลูโคส ; n = W/M = 110/180
= 0.61 โมล
สารละลายนี้มีความเข้มข้น 0.61 โมล/ลิตร ตอบ
- ความเข้มข้นในหน่วยโมล/ลิตร กับความเข้มข้นในหน่วยร้อยละโดยมวล/ปริมาตร มีความสัมพันธ์กัน คือถ้าทราบร้อยละโดยมวล/ปริมาตร สามารถเปลี่ยนให้เป็นโมล/ลิตรได้ทันที
ตัวอย่าง สารละลาย C6H12O6 ความเข้มข้นร้อยละ 10 โดยมวล/ปริมาตร คิดเป็นความเข้มข้นกี่โมล/ลิตร
ความเข้มข้นร้อยละ 10 โดยมวล/ปริมาตร
สารละลาย 100 cm3 มี C6H12O6 ละลายอยู่ 10 กรัม
สารละลาย 1,000 cm3 มี C6H12O6 ละลายอยู่ = 1,000 กรัม
คิดเป็นจำนวนโมลของกลูโคส ; n = W/M = 1,000/180
= 5.56 โมล
สารละลายนี้มีความเข้มข้น 5.56 โมล/ลิตร ตอบ
แบบฝึกหัด
1. ในสารละลาย 350.00 cm3 มีโซเดียมคลอไรด์ ( NaCl )ละลายอยู่ 10.50 กรัม จะมีความเข้มข้นกี่โมล/ลิตร (Na=23 Cl=35.5)
2. สารละลาย 125.00 cm3 มีลิเทียมคลอเรต , LiClO4.3H2O ละลายอยู่ 40.70 กรัม สารละลายจะมีความเข้มข้นกี่โมล/ลิตร (Li=7 Cl=35.5 O=16 H=1)
3. สารละลาย 0.355 dm3 มีแมกนีเซียมโบรไมด์ , MgBr2 ละลายอยู่ 25.00 กรัม จะมีความเข้มข้นกี่โมล/ลิตร (Mg=24 Br=80)
4. สารละลาย 185.00 cm3 มีแมงกานีส (II) ไนเตรต , Mn(NO3)2.2H2O ละลายอยู่ 5.66 กรัม จะมีความเข้มข้นกี่โมล/ลิตร (Mn=55 N=14 O=16)
5. จงคำนวณหาความเข้มข้นในหน่วย molarity ของสารละลายต่อไปนี้ (Li=7 O=16 S=32 Na=23 C=12 H=1)
5.1 Li2SO3 จำนวน 4.67 mole ในสารละลายที่มีปริมาตร 2.04 ลิตร
5.2 Li2SO3 จำนวน 0.629 mole ในสารละลายที่มีปริมาตร 1.50 ลิตร
5.3 Na2CO3 จำนวน 4.783 g ในสารละลายที่มีปริมาตร 10.01 ลิตร
5.4 (NH4)2CO3 จำนวน 0.897 g ในสารละลายที่มีปริมาตร 250 cm3
6. จงคำนวณหาจำนวนโมลของตัวถูกละลายในสารละลายต่อไปนี้ (Cu=63.5 Mg=24 Pb=207)
6.1 สารละลาย Cu(NO3) ความเข้มข้น 22.0 M ปริมาตร 2.35 dm3
6.2 สารละลาย MgCO3 ความเข้มข้น 0.50 M ปริมาตร 3.00 dm3
6.3 สารละลาย Pb(NO3)2 ความเข้มข้น 0.415 M ปริมาตร 16.00 cm3
6.4 สารละลาย Na2O ความเข้มข้น 3.76 M ปริมาตร 6.20 cm3
7. จงคำนวณหามวล(กรัม)ของตัวละลายในสารละลายต่อไปนี้ ( K=39 Cl=35.5 Na=23 O=16 )
7.1 สารละลาย KCl ความเข้มข้น 1.00 โมล่าร์ ปริมาตร 0.500 dm3
7.2 สารละลาย Na2O ความเข้มข้น 3.76 โมล่าร์ ปริมาตร 6.02 dm3
8. จงคำนวณหาจำนวนโมลและมวล (กรัม) ของ NaCl ที่มีอยู่ในสารละลาย ซึ่งมีความเข้มข้น 0.20 M และมีปริมาตร100 cm3
9. สารละลาย NaOH เข้มข้น 0.25 M จำนวน 300 cm3 จะมี NaOH ละลายอยู่กี่กรัม (Na=23 O=16 H=1) (ตอบ 3.00 กรัม)
10. สารละลาย 575 cm3 มี NaCl ละลายอยู่ 9.25 กรัม จะมีความเข้มข้นกี่โมลาร์ (ตอบ 0.284 M )
11. สารละลาย NaCl ความเข้มข้น 5.32 % โดยมวล/มวล มีความหนาแน่น 1.10 g/cm3 คิดเป็นความเข้มข้นกี่โมล/ลิตร
12. สารละลาย H2SO4 เข้มข้น 10 % โดยมวล/มวล มีความหนาแน่น 1.07 g/cm3 จะมีความเข้มข้นกี่โมล่าร์ (H=1 O=16 S=16) (ตอบ 1.09 )
13. สารละลาย K2SO4 เข้มข้น 0.50 M จะมีความเข้มข้นร้อยละเท่าไรโดยมวล/ปริมาตร (ตอบ 8.70)
14. ก๊าซไฮโดรเจนคลอไรด์หนัก 1.46 กิโลกรัม นำไปละลายน้ำจนได้สารละลายกรดไฮโดรริก 10 dm3 สารละลายกรดนี้มีความเข้มข้นเท่าใด (Ent’23) (H=1 Cl=35.6)
1. 0.146 g/dm3 2. 14.6 % (โดยมวล/มวล) 3. 4 mol/dm3 4. .0.4 mol/dm3
15. น้ำส้มสายชูชนิดหนึ่ง มีความหนานแน่น 1.13 g/cm3 ระบุว่ามีกรดแอซีติกละลายอยู่ร้อยละ 8 โดยน้ำหนักน้ำส้มสายชูนี้จะมีความเข้มข้นคิดเป็นกี่ mol/dm3 (ENT’43)
1. 0.13 2. 1.33 3. 1.51 4. 7.1
16. ผ่านก๊าซ A ลงในน้ำจำนวนหนึ่ง ได้สารละลายกรด B ที่มีความเข้มข้นร้อยละ 30 โดยมวล และมีความหนาแน่น 1.10 กรัมต่อลูกบาศก์เซนติเมตร ถ้ามวลโมเลกุลของ B = 66 สารละลายกรด B มีความเข้มข้นกี่โมลต่อลูกบาศก์เดซิเมตร (ENT’37)
1. 5 2. 10 3. 20 4. 25
17. ของเหลวชนิดหนึ่งมีสูตรเป็น A3B มีความถ่วงจำเพาะ 1.50 (มวลอะตอมของA=33,B=21) เมื่อนำA3B 20 cm3 ผสมกับน้ำให้มีปริมาตรสุดท้ายเท่ากับ 500 cm3 สารละลายที่ได้จะมีความเข้มข้นกี่ mol/dm3 (ENT’26)
1. 2.00 2. 1.50 3. 1.00 4. 0.50
18. เมื่อเติมผลึก AgNO3 1.70 กรัมลงในสารละลาย AgNO3 0.10 mol/dm3 250 cm3 แล้วคนจนผลึกละลายหมดสารละลาย AgNO3 ใหม่ที่ได้จะมีความเข้มข้นกี่ mol/dm3 สมมติว่าปริมาตรของสารละลายคงที่ (ENT’26) (Ag=108 O=16 N=14)
1. 0.11 2. 0.14 3. 0.28 4. 0.44
19. (PAT.2 ต.ค.51) มีสารละลาย NaOH 500 cm3 ไม่ทราบความเข้มข้น เมื่อแบ่งสารละลาย NaOH นี้มา 100 cm3 เติมน้ำลงไป 300 cm3 ปรากฏว่าได้สารละลายเข้มข้น 0.10 โมล/ลิตร ถ้านำสารละลาย NaOH ที่เหลือทั้งหมดซึ่งไม่ทราบความเข้มข้นนี้ มาเติมน้ำลงไป 400 cm3 จะได้สารละลายเข้มข้นกี่โมล/ลิตร
1. 0.20 2. 0.30 3. 0.40 4. 0.50
20. Cow's milk contains 4.5 g of lactose (C12H22O11) per 0.100 L of milk. What is the molarity of lactose?
(Atomic weights: C = 12.01, H = 1.008, O = 16.00). (Ans.a); (ถ้าในน้ำนมจำนวน 0.100 ลิตร มีแลคโตสละลายอยู่ 4.5 กรัม คิดเป็นความเข้มข้นกี่โมล/ลิตร)
a) 0.13 b) 0.16 c) 0.045 d) 0.415 e) 1.3
21. Gatorade Thirst Quencher contains 0.14 g of Cl- in a 250 mL glass. What is the molarity of Cl-?
(Atomic weight: Cl = 35.45). (Ans.a); (เครื่องดื่มแก้กระหายน้ำ 250 mL มี Cl- ละลายอยู่ 0.14 g ความเข้มข้นของ Cl- เป็นกี่โมล/ลิตร)
a) 0.016 b) 0.32 c) 0.16 d) 0.56 e) 0.032
22. There are 10.0 g of calcium as Ca2+ in 1.0 L of milk. What is the molarity of calcium ions in milk?
(Atomic weight: Ca = 40.08). (Ans.a); (น้ำนม 1.0 L มี Ca2+ ละลายอยู่ 10.0 g ความเข้มข้นของ Ca2+ เป็นกี่โมล/ลิตร)
a) 0.25 b) 0.025 c) 0.50 d) 0.010 e) 0.10
23. The density of a 36.0% by weight aqueous solution of (NH4)2SO4 is 1.2077 g/cm3. What is the molarity of the compound? (Atomic weights: N = 14.01, S = 32.06, O = 16.00, H = 1.008). (Ans.a); (สารละลาย (NH4)2SO4 มีความเข้มข้น 36.0% โดยมวล มีความหนาแน่น 1.2077 g/cm3 คิดเป็นความเข้มข้นกี่โมล/ลิตร)
a) 3.29 b) 3.82 c) 3.60 d) 4.03 e) 4.24
24. The density of a 64.0% by weight aqueous solution of glycerol (C3H8O3) is 1.1663 g/cm3. What is the molarity of the compound? (Atomic weights: C = 12.01, H = 1.008, O = 16.00). (Ans.a); (สารละลาย glycerol (C3H8O3) มีความเข้มข้น 64.0% โดยมวล มีความหนาแน่น 1.1663 g/cm3 คิดเป็นความเข้มข้นกี่โมล/ลิตร)
a) 8.11 b) 8.62 c) 7.51 d) 8.41 e) 7.82
25. What is the molarity of HI in a solution that is 47.0% HI and has a density equal to 1.50 g/mL?
(Atomic weights: H = 1.008, I = 126.9). (Ans.a); (สารละลาย HI ความเข้มข้น 47.0% มีความหนาแน่น 1.50 g/mL คิดเป็นความเข้มข้นกี่โมล/ลิตร)
a) 5.51 b) 4.76 c) 5.85 d) 5.22 e) 5.00
26. Determine the number of moles of solute present in 275 mL of 0.5151 M KClO4.
(Atomic weights: Cl = 35.45, O = 16.00, K = 39.1). (Ans.c); (สารละลาย KClO4. ความเข้มข้น 0.5151 M จำนวน 275 mL มี KClO4 ละลายอยู่กี่โมล)
a) 0.112 b) 0.189 c) 0.142 d) 0.0922 e) 0.212
27. Determine the number of moles of solute present in 455 mL of 3.75 M HCl solution.
(Atomic weights: Cl = 35.45, H = 1.008). (Ans.c); (สารละลาย HCl ความเข้มข้น 3.75 M จำนวน 455 mL มี HCl ละลายอยู่กี่โมล)
a) 1.23 b) 1.56 c) 1.71 d) 1.98 e) 1.89
28. How many moles of glucose are contained in 500.0 mL of 0.30 M glucose, C6H12O6, used in intravenous injection? (Atomic weights: C = 12.01, H = 1.008, O = 16.00). (Ans.c); (สารละลายกลูโคสสำหรับฉีดเข้าทางเส้นเลือดดำ มีความเข้มข้นของ C6H12O6 0.30 M อยากทราบว่าในสารละลาย 500.0 mL มีกลูโคสละลายอยู่กี่โมล)
a) 0.60 b) 0.015 c) 0.15 d) 1.5 e) 0.060
29. How many grams of NaCN are in 100.0 mL of 3.8 x 10-5 M NaCN? (Atomic weights: Na = 22.99, N = 14.01, C = 12.01). (Ans.e); (สารละลาย NaCN ความเข้มข้น 3.8 x 10-5 M อยากทราบว่าในสารละลาย 100.0 mL จะมี NaCN ละลายอยู่กี่กรัม)
a) 3.8 x 10-5 b) 1.9 x 10-5 c) 2.6 x 10-6 d) 3.8 x 10-4 e) 1.9 x 10-4
30. How many grams of glucose are contained in 500.0 mL of 0.30 M glucose, C6H12O6, used in intravenous injection? (Atomic weights: C = 12.01, H = 1.008, O = 16.00). (ans.e) ; (สารละลายน้ำตาลกลูโคสที่ใช้ฉีดเข้าเส้นเลือดดำ มีความเข้มข้นของ C6H12O6 0.30 M อยากทราบว่าในสารละลาย 500.0 mL จะมีกลูโคสละลายอยู่กี่กรัม)
a) 2.7 b) 1.5 c) 0.15 d) 0.27 e) 27
31. The lowest limit of MgSO4 that can be detected by taste in drinking water is 0.400 g per liter. How many moles of MgSO4 is this per liter? (Atomic weights: Mg = 24.30, O = 16.00, S = 32.06). (Ans.e) ; (มาตรฐานของน้ำดื่มอนุญาตให้มี MgSO4 ได้ 0.400 กรัม/ลิตร อยากทราบว่าคิดเป็นกี่โมล/ลิตร)
a) 3.32 x 10-4 b) 3.01 x 10-6 c) 3.01 x 10-4 d) 3.32 x 10-2 e) 3.32 x 10-3
32. สารละลาย C6H12O6 กับสารละลาย NaCl มีความเข้มข้น 1 โมล/ลิตร เท่ากัน โดยมีน้ำเป็นตัวทำละลายเช่นเดียวกัน แต่มีรูปแบบของการละลายแตกต่างกันคือ
C6H12O6(s) C6H12O6(aq)
NaCl(s) Na+(aq) + Cl-(aq)
จงเปรียบเทียบอัตราส่วนระหว่าง จำนวนโมเลกุลของ C6H12O6 : จำนวนโมเลกุลของน้ำ
และอัตราส่วนระหว่าง จำนวนไอออน Na+ + Cl- : จำนวนโมเลกุลของน้ำ
Content's Picture

Size : 21.20 KBs
Upload : 2013-08-05 04:04:05
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|