ปริมาณสารสัมพันธ์ ตอนที่ 3 สูตรเคมี
สูตรเคมี (Chemical formula)
คือการนำสัญลักษณ์ของธาตุมาเขียนแทนสารเคมีต่าง ๆ เช่น C6H14 หมายถึง เฮกเซน สูตรเคมีจำแนกเป็น 3 ประเภท คือ สูตรโมเลกุล (molecular formula)
สูตรเอมพิริกัลหรือสูตรอย่างง่าย (empirical formula) และสูตรโครงสร้าง (structural formula)
สูตรโมเลกุล (molecular formula) เป็นการเขียนสูตรแสดงองค์ประกอบของธาตุต่าง ๆ ตามที่เป็นจริง
สูตรโมเลกุลของสารต่าง ๆ เช่น เฮกเซน ( C6H14) จะแสดงข้อมูลดังนี้
- บอกชนิดของธาตุที่เป็นส่วนประกอบอยู่ในโมเลกุลนั้น ๆ เช่น สูตรโมเลกุลของเฮกเซนคือ C6H14ทำให้ทราบว่าเฮกเซนประกอบด้วยธาตุ C และ H
- แสดงมวลโมเลกุล (molecular mass) และมวลต่อโมล (molar mass)
- แสดงอัตราส่วนของธาตุที่เป็นองค์ประกอบในรูปแบบต่าง ๆ ดังตาราง
|
สิ่งที่ทราบจากสูตรโมเลกุล C6H14
|
|
มวลโมเลกุล (molecula mass)
|
6C + 14H
(6x12) + (14x1)
72 + 14
86 amu.
|
|
มวลต่อโมล (molar mass)
|
86 g/mol
|
|
อัตราส่วนระหว่าง C:H โดยจำนวนโมล
|
6 : 14
|
|
อัตราส่วนระหว่าง C:H โดยจำนวนอะตอม
|
6(6.02x1023) : 14(6.02x1023)
6:14
|
|
อัตราส่วนระหว่าง C:H โดยมวล (กรัม)
|
(12x6) : (1x14)
72 :14
|
|
ร้อยละโดยมวล
|
ร้อยละของ C =
= 83.72
ร้อยละของ H =
= 16.28
|
สูตรเอมพิริกัลหรือสูตรอย่างง่าย (empirical formula) คือสูตรที่เกิดจากการทำให้สูตรโมเลกุลเป็นอัตราส่วนอย่างต่ำ เช่น จากสูตรโมเลกุล C6H14
สูตรเอมพิริกัลคือ C3H7 สูตรจะแสดงข้อมูลดังนี้
- บอกชนิดของธาตุที่เป็นส่วนประกอบอยู่ในสารนั้น ๆ เช่น สูตรเอมพิริกัลของเฮกเซนคือ C3H7ทำให้ทราบว่าเฮกเซนประกอบด้วยธาตุ C และ H
- แสดงอัตราส่วนของธาตุที่เป็นองค์ประกอบในรูปแบบต่าง ๆ ดังตาราง
|
สิ่งที่ทราบจากสูตรเอมพิริกัล C3H7
|
|
มวลสูตรเอมพิริกัล (empirical formula mass)
|
3C + 7H
(3 x 12) + (7 x 1)
36 + 7
43 amu.
|
|
มวลต่อโมล (molar mass)
|
43g/mol
|
|
อัตราส่วน C:H โดยจำนวนโมล
|
3: 7
|
|
อัตราส่วน C:H โดยจำนวนอะตอม
|
3(6.02x1023) : 7(6.02x1023)
3:7
|
|
อัตราส่วน C:H โดยมวล (กรัม)
|
3C + 7H
(3 x 12) + (7 x 1)
36 :7
|
|
ร้อยละโดยมวล
|
ร้อยละของ C = 36x100/43
= 83.72
ร้อยละของ H = 7x100/43
= 16.28
|
** ร้อยละโดยมวลของธาตุที่เป็นองค์ประกอบ ไม่ว่าจะคิดจากสูตรโมเลกุลหรือสูตรเอมพิริกัลจะได้เท่ากัน
ความสัมพันธ์ระหว่างสูตรเอมพิริกัลกับสูตรโมเลกุลเป็นดังนี้
สูตรโมเลกุล = (สูตรเอมพิริกัล)n
(มวลสูตรเอมพิริกัล)n = มวลโมเลกุล
** กรณี C6H14 แสดงความสัมพันธ์ได้ดังนี้
C6H14 = (C3H7)2
86 = (43)2
สูตรโครงสร้าง (structural formula) คือการเขียนสูตรที่แสดงให้เห็นว่าอะตอมที่เป็นองค์ประกอบของโมเลกุล ดังที่แสดงในสูตรโมเลกุลมีการสร้างพันธะกันอย่างไร
โดยสามารถเขียนได้ทั้งแบบ 2 มิติและ 3 มิติ เช่น สูตรโครงสร้างของ C6H14 เขียนได้หลายแบบ ดังนี้
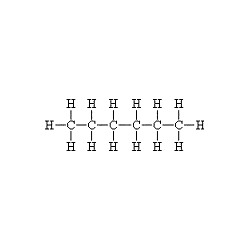 
ตัวอย่างสูตรโมเลกุลและสูตรเอมพิริกัลของสารบางชนิด
|
สูตรโมเลกุล
|
สูตรเอมพิริกัล
|
สูตรโครงสร้าง
|
|
CH4
|
CH4
|
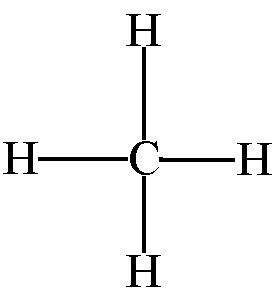
|
|
C2H6
|
CH3
|
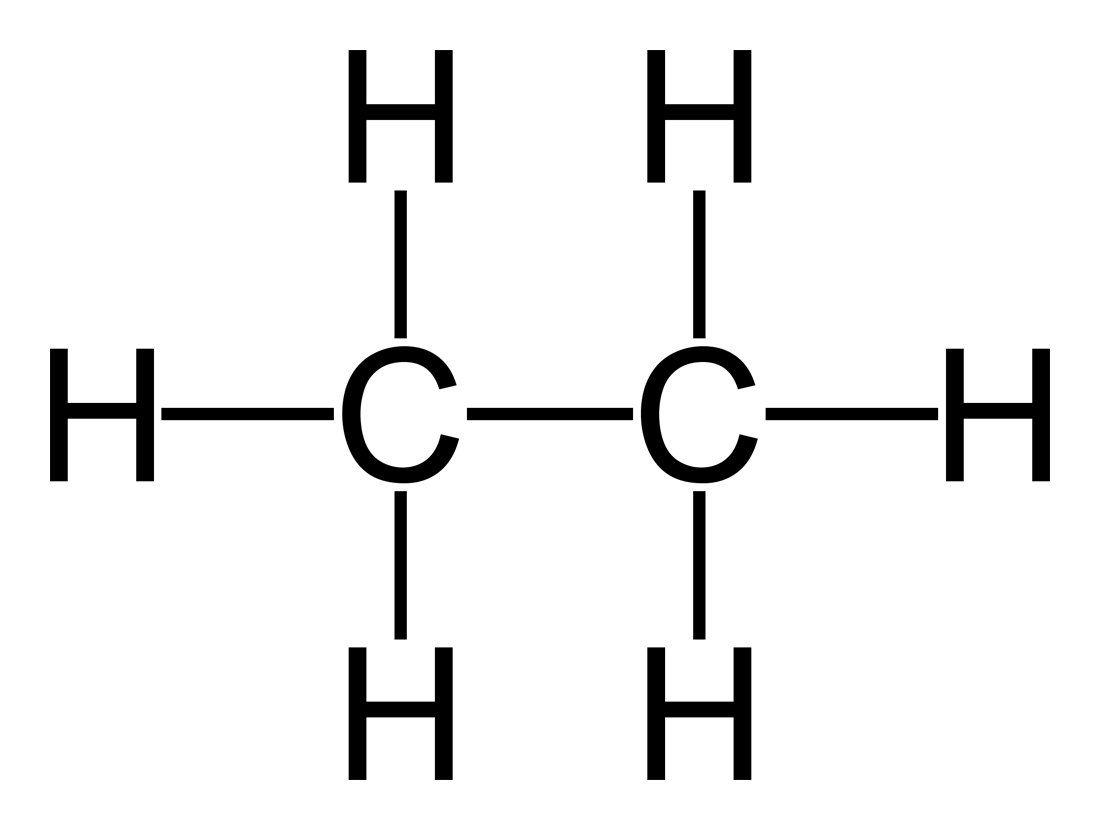
|
|
C3H8
|
C3H8
|
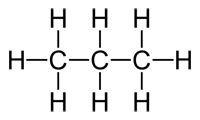
|
|
C4H10
|
C2H5
|
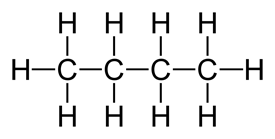
|
|
C6H5COOH
|
C6H5COOH
|
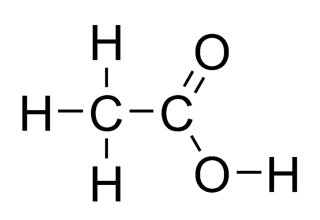
|
* สารที่สูตรโมเลกุลเป็นอัตราส่วนอย่างต่ำอยู่แล้ว สูตรโมเลกุลกับสูตรเอมพิริกัลจะเป็นสูตรเดียวกัน เช่น CH4 C3H8
การคำนวณหาสูตรเอมพิริกัลและสูตรโมเลกุล
ทั้งสูตรเอมพิริกัลและสูตรโมเลกุลจะบอกอัตราส่วนของธาตุที่เป็นองค์ประกอบในรูปที่เป็นร้อยละโดยมวลได้ตรงกัน ดังตัวอย่าง
|
สารตัวอย่าง
|
อัตราส่วน C:H
โดยจำนวนโมล
|
อัตราส่วน C:H
โดยมวล
|
อัตราส่วน C:H
เป็นร้อยละโดยมวล
|
|
C2H6 (สูตรโมเลกุล)
CH3 (สูตรเอมพิริกัล)
|
2:6
1:3
|
24:6
12:3
|
80:20
80:20
|
|
C2H4(สูตรโมเลกุล)
CH2(สูตรเอมพิริกัล)
|
2:4
1:2
|
24:4
12:2
|
85.71:13.33
85.71:13.33
|
|
C6H6(สูตรโมเลกุล)
CH(สูตรเอมพิริกัล)
|
6:6
1:1
|
72:6
12:1
|
92.31:7.69
92.31:7.69
|
ในการเขียนสูตรเอมพิริกัลและสูตรโมเลกุลนั้น เป็นการเขียนแสดงอัตราส่วนของธาตุที่เป็นองค์ประกอบที่มีอยู่ในโมเลกุลนั้น ๆ เช่น C6H14 ความหมายว่า C6H14 จำนวน 1 โมล
ประกอบด้วย C จำนวน 6 โมล และ H จำนวน 14 โมล หรือเขียนว่า ; C : H = 6 : 14 โดยจำนวนโมล
แต่ถ้าพิจารณาในหน่วยย่อยคือคิดว่า C6H14 คือเฮกเซนเพียง 1 โมเลกุล จะประกอบด้วย C จำนวน 6 อะตอม และ H จำนวน 14 อะตอม อัตราส่วนระหว่าง
C : H = 6 : 14 โดยจำนวนอะตอม
การคำนวณหาสูตรเอมพิริกัลและสูตรโมเลกุลของสารประกอบ ต่าง ๆ มีหลักการทั่วไปดังนี้
- ต้องทราบว่าสารประกอบเหล่านั้นมีธาตุใดเป็นองค์ประกอบบ้าง
- ต้องทราบมวลหรือร้อยละโดยมวลของธาตุที่เป็นองค์ประกอบทุกชนิด
- เปลี่ยนมวลหรือร้อยละโดยมวลของแต่ละธาตุให้เป็นจำนวนโมล แล้วทำให้เป็นจำนวนเต็มและเป็นอัตราส่วนอย่างต่ำ จะได้สูตรเอมพิริกัลของสารประกอบนั้น
- ถ้าทราบมวลโมเลกุลจะหาสูตรโมเลกุลได้ โดยใช้สมการต่อไปนี้
(มวลสูตรเอมพิริกัล)n = มวลโมเลกุล
สูตรโมเลกุล = (สูตรเอมพิริกัล)n
รูปแบบของการคำนวณหาสูตรเอมพิริกัลและสูตรโมเลกุลมีดังนี้
เพื่อให้เข้าใจง่ายจะใช้ตัวอย่างเป็นสารชนิดเดียวกันคืออีเทน (C2H6) สารชนิดนี้เป็นสารไฮโดรคาร์บอน โมเลกุลประกอบด้วยไฮโดรเจนกับคาร์บอนเท่านั้น
สูตรโมเลกุลคือ C2H6 มีมวลโมเลกุล = 30 amu.
มีมวล/โมล = 30 g/mol
สูตรเอมพิริกัลคือ CH3 มีมวลสูตรเอมพิริกัล = 15 amu.
จะแสดงการคำนวณหาสูตรโมเลกุลและสูตรเอมพิริกัลของสารเชนิดนี้ โดยกำหนดข้อมูลของธาตุที่เป็นองค์ประกอบในรูปแบบที่แตกต่างกัน 3 แบบ แต่ไม่ว่าจะเป็นข้อมูลแบบใดก็จะ
ได้สูตรเอมพิริกัลหมือนกันคือ CH3 และได้สูตรโมเลกุลเหมือนกันคือ C2H6 ดังนี้
1. บอกมวลของธาตุที่เป็นองค์ประกอบโดยตรง
ตัวอย่าง สารประกอบไฮโดรคาร์บอนชนิดหนึ่งมีมวลโมเลกุล 30 amu. เมื่อนำสารชนิดนี้มา 10.00 กรัม พบว่าประกอบด้วย C 8.00 กรัม และ H 2.00 กรัม
จงหาสูตรเอมพิริกัลและสูตรโมเลกุลของสารชนิดนี้
วิธีทำ (หาสูตรเอมพิริกัล)
อัตราส่วนระหว่าง C : H
อัตราส่วนโดยมวล (กรัม) 8 : 2
เปลี่ยนเป็นโมล 8/12 : 1/1
0.67 : 2
1 : 3
สูตรเอมพิริกัลคือ CH3 ตอบ
(หาสูตรโมเลกุล)
(มวลสูตรเอมพิริกัล)n = มวลโมเลกุล
(CH3)n = 30
15n = 30
n = 2
สูตรโมเลกุล = (สูตรเอมพิริกัล)n
= (CH3)2
= C2H6 ตอบ
2. บอกส่วนประกอบของธาตุเป็นร้อยละโดยมวล
ตัวอย่าง สารประกอบไฮโดรคาร์บอนชนิดหนึ่งมีมวลโมเลกุล 30 ประกอบด้วย C ร้อยละ 80 และ H ร้อยละ 20 โดยมวล จงหาสูตรเอมพิริกัลและสูตรโมเลกุลของสารชนิดนี้
วิธีทำ (หาสูตรเอมพิริกัล)
อัตราส่วนระหว่าง C : H
อัตราส่วนเป็นร้อยละโดยมวล 80 : 20
เปลี่ยนเป็นโมล 80/12 : 20/1
6.67 : 20
1 : 3
สูตรเอมพิริกัลคือ CH3 ตอบ
(หาสูตรโมเลกุล)
(มวลสูตรเอมพิริกัล)n = มวลโมเลกุล
(CH3)n = 30
15n = 30
n = 2
สูตรโมเลกุล = (สูตรเอมพิริกัล)n
= (CH3)2
= C2H6 ตอบ
3. บอกส่วนประกอบของธาตุทางอ้อม ซึ่งมีหลายวิธี เช่น บอกด้วยปฏิกิริยา บอกด้วยการวิเคราะห์และอื่น ๆ รวมทั้งการบอกมวลโมเลกุลอาจบอกทางอ้อม
โดยให้ข้อมูลมาบางส่วนเพื่อให้นำไปคำนวณหามวลโมเลกุลเอาเอง
ตัวอย่าง สารไฮโดรคาร์บอนชนิดหนึ่งมีมวลโมเลกุล 30 เมื่อนำสารชนิดนี้มา 10 กรัม แล้วเผาไหม้อย่างสมบูรณ์ปรากฏว่าได้ก๊าซ CO2 29.33 กรัม และไอน้ำอีก 18.00 กรัม
จงหาสูตรเอมพิริกัลและสูตรโมเลกุลของสารดังกล่าวนี้
วิธีทำ (หาสูตรเอมพิริกัล)
ให้ทำความเข้าใจว่าเมื่อสารไฮโดรคาร์บอนซึ่งประกอบด้วยธาตุ H และ C เกิดการเผาไหม้ ธาตุ H และ C จะรวมตัวกับออกซิเจนในอากาศ กลายเป็นไอน้ำ (H2O)
และก๊าซ CO2 ตามลำดับ เราต้องคำนวณหามวลของ H ในไอน้ำที่เกิดขึ้น และคำนวณหามวลของ C ใน CO2 ที่เกิดขึ้น มวลของ H และ C ดังกล่าวก็คือมวลของ H
และ C ที่เป็นองค์ประกอบอยู่ในสารไฮโดรคาร์บอนที่เรากำลังต้องการหาสูตรเอมพิริกัลและสูตรโมเลกุล
(คำนวณหามวลของ C ใน CO2)
CO2 = C + 2O
= 12 + (2x16)
= 12 + 32
= 44 (หมายความว่า CO2 1 โมล มีมวล 44 กรัม ประกอบด้วย C 12 กรัม และ O 32 กรัม)
CO2 44 กรัม มี C เป็นองค์ประกอบ 12 กรัม
CO2 29.33 กรัม มี C เป็นองค์ประกอบ = 12x29.33/44 กรัม
= 8.00 กรัม**
มวลของ H ในสารตัวอย่าง = 10 - 8 = 2.0 กรัม**
ขณะนี้เราทราบมวลของ C และ H ที่มีอยู่ในสารประกอบแล้ว ทำให้คำนวณหาสูตรเอมพิริกัลและสูตรโมเลกุล ต่อไปได้
(หาสูตรเอมพิริกัล)
อัตราส่วนระหว่าง C : H
อัตราส่วนโดยมวล (กรัม) 8 : 2
เปลี่ยนเป็นโมล 8/12 : 2/1
0.67 : 2
1 : 3
สูตรเอมพิริกัลคือ CH3 ตอบ
(หาสูตรโมเลกุล)
(มวลสูตรเอมพิริกัล)n = มวลโมเลกุล
(CH3)n = 30
15n = 30
n = 2
สูตรโมเลกุล = (สูตรเอมพิริกัล)n
= (CH3)2
= C2H6 ตอบ
- จะเห็นได้ว่าจากข้อมูลที่กำหนดให้ทั้ง 3 แบบ เราสามารถคำนวณหาสูตรโมเลกุลและสูตรเอมพิริกัลได้ตรงกัน
(คลิ้ก ชมแอนิเมชันการหาสูตรเอมพิริกัล)
แบบฝึกหัด
1. จงหาสูตรเอมพิริกัลของสารต่อไปนี้
1.1 สารที่ประกอบด้วย C H และ O ที่มีจำนวนโมล 0.013 0.039 และ 0.0065 ตามลำดับ
1.2 สารที่ประกอบด้วย Fe และ O ในอัตราส่วนโดยมวล 11.66 : 5.01 กรัม ตามลำดับ
1.3 สารที่ประกอบด้วย C H และ O ในอัตราส่วนร้อยละโดยมวล 40.0 6.7 และ 53.3 ตามลำดับ
2. จงหาสูตรโมเลกุลของสารต่อไปนี้
2.1 สารที่มีสูตรเอมพิริกัลเป็น CH และมีมวลโมเลกุล 78
2.2 สารที่มีสูตรเอมพิริกัลเป็น NO2 และมีมวลโมเลกุล 92.02
2.3 สารที่มีสูตรเอมพิริกัลเป็น CH2 และมีมวลโมเลกุล 70.14
2.4 สารที่มีสูตรเอมพิริกัลเป็น NH2Cl และมีมวลโมเลกุล 51.5
3. จงหาสูตรโมเลกุลของสารต่อไปนี้
3.1 ethylene glycol ประกอบด้วย C H และ O ในอัตราส่วนร้อยละโดยมวล 38.7 9.7 และ 51.6 ตามลำดับ โดยสารชนิดนี้มีมวลโมเลกุล 62
3.2 caffein ประกอบด้วย C H N และ O ในอัตราส่วนร้อยละโดยมวล 49.5 5.15 28.9 และ 16.5 ตามลำดับ โดยสารชนิดนี้มีมวลโมเลกุล 195
3.3 adrenaline ประกอบด้วย C H O และ N ในอัตราส่วนร้อยละโดยมวล 59.0 7.10 26.20 และ 7.70 ตามลำดับ โดยสารชนิดนี้มีมวลโมเลกุล 180
4. ethylbutyrate เป็นสารจำพวกเอสเทอร์ที่มีกลิ่นเหมือนสับปะรด ประกอบด้วย C H และ O เมื่อนำสารนี้มา 2.78 มิลลิกรัมแล้วเผาไหม้อย่างสมบูรณ์ พบว่ามีก๊าซ CO2
เกิดขึ้น 6.32 มิลลิกรัม และไอน้ำอีก 2.58 มิลลิกรัม จงหาสูตรเอมพิริกัลของสารชนิดนี้
5. menthol ประกอบด้วย C H และ O เมื่อนำเมนทอลจำนวน 0.1005 กรัม มาเผาไหม้อย่างสมบูรณ์ ได้ก๊าซ CO2 จำนวน 0.2829 กรัม และไอน้ำอีก 0.1159 กรัม
จงหาสูตรเอมพิริกัลของเมนทอล และถ้ามวลโมเลกุลของเมนทอลเท่ากับ 156 จงหาสูตรโมเลกุลของเมนทอลด้วย
6. สารที่ประกอบด้วย C H และ O และมีมวลโมเลกุล 74 เมื่อนำสารดังกล่าวนี้หนัก 7.4 กรัม มาเผาไหม้ในอากาศอย่างสมบูรณ์พบว่า มีก๊าซ CO2 เกิดขึ้น 13.2 กรัม
และไอน้ำอีก 5.4 กรัม จงหาสูตรโมเลกุลของสารดังกล่าวนี้
7. A compound containing only carbon, hydrogen and oxygen is reacted with chlorine. The hydrogen is converted into HCl,
the carbon into CCl4. A 5.00 mg sample forms 10.7 mg of HCl and 30.2 mg of CCl4. What is the empirical formula of the compound?
(Atomic weights: C = 12.01, H = 1.008, O = 16.00, Cl = 35.45). (Ans.e); ( สารประกอบชนิดหนึ่งประกอบด้วย คาร์บอน ไฮโดรเจนและออกซิเจน
เมื่อนำสารดังกล่าว 5.00 มิลลิกรัม ไปทำปฏิกิริยากับคลอรีน พบว่ามี HCl เกิดขึ้น 10.7 มิลลิกรัม และ CCl4 อีก 30.2 มิลลิกรัม
สูตรเอมพิริกัลของสารนี้เป็นดังข้อใด)
a) C2H4O b) C3H5O2 c) CH2O d) C4H8O3 e) C4H6O3
8. A 1.35 g sample of a compound containing carbon, hydrogen, oxygen and nitrogen was burned to produce 0.810 g H2O
and 1.32 g CO2. In a separate reaction, 0.735 g of the substance was converted into 0.284 g of NH3. What is the empirical formula
of the compound? (Atomic weights: C = 16.00, H = 1.008, O = 16.00, N = 14.01). (Ans.e) ; ( สารชนิดหนึ่งประกอบด้วย คาร์บอน
ไฮโดรเจน ออกซิเจนและไนโตรเจน เมื่อนำสารดังกล่าวนี้มา 1.35 กรัม มาทำการเผาไหม้พบว่ามีน้ำเกิดขึ้น 0.810 กรัม และ CO2 1.32 กรัม
แต่เมื่อนำสารดังกล่าวนี้มา 0.735 กรัม สามารถเปลี่ยนให้เป็นแอมโมเนียได้ 0.284 กรัม สูตรเอมพิริกัลของสารนี้เป็นดังข้อใด)
a) CH3N2O b) CHNO c) CH2NO d) CHNO2 e) CH3NO
9. Determine the empirical formula of Lucite which is 71.40% C, 9.59% H and 19.01% O.
(Atomic weights: C = 12.01, H = 1.008, O = 16.00). (Ans.c) ; (จงหาสูตรเอมพิริกัลของ Lucite ซึ่งประกอบด้วย C 71.40 % , H 9.59 %
และ O 19.01 %)
a) C2H6O b) CHO c) C5H8O d) C4H6O e) C3H6O
10. Determine the empirical formula of saran which is 24.8% C, 2.1% H and 73.1% Cl.
(Atomic weights: C = 12.01, H = 1.008, Cl = 35.45). (Ans.c) ; (จงหาสูตรเอมพิริกัลของ saran ซึ่งประกอบด้วย C 24.8%, H 2.1%
และ Cl 73.1% )
a) CH3Cl b) C2H2Cl c) CHCl d) C2HCl e) CH2Cl
11. A semiconductor consists of 32.0% silver and 68.0% indium. What is the empirical formula?
(Atomic weights: Ag = 107.9, In = 114.8). (Ans.b) ; (สารกึ่งตัวนำประกอบด้วย โลหะเงิน 32.0 % และธาตุอินเดียม 68.0 %
สูตรเอมพิริกัลเป็นดังข้อใด)
a) AgIn b) AgIn2 c) Ag3In2 d) Ag2In e) Ag2In3
12. A semiconductor consists of 66.3% bismuth and 33.7% palladium. What is the empirical formula?
(Atomic weights: Bi = 209.0, Pd = 106.4). (Ans.b); (สารกึ่งตัวนำประกอบด้วย บิทมัส 66.3 % และพาราเดียม 33.7 %
สูตรเอมพิริกัลเป็นดังข้อใด)
a) BiPd2 b) BiPd c) Bi3Pd2 d) Bi2Pd e) Bi2Pd3
13. The mineral thorite contains 71.6% Th, 8.7% Si and 19.7% O. What is the empirical formula?
(Atomic weights: Th = 232.0, Si = 28.1, O = 16.00). (Ans.c) ; (แร่ thorite ประกอบด้วย Th 71.6%, Si 8.7% และ O 19.7%
สูตรเอมพิริกัลเป็นดังข้อใด)
a) ThSiO3 b) ThSi2O c) ThSiO4 d) ThSiO2 e) Th2SiO4
14. The mineral forsterite contains 34.5% Mg, 20.0% Si and 45.5% O. What is the empirical formula?
(Atomic weights: Mg = 24.3, Si = 28.1, O = 16.00). (Ans.c) ; (แร่ forsterite ประกอบด้วย Mg 34.5%, Si 20.0% และ O 45.5% สูตรเอมพิริกัลเป็นดังข้อใด)
a) Mg2SiO2 b) MgSiO4 c) Mg2SiO4 d) MgSiO3 e) Mg2SiO3
15. What is the empirical formula of a compound that contains 81.0% carbon and 18.3% hydrogen.
(Atomic weights: C = 12.01, H = 1.008). (Ans.e) ; (สารชนิดหนึ่งประกอบด้วย C 81.0 % และ H 18.3 % สูตรเอมพิริกัลเป็นดังข้อใด)
a) CH3 b) C2H7 c) C3H5 d) C2H5 e) C3H8
16. A compound consists of 57.0% iodine and 43.0% fluorine. What is its empirical formula?
(Atomic weights: iodine = 126.0, fluorine = 19.0).(Ans.e) ; (สารชนิดหนึ่งประกอบด้วย I 57.0 % และ F43.0 %
สูตรเอมพิริกัลเป็นดังข้อใด)
a) IF3 b) I2F3 c) IF7 d) IF e) IF5
17. Gahnite contains 35.7% Zn, 29.4% Al and 34.9% O. What is the empirical formula?
(Atomic weights: Zn = 65.4, Al = 27.0, O = 16.00). (Ans.b) ; (Gahnite ประกอบด้วย Zn 35.7%, Al 29.4% และ O 34.9%
สูตรเอมพิริกัลเป็นดังข้อใด)
a) Zn2AlO3 b) ZnAl2O4 c) ZnAlO3 d) Zn2AlO4 e) ZnAlO4
18. A compound consists of 15.5% carbon, 23.0% chlorine and 61.5% fluorine by mass. What is the empirical formula
of the compound? (Atomic weights: C = 12.01, Cl = 35.45, F = 19.00).(Ans.b) ; (สารประกอบชนิดหนึ่งประกอบด้วย
คาร์บอน 15.5 % คลอรีน 23.0 % และฟลูออรีน 61.5 % สูตรเอมพิริกัลเป็นดังข้อใด)
a) C2ClF2 b) C2ClF5 c) C2Cl2F d) C2ClF3 e) CClF
19. Cocaine, an addictive drug, has the weight percents C = 67.3%, H = 6.98%, N = 4.62% and O = 21.10%
Content's Picture

Size : 9.39 KBs
Upload : 2013-08-03 04:52:33
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|