กรด - เบส ตอนที่ 2 การแตกตัวของกรด-เบส และภาวะสมดุลในสารละลายกรด เบส
กรด-เบส
ตอนที่ 2 การแตกตัวของกรด-เบส และภาวะสมดุลในสารละลายกรด
– เบส
เมื่อจำแนก
กรด-เบส โดยดูจากความแรงของกรดหรือเบส ทำให้จำแนกออก 2 ชนิด
คือ
1. กรดแก่
(strong acid) คือกรดที่ละลายน้ำแล้วจะแตกตัวเป็นไอออนได้
100 % มี 7 ชนิด และมีลำดับ
ความแรงดังนี้ HClO4>HI>HBr>HCl>H2SO4>HNO3>HClO3
2. กรดอ่อน (weak acid)
คือกรดที่มีความแรงของกรดน้อย
เมื่อเกิดการละลายจะมีการแตกตัวเพียงเล็กน้อย
และเกิดภาวะสมดุล กรดอ่อนมีอยู่เป็นจำนวนมาก ได้แก่
กรดอินทรีย์ทุกชนิด
รวมทั้งกรดอนินทรีย์ที่ไม่ใช่
กรดแก่ เช่น H2CO3 H2SO3 …
3.
เบสแก่ (Strong base) คือเบสที่ละลายน้ำแล้วแตกตัว 100 % มี 8 ชนิดและมีลำดับความแรงดังนี้
KOH > Ba(OH)2 >
CsOH > NaOH > Sr(OH)2 > Ca(OH)2 > LiOH >
RbOH
4. เบสอ่อน (Weak base) คือเบสที่มีความแรงน้อย
เมื่อละลายจะแตกตัวเพียงเล็กน้อยแล้วเกิดภาวะสมดุล
ทำนองเดียวกับกรดอ่อน เช่น
NH3
หรือ NH4OH
(คลิ้ก ชมเปรียบเทียบการแตกตัวของกรดแก่และกรดอ่อน)
(คลิ้ก
ชมการแตกตัวของกรดแก่) (คลิ้ก ชมการแตกตัวของกรดอ่อน)
ไอออนสำคัญในสารละลายกรดหรือเบส
ถ้าพิจารณาสารละลายกรด – เบส ตามทฤษฎีของอาร์รีเนียส สารละลายของกรดแต่ละชนิด จะมีอนุภาคชนิดเดียวกันละลายอยู่คือ H+ หรือ H3O+ เช่น
HCl → H+
+ Cl-
หรือ HCl + H2O → H3O+
+ Cl-
H2SO4
→ H+ + HSO4-
หรือ H2SO4 + H2O
→ H3O+
+ HSO4-
HNO3 → H+
+ NO3-
หรือ HNO3 + H2O → H3O+
+ NO3-
CH3COOH → H+
+ CH3COO-
หรือ CH3COOH + H2O → H3O+
+ CH3COO-
สำหรับกรณีของเบส ต่างก็จะมี
OH- ละลายอยู่เช่นกันดังตัวอย่าง
NaOH → Na+ + OH-
KOH → K+ + OH-
Ca(OH)2 è Ca2+ + 2OH-
NH4OH → NH4+ +
OH-
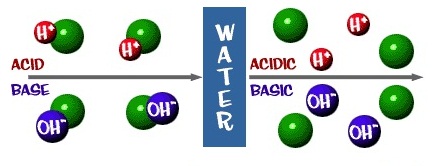
การที่มีไอออนอยู่ในสารละลายกรดและสารละลายเบส ทำให้สารละลายนำไฟฟ้าได้ เรียกว่าสารละลายอิเล็กโตรไลต์
ซึ่งนอกจากสารละลายของกรดและเบสแล้วสารละลายของเกลือหรือสารละลายของสารไอออนิกต่าง
ๆ
จะมีสมบัติเป็นสารละลายอิเล็กโตรไลต์เช่นกัน
ถ้าเปรียบเทียบสมบัติของสารละลายอิเล็กโตรไลต์ชนิดต่าง
ๆ ที่มีความเข้มข้นเท่ากัน
ชนิดที่นำไฟฟ้าได้ดีกว่าจะมีสมบัติเป็นสารละลายอิเล็กโตรไลต์ที่แก่กว่า ถ้าพิจารณาเฉพาะสารละลายของกรดและเบส พบว่าจะทั้งอิเล็กโตรไลต์อ่อนและอิเล็กโตรไลต์แก่
กรดที่ทำให้เกิดสารละลายอิเล็กโตรไลต์แก่เรียกว่าว่ากรดแก่ (strong
acid) ซึ่งมี 7 ชนิด ได้แก่
HCl HBr HI HNO3 H2SO4 HClO3 HClO4 (แหล่งอ้างอิงบางแห่งไม่จัดให้ HClO3
เป็นกรดแก่) มักกล่าวว่ากรดแก่เป็นกรดที่แตกตัวได้ 100 % สำหรับกรดที่แตกตัวได้ไม่ถึง 100 % เราเรียกว่ากรดอ่อน (weak base) ทำให้สารละลายมีสมบัติเป็นอิเล็กโตรไลต์อ่อน
ส่วนที่ไม่แตกตัวเป็นไอออนจะละลายอยู่ในรูปโมเลกุล กรดอ่อนมีอยู่เป็นจำนวนมาก ได้แก่กรดอินทรีย์ทุกชนิด และกรดอนินทรีย์นอกเหนือจากกรดแก่ 7
ชนิดดังกล่าวมาแล้ว
สำหรับสารละลายเบสก็เช่นเดียวกัน พบว่ามีทั้งชนิดที่เป็นอิเล็กโตรไลต์แก่และอิเล็กโตรไลต์อ่อน เบสที่ทำให้เกิดสารละลายอิเล็กโตรไลต์แก่เรียกว่าเบสแก่ (strong base) มี 8 ชนิด
คือ KOH Ba(OH)2 CsOH NaOH Sr(OH)2 Ca(OH)2 LiOH RbOH นอกจากที่กล่าวมานี้เป็นเบสอ่อน (weak
base)
ซึ่งมีอยู่เป็นจำนวนมาก เช่น
สารกลุ่มเอมีน
; R-NH2
โครงสร้างโมเลกุลของกรดเป็นสารโคเวเลนต์ แต่เมื่อละลายน้ำจะแตกตัวออกเป็นไอออน ซึ่งแตกต่างจากสารโคเวเลนต์อื่น ๆ
ที่ละลายทั้งโมเลกุล เมื่อกรดละลายน้ำแล้วจะทำให้ H ในโมเลกุลจะแตกตัวออกเป็น H+
และจะรวมตัวอยู่กับโมเลกุลของน้ำในรูป H3O+ (ไฮโดรเนียมไอออน) ส่วนที่เหลือจะเป็นไอออนลบซึ่งก็คือคู่เบสของกรดนั้น
ๆ ละลายอยู่ในสารละลายเดียวกัน ตัวอย่างโครงสร้างโมเลกุลของกรดบางชนิดเป็นดังนี้
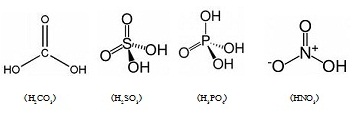
จะเห็นได้ว่า H
สร้างพันธะโคเวเลนต์อยู่กับ O ซึ่งล้อมรอบอะตอมของอโลหะที่เป็นอะตอมกลาง
ไม่ได้สร้างพันธะกับอโลหะที่เป็นอะตอมกลางโดยตรง
ภาวะสมดุลของกรดอ่อน
การละลายของกรดอ่อนจะมีการแตกตัวเป็นไอออนเพียงเล็กน้อย และผันกลับได้โดย ทำให้มีภาวะสมดุลเกิดขึ้น เรียกว่าสมดุลของสารละลายกรดอ่อนหรือสมดุลของการแตกตัวของกรดอ่อน ซึ่งมีค่าคงที่สมดุลทำนองเดียวกับสมดุลทั่ว ๆ
ไป เช่น
การแตกตัวของกรดอะซิติก
(CH3COOH) เป็นดังนี้
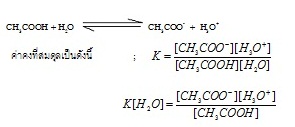
กำหนดให้เรียก K[H2O] ว่า Ka ฉะนั้น
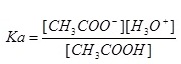
สังเกตจากสมการแสดงภาวะสมดุลจะเห็นว่า [CH3COO-]= [H3O+] ฉะนั้นค่า Ka จึงเป็นดังนี้ก็ได้
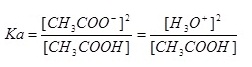
ในการหาค่า Ka ของกรดอ่อนนี้ ถ้ากรดอ่อนแตกตัวน้อยมาก อนุโลมให้ใช้ความเข้มข้นเดิมของกรดมาคิดค่า Ka เสมือนหนึ่งไม่ได้แตกตัว ค่าที่ได้ก็จะใกล้เคียงกับการคิดว่ามีการแตกตัว
ค่า
Ka ของกรดอ่อนต่าง ๆ ใช้ในการบอกความแรงของกรดอ่อนนั้น
ๆ กรดอ่อนที่มีค่า Ka มาก จะมีความแรงของกรดมากกว่ากรดที่มีค่า Ka น้อย แต่ในขณะเดียวกันเราสามารถแสดงด้วยค่า –log
Ka เรียกว่า pKa ของกรดแต่ละชนิดได้ด้วย ความหมายของค่า pKa จะตรงข้ามกับค่า Ka คือถ้า pKa มาก
ความแรงของกรดจะน้อย ดังตัวอย่างต่อไปนี้
|
Name
|
Formula
|
Ka
|
pKa
|
|
acetic
|
HC2H3O2
|
1.8
x 10-5
|
4.7
|
|
ascorbic
(I)
|
H2C6H6O6
|
7.9
x 10-5
|
4.1
|
|
benzoic
|
HC7H5O2
|
6.4
x 10-5
|
4.2
|
|
boric
(I)
|
H3BO3
|
5.4
x 10-10
|
9.3
|
|
boric
(II)
|
H2BO3-
|
1.8
x 10-13
|
12.7
|
|
boric
(III)
|
HBO32-
|
1.6
x 10-14
|
13.8
|
|
carbonic
(I)
|
H2CO3
|
4.5
x 10-7
|
6.3
|
|
carbonic
(II)
|
HCO3-
|
4.7
x 10-11
|
10.3
|
|
citric
(I)
|
H3C6H5O7
|
3.2
x 10-7
|
6.5
|
|
citric
(II)
|
H2C6H5O7-
|
1.7
x 105
|
4.8
|
|
citric
(III)
|
HC6H5O72-
|
4.1
x 10-7
|
6.4
|
|
formic
|
HCHO2
|
1.8
x 10-4
|
3.7
|
|
hydrofluoric
|
HF
|
6.3
x 10-4
|
3.2
|
*** Ka = 10-pKa
ค่าคงที่สมดุลของกรดอ่อนแต่ละชนิดจะคงที่เมื่ออุณหภูมิคงที่
ทำนองเดียวกับค่าคงที่ของสมดุลทั่วไปดังที่ทราบมาแล้ว ฉะนั้นสารละลายของกรดอ่อนชนิดเดียวกัน ณ
อุณหภูมิเดียวกัน
ไม่ว่าจะเข้มข้นมากหรือน้อยก็จะมีค่าคงที่สมดุลหรือ Ka เท่ากัน แต่ความแรงของความเป็นกรด (pH) ไม่เท่ากัน
ชนิดที่มีความเข้มข้นมากจะแรงกว่าชนิดที่เข้มข้นน้อย (pH ต่ำกว่า)
สารละลายของกรดอ่อนต่าง ๆ จะมีความสัมพันธ์ระหว่างตัวแปร 3
ค่า คือความเข้มข้นของสารละลายกรด ร้อยละในการแตกตัวและค่า
Ka เมื่อทราบตัวแปร 2
ค่า จะคำนวณหาตัวแปรค่าที่ 3 ได้
ตัวอย่างต่อไปนี้จะแสดงความสัมพันธ์ของค่าทั้ง 3
ค่า ดังกล่าวมาแล้ว ของสารละลายกรดอะซิติก คือ
* ความเข้มข้น 1.00 mol/dm3
*
ค่า Ka = 1.8 x 10-5
*
ร้อยละในการแตกตัว 1.34x10-0.5
จะแสดงด้วยตัวอย่าง 3
ตัวอย่าง เพื่อให้เห็นความสัมพันธ์ของค่าทั้ง 3 โดยใช้ค่าที่ทราบ 2
ค่า เพื่อคำนวณหาค่าที่ 3
ตัวอย่างที่ 1 (
ทราบความเข้มข้นและค่า Ka คำนวณหาร้อยละของการแตกตัว );
สารละลายกรดอะซิติกมีความเข้มข้น 1.00 mol/dm3 อยากทราบว่ากรดอะซิติกแตกตัวร้อยละเท่าไร ถ้าภาวะสมดุลและค่า Ka เป็นดังนี้
CH3COOH(aq) ↔ CH3COO-(aq) + H+(aq) ;
Ka = 1.8 x 10-5
วิธีทำ Ka = [CH3COO-][H+]
1.8 x 10-5 = [CH3COO-]2 / 1
[CH3COO-]2 = 1.8
x 10-5
[CH3COO-] = 1.8
x 10-5
= 1.34 x 10-2.5 mol/dm3
หาร้อยละในการแตกตัวดังนี้
สารละลาย CH3COOH เข้มข้น 1.00 mol/dm3 แตกตัวได้ 1.34 x 10-2.5 mol/dm3
สารละลาย
CH3COOH เข้มข้น 100.00 mol/dm3 แตกตัวได้ (1.34 x 10-2.5)(100)/1.00 =1.34x10-0.5 mol/dm3 ตอบ
ตัวอย่างที่ 2 ( ทราบความเข้มข้นและร้อยละของการแตกตัว คำนวณหาค่า Ka );
สารละลายกรดอะซิติกมีความเข้มข้น 1.00 mol/dm3 แตกตัวได้ร้อยละ 1.34x10-0.5 อยากทราบว่าค่า Ka เป็นเท่าไร
วิธีทำ
สารละลาย CH3COOH เข้มข้น
100.00 mol/dm3 แตกตัวได้ 1.34x10-0.5 mol/dm3
สารละลาย CH3COOH เข้มข้น
1.00 mol/dm3 แตกตัวได้ (1.34x10-0.5 )(1.00)/(100.00) mol/dm3
=
1.34x10-2.5 mol/dm3
CH3COOH(aq) ↔ CH3COO-(aq) + H+(aq)
เริ่ม 1.00 mol/dm3 - -
เปลี่ยนแปลง 1.00-1.34x10-2.5
สมดุล 1.00-1.34x10-2.5 1.34x10-2.5 1.34x10-2.5
Ka = [CH3COO-]2 / [CH3COOH] = [1.34x10-2.5]2 = 1.8 x 10-5 ตอบ
ตัวอย่างที่ 3 ( ทราบค่า Ka และร้อยละของการแตกตัว
คำนวณหาความเข้มข้น);
สารละลายกรดอะซิติกมีค่า Ka = 1.8 x 10-5 แตกตัวได้ร้อยละ 1.34x10-0.5 อยากทราบว่ามีความเข้มข้นกี่ mol/dm3
วิธีทำ สมมติว่ามีความเข้มข้น x mol/dm3
ถ้าเข้มข้น 100 mol/dm3 แตกตัวได้ 1.34x10-0.5 mol/dm3
ถ้าเข้มข้น x mol/dm3 แตกตัวได้ (1.34x10-0.5)(x)/(100) mol/dm3
1.34x10-2.5(x) mol/dm3
CH3COOH(aq) ↔ CH3COO-(aq) + H+(aq)
เริ่ม x
mol/dm3 - -
เปลี่ยนแปลง x-1.34x10-2.5 (x)
สมดุล x-1.34x10-2.5
(x) 1.34x10-2.5 (x) 1.34x10-2.5 (x)
Ka = [CH3COO-]2 / [CH3COOH]
[CH3COOH] = [CH3COO-]2 / Ka
1 = { [1.34x10-2.5](x)}2 / Ka
1.8x10-5 =
(1.8x10-5)(x)2
x =
1 ตอบ
หมายเหตุ ณ อุณหภูมิคงที่ กรดอ่อนและเบสอ่อน เมื่อมีความเข้มข้นมากขึ้น ร้อยละในการตกตัวจะลดลง (ดูตัวอย่าง)
ตัวอย่าง จงคำนวณหาร้อยละในการแตกตัวของกรด CH3COOH เมื่อสารละลายมีความเข้มข้น 4.00 mol/dm3
; Ka = 1.8x10-5
วิธีทำ CH3COOH(aq) ↔ CH3COO-(aq) + H+(aq) ; Ka = 1.8x10-5
Ka = [CH3COO-][H+] / [CH3COOH]
1.8x10-5 = [CH3COO-]2 / 4
[CH3COO-]2
= 4(1.8x10-5)
= 7.2 x 10-5
[CH3COO-]
= 2.68 x 10-2.5
หาร้อยละในการแตกตัวดังนี้
สารละลาย CH3COOH เข้มข้น
4.00 mol/dm3 แตกตัวได้ 2.68 x 10-2.5mol/dm3
สารละลาย
CH3COOH เข้มข้น 100.00 mol/dm3 แตกตัวได้ (2.68 x 10-2.5)(100)/4.00 =0.67x10-0.5 mol/dm3 ตอบ
(ย้อนกลับไปดูเพื่อเปรียบเทียบกับตัวอย่างที่ 1 จะเห็นว่าในตัวอย่างนั้น CH3COOH มีความเข้มข้น 1.00 mol/dm3 แต่มีร้อยละในการแตกตัว 1.34x10-0.5 ซึ่งมากกว่า 2.68 x 10-2.5 )
ความสัมพันธ์ระหว่างกรดอ่อนกับคู่เบส และเบสอ่อนกับคู่กรด
เมื่อพิจารณาความเป็นกรด
– เบส
ตามทฤษฎีของบรอนสเต็ตและเลาว์รี จะพบว่ากรดแต่ละชนิดจะมีคู่เบสของมัน(ให้สังเกตว่ากรดจะมี
H มากกว่าคู่เบสอยุ่ 1 อนุภาค) ขณะเดียวกันเบสแต่ละชนิดก็จะมีคู่กรดของมันด้วย
(ให้สังเกตว่าคู่เบสจะมี H
อยู่น้อยกว่าคู่กรดของมันอยู่ 1 อนุภาค) มีหลักการอยู่ว่ากรดที่อ่อน
คู่เบสของมันจะมีความแรงของเบสมาก เบสก็เช่นกัน เบสที่อ่อนคู่กรดของมันก็จะมีความแรงของกรดมาก ดังสมการ
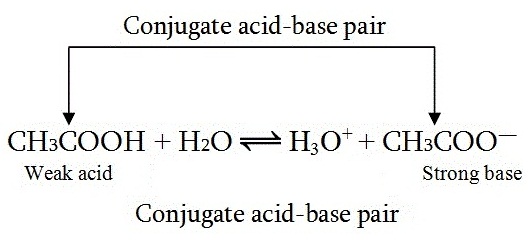
ความแรงของกรดแสดงด้วยค่า Ka
ขณะที่ความแรงของคู่เบสแสดงด้วยค่า Kb และ Ka.Kb = Kw
ถ้า Ka ของ CH3COOH เป็นดังนี้
CH3COOH ↔ CH3COO- + H+ ; Ka =
1.8 x 10-5
CH3COO- ซึ่งเป็น ; คู่เบสของ CH3COOH จะมีสมดุลและค่า Kb ดังนี้.
CH3COO- + H+ ↔ CH3COOH ; Kb = ?
Ka.Kb = Kw ; Kb = Kw / Ka = 1.0 x 10-14 / 1.8 x 10-5 = 5.6 x 10-10
สำหรับกรณีของเบสอ่อนก็จะเป็นทำนองเดียวกัน เช่น
กรณีของ
NH3 ซึ่งเป็นเบส จะมีคู่กรดของมันคือ NH4+ ความแรงระหว่างเบสกับคู่กรดจะตรงข้ามกัน เบสที่อ่อน
คู่กรดจะมีความแรงมาก ดังสมการ
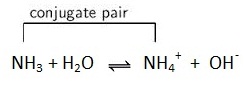
NH4+ ซึ่งเป็นคู่กรดของ NH3 จะมีภาวะสมดุลดังสมการ
NH4+
+ OH- ↔ NH3 + H2O ;
Ka = …..
ค่า Ka ของ NH4+ คิดได้จากสมการ Ka.Kb
= Kw ทำนองเดียวกับกรณีของกรดอ่อน ดังแสดงต่อไปนี้
NH3 + H2O ↔ NH4+ + OH- ; Kb =
1.8 x 10-5
NH4+ ซึ่งเป็นคู่กรดของ NH3 จะมีค่า
Ka ดังนี้
Ka.Kb = Kw ; Ka = Kw / Ka = 1.0 x 10-14 / 1.8 x 10-5 = 5.6 x 10-10
หมายเหตุ กรดอะซิติก (CH3COOH)
และแอมโมเนีย (NH3) เป็นกรด – เบส ที่มีค่า Ka = Kb คือ 1.8 x
10-5
แบบฝึกหัด
Content's Picture

Size : 72.30 KBs
Upload : 2013-07-28 07:17:00
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|