กรด-เบส ตอนที่ 1 ทฤษฎีกรด-เบส
กรด-เบส (Acid-Base)
ตอนที่
1 ทฤษฎีกรด-เบส
(Acid-Base
Theories)
ทฤษฎีกรด-เบสที่ควรทำความเข้าใจในขั้นนี้มี 3
ทฤษฎี ได้แก่
1. ทฤษฎีกรด-เบส ของอาร์รีเนียส
(The Arrhenius Theory of acids and bases) ( พ.ศ.2446)
อาร์รีเนียส
กล่าวว่า กรด คือสารที่แตกตัวให้ H+ เมื่อเกิดการละลาย
(Acids are substances
which produce hydrogen ions in solution.)
เบส คือสารที่แตกตัวให้ OH-
เมื่อเกิดการละลาย
(Bases are substances
which produce hydroxide ions in solution.)
* เมื่อ H+ ทำปฏิกิริยากับ OH- เรียกว่าปฏิกิริยาสะเทิน (Neutralisation) ทำให้ความเป็นกรด-เบสหมดไป กลายเป็นน้ำ
ดังสมการ ; H+(aq) + OH-(aq) → H2O(l)
* ตามทฤษฎีของอาร์รีเนียส H2O เป็นสารที่มีสมบัติเป็นกลาง แต่ในทฤษฎีอื่นจะพบว่า H2O อาจเป็นได้ทั้งกรดและแบส
ทฤษฎีกรดเบสของอาร์รีเนียสมีข้อบกพร่อง(Limitations of the theory)
ทำให้อธิบายความเป็นกรดหรือเบสได้ไม่ครอบคลุมทุกสถานการณ์ เช่น
ปฏิกิริยาดังสมการ
NaOH(aq) + HCl(aq)
→ NaCl(aq)
+ H2O(l)
NH3(aq) +
HCl(aq) → NH4Cl(aq)
ทฤษฎีของอาร์รีเนียสใช้อธิบายปฏิกิริยาระหว่าง NaOH กับ
HCl ได้โดยตรง
ทฤษฎีของอาร์รีเนียสสามารถอธิบายปฏิกิริยาระหว่าง NaOH กับ
HCl ได้โดยตรง เพราะการละลายของ NaOH ซึ่งเป็นเบส มีการแตกตัวให้ OH-
ตามที่กล่าวในทฤษฎี ดังสมการ
NaOH(s) → Na+(aq) + OH-(aq)
ขณะเดียวกันการละลายของ HCl ก็มีการแตกตัวให้ H+ จริงดังที่กล่าวไว้ในทฤษีเช่นกัน ดังสมการ
HCl(g) → H+(aq) + Cl-(aq)
เมื่อทำปฏิกิริยากันจะเป็นดังสมการ
Na+(aq) + OH-(aq) + H+(aq) + Cl-(aq) → H2O(l) + Na+(aq) + Cl-(aq)
เขียนเฉพาะการรวมตัวระหว่าง
OH- กับ H+ จะเป็นดังสมการ
OH-(aq) + H+(aq) → H2O(l)
*** สำหรับ
Na+ กับ Cl- จะไม่รวมตัวกันเป็น NaCl ในทันที
เพราะเป็นเกลือของโลหะอัลคาไลน์
ซึ่งมีสมบัติเป็นเกลือที่ละลายน้ำได้ดี
จนกว่าจะระเหยน้ำออกไปจนมีความเข้มข้นถึงจุดอิ่มตัว จึงจะเริ่มรวมตัวกันแล้วตกผลึก
(ลักษณะเดียวกับการทำนาเกลือ)
และถ้าระเหยน้ำออกไปจนหมด Na+ กับ Cl- ทั้งหมดจึงจะรวมตัวกันเป็นผลึก NaCl
แต่ปฏิกิริยาระหว่าง NH3 กับ HCl จะอธิบายด้วยทฤษฎีกรด-เบสของอาร์รีเนียสทั้งหมดไม่ได้ เพราะ NH3 ซึ่งเป็นเบส แต่ไม่ได้แตกตัวให้ OH- โดยตรง
ฉะนั้น NH3
จึงไม่ใช่เบสตามทฤษฎีของอาร์รีเนียส
ในขณะที่ HCl เป็นกรดตามทฤษฎีของอาร์รีเนียสเช่นเดิม ปฏิกิริยาที่เกิดขึ้นเป็นดังสมการ
NH3(aq) +
HCl(aq) → NH4Cl(aq)
ถ้าเขียนแสดงในรูปที่แตกตัวเป็นไอออนจะเป็นดังนี้
NH3(aq) + H+(aq + Cl-(aq) → NH4+(aq) + Cl-(aq)
ถ้าแสดงเฉพาะไอออนที่รวมตัวกันจริงจะเป็นดังนี้
NH3(aq) + H+(aq) → NH4+(aq)
จากกรณีดังกล่าวนี้และกรณีอื่น ๆ
ทำนองเดียวกันนี้อีกมากมาย ทำให้ทฤษฎีกรด-เบส ของอาร์รีเนียส อธิบายความเป็นกรดหรือเบสของอนุภาคบางอย่างไม่ได้ จึงมีการเสนอทฤษฎีกรด-เบสขึ้นมาใหม่
2. ทฤษฎีกรด-เบส ของบรอนสเต็ตและเลาว์รี (The Bronsted-Lowry Theory of acids and bases) (พ.ศ.2466)
ทฤษฎีนี้กล่าวว่า
กรด คือสารที่ให้โปรตอน (H+) แก่สารอื่น ( An acid is a proton (hydrogen ion) donor.)
เบส คือสารที่รับโปรตอน (H+) จากสารอื่น ( A base is a proton (hydrogen ion) acceptor.)
ความเป็นกรดตามทฤษฎีนี้เกี่ยวข้องกับการให้ H+
ทำนองเดียวกับทฤษฎีของอาร์รีเนียส
แต่ความเป็นเบสไม่ได้กล่าวถึง
OH-
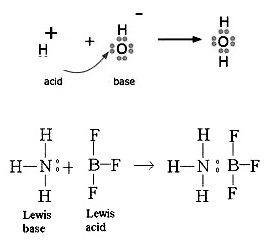
แต่หมายถึงใครก็ได้ที่รับ H+ ซึ่งพบว่า OH- ก็เป็นอนุภาคหนึ่งที่รับ H+ ได้เช่นกัน OH- จึงเป็นเบสชนิดหนึ่งด้วยตามทฤษฎีนี้ ดังรูป
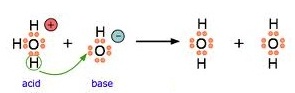
บางครั้งจะพบว่า
โมเลกุลหรืออนุภาคของสารบางชนิดมีสมบัติเป็นได้ทั้งกรดและเบส คือบางครั้งให้ H+ แต่บางครั้งรับ H+
โมเลกุลของ H2O ก็เช่นกัน เป็นได้ทั้งกรดและเบส ดังรูป
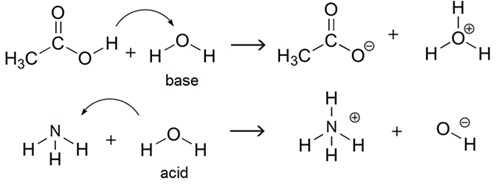
(คลิ้ก ชมวีดีทัศน์แสดงลักษณะของกรด-เบสของอาร์รีเนียสและบรอนสเตต-เลาว์รี )
(คลิ้ก ชมวีดีทัศน์แสดงลักษณะของกรด-เบสของบรอนสเต็ต-เลาว์รีและลิวอิส )
คู่กรด-เบส (Conjugate acid base
pair)
กรด-เบส
ตามทฤษฎีกรด-เบสของบรอนสเต็ตและเลาร์รี
จะพบได้มากในปฏิกิริยาระหว่างกรด-เบสที่ผันกลับได้
เราจะพบว่าผลิตภัณฑ์จากกรดของปฏิกิริยาไปข้างหน้า จะมีสมบัติเป็นเบสของปฏิกิริยาย้อนกลับ ในขณะที่ผลิตภัณฑ์จากเบสของปฏิกิริยาไปข้างหน้า จะมีสมบัติเป็นกรดของปฏิกิริยาย้อนกลับ กำหนดให้กรดของปฏิกิริยาไปข้างหน้ากับเบสของปฏิกิริยาย้อนกลับเป็นคู่กัน
และเบสของปฏิกิริยาไปข้างหน้ากับกรดของปฏิกิริยาย้อนกลับเป็นคู่กัน ดังรูป
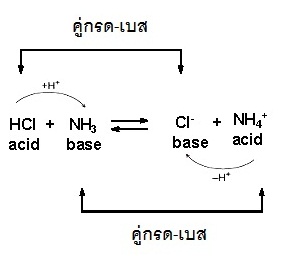
(คลิ้ก ชมวีดีทัศน์แสดงลักษณะของคู่กรด-เบส )
** กรด
กับคู่เบสของมันจะมีความแรงของกรด-เบสตรงข้ามกัน ถ้ากรดมีความแรงมาก คู่เบสจะมีความแรงของเบสน้อย แต่ถ้ากรดมีความแรงของกรดน้อย คู่เบสจะมีความแรงของเบสมาก
** เบส
กับคู่กรดของมันเป็นทำนองเดียวกัน
คือถ้าเบสมีความแรงมาก
คู่กรดจะมีความแรงของกรดน้อย
ถ้าเบสมีความแรงน้อยคู่กรดของมันจะมีความแรงของกรดมาก
3. ทฤษฎีกรด-เบสของลิวอิส (The Lewis Theory of
acids and bases) ( พ. ศ.2481)
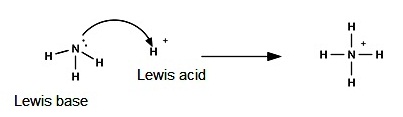
ลิวอิสกล่าวว่า กรด
คือสารหรืออนุภาคที่รับคู่อิเล้กตรอนจากสารหรืออนุภาคอื่น (An acid is an electron pair acceptor.)
เบส
คือสารหรืออนุภาคที่ให้คู่อิเล็กตรอนแก่สารอื่น (A base is an electron pair donor.)
ทฤษฎีกรด-เบสนี้ไม่กล่าวถึง
H+ และ OH- แต่ให้ดูที่การให้หรือรับคู่อิเล็กตรอนเป็นสำคัญ ซึ่งจะพบว่า H+
เป็นอนุภาคที่รับคู่อิเล็กตรอนได้ ฉะนั้น H+ จึงเป็นกรดตามทฤษฏีของลิวอิสด้วย สำหรับ OH- ก็เช่นกัน สามารถให้คู่อิเล็กตรอนแก่อนุภาคอื่นได้ ฉะนั้น
OH- จึงเป็นเบสตามทฤษฎีของลิวอิสเช่นกัน
การจำแนกประเภทของกรด-เบส
สามารถจำแนกกรด-เบสได้หลายแบบ ขึ้นอยู่กับว่าจะใช้เกณฑ์ใดในการจำแนก
เมื่อใช้เกณฑ์อย่างหนึ่งก็จะจำแนกได้รูปแบบหนึ่ง ดังนี้
1. จำแนกตามแหล่งกำเนิด
1.1
กรดอินทรีย์ คือกรดที่มีหมู่
carboxyl อยู่ในโมเลกุล (-COOH) กรดอินทรีย์เป็นกรดอ่อนทุกชนิด
1.2
กรดอนินทรีย์ คือกรดที่ไม่มีหมู่ carboxyl อยู่ในโมเลกุล จำแนกออกเป็น 2
ประเภทคือ
1.2.1 กรดธาตุคู่ (binary acid) หรือกรดไฮโดร (Hydro acid) คือกรดที่ประกอบด้วยธาตุเพียง 2
ธาตุในโมเลกุล คือไฮโดรเจน (H) และอโลหะอีกธาตุหนึ่ง (ยกเว้น O) ได้แก่ HF
HCl HBr HI H2S
1.2.2 กรดออกซี่ (oxyacid) คือกรดที่ประกอบด้วยธาตุจำนวน 3 ธาตุ
คือ H + อโลหะ + O เช่น
HNO3 H2SO4 H2CO3
การเรียกชื่อ
กรดธาตุคู่ให้เริ่มด้วยคำว่า ไฮโดร (Hydro ) แล้วลงท้ายด้วยชื่อของอโลหะที่เปลี่ยนเสียงคำท้ายเป็น อิก
เช่น
|
กรด
|
ชื่อ
|
|
HF
|
Hydro fluoric
|
|
HCl
|
Hydro Chloric
|
|
HBr
|
Hydro Bromic
|
|
HI
|
Hydro Iodic
|
|
H2S
|
Hydro sulfuric
|
|
HCN
|
Hydro cyanic
|
กรดออกซี่ (Oxyacid) ให้เรียกชื่อโดยใช้ชื่อของอโลหะที่อยู่ระหว่าง
H กับ O ซึ่งเปลี่ยนเสียงคำท้ายเป็น อิก เช่น H2CO3 เรียกว่ากรดคาร์บอนิก
แต่ถ้าอโลหะชนิดเดียวกันแต่อยู่ในโลเลกุลของกรดต่างชนิด เฃ่น
HNO2 HNO3 การเรียกชื่อให้ดูที่จำนวนอะตอมของ O ให้ใช้เสียง “อัส” กับชนิดที่มี O น้อย
ใช้เสียง “อิก” กับชนิดที่มี O มาก
NHO2 เรียกว่า กรดไนตรัส
HNO3 เรียกว่า กรดไนตริก
|
กรด
|
ชื่อ
|
|
HNO2
|
nitrus acid
|
|
HNO3
|
nitric acid
|
|
H2SO3
|
sulfurus acid
|
|
H2SO4
|
sulfuric acid
|
|
H3PO3
|
phosphorus acid
|
|
H3PO4
|
phosphoric acid
|
|
H2CO3
|
carbonic acid
|
|
HClO
|
hypochlorous acid
|
|
HClO2
|
chlorous acid
|
|
HClO3
|
chloric acid
|
|
HClO4
|
perchloric acid
|
|
|
|
*** กรดกัดทอง (aqua
regea) เป็นส่วนผสมระหว่างกรด
HCl และกรด HNO3 ในอัตราส่วน 3:1
2. จำแนกกรดโดยดูจากจำนวนครั้งในการแตกตัวให้ H+ จำแนกออกเป็น
2 ประเภท คือ
2.1
กรดโมโนโปรติก (monoprotic) คือกรดที่แตกตัวให้ H+ เพียง 1 ครั้ง เช่น HCl
HBr HI HNO3 …
2.2
กรดโพลิโปรติก (poly protic) คือกรดที่แตกตัวให้
H+ มากกว่า 1 ครั้ง เช่น H2SO4 H3CO3 H2S…
3. จำแนกกรดโดยดูจากความแรงของกรด หรือความสามารถในการแตกตัวของกรด
จำแนกออกเป็น 2 ประเภทคือ
3.1
กรดแก่ (strong acid) คือกรดที่เมื่อเกิดการละลายแล้วจะแตกตัวเป็นไอออนได้
100 % มี 7 ชนิด
และมีลำดับความแรงดังนี้ HClO4>HI>HBr>HCl>H2SO4>HNO3>HClO3
3.2
กรดอ่อน (weak acid) คือกรดที่มีความแรงของกรดน้อย
เมื่อเกิดการละลายจะมีการแตกตัวเพียงเล็กน้อย และเกิดภาวะสมดุล กรดอ่อนมีอยู่เป็นจำนวนมาก ได้แก่
กรดอินทรีย์ทุกชนิด
รวมทั้งกรดอนินทรีย์ที่ไม่ใช่กรดแก่
เช่น H2CO3
H2SO3 …
***สำหรับกรด H2SO4 นั้นเป็นกรดแก่เมื่อแตกตัวครั้งที่
1 คือแตกตัว 100 % ดังนี้
H2SO4 → H+
+ HSO4-
แต่เมื่อแตกตัวครั้งที่ 2
จะมีสมบัติเป็นกรดอ่อน ดังนี้
HSO4- ↔ H+ + SO42- ; Ka
= 1.20 x 10-2
สำหรับกรณีของเบสไม่มีการจำแนกว่าเป็นอินทรีย์หรืออนินทรีย์
แต่มีการจำแนกออกเป็นเบสอ่อนและเบสแก่ทำนองเดียวกับการจำแนกกรด เบสแก่
เมื่อเกิดการละลายจะแตกตัว 100
% เบสแก่มี 8
ชนิดและมีลำดับความแรงดังนี้
KOH > Ba(OH)2 > CsOH > NaOH
> Sr(OH)2 > Ca(OH)2 > LiOH > RbOH
เบสอ่อน
คือเบสที่มีความแรงน้อย
เมื่อละลายจะแตกตัวเพียงเล็กน้อยแล้วเกิดภาวะสมดุลทำนองเดียวกับกรดอ่อน เช่น NH3 หรือ NH4OH
ไอออนสำคัญในสารละลายกรดหรือเบส
การที่กรดชนิดต่าง ๆ
มีสมบัติโดยรวมเป็นทำนองเดียวกัน เป็นเพราะในสารละลายของกรดแต่ละชนิด มีอนุภาคชนิดเดียวกันละลายอยู่คือ H+ หรือ H3O+ เช่น
HCl → H+
+ Cl-
หรือ HCl + H2O → H3O+
+ Cl-
H2SO4
→ H+ + HSO4-
หรือ H2SO4 + H2O
→ H3O+
+ HSO4-
HNO3 → H+
+ NO3-
หรือ HNO3 + H2O → H3O+
+ NO3-
CH3COOH → H+ +
CH3COO-
หรือ CH3COOH + H2O → H3O+
+ CH3COO-
สำหรับกรณีของเบส ต่างก็จะมี
OH- ละลายอยู่เช่นกันดังตัวอย่าง
NaOH → Na+ + OH-
KOH → K+ + OH-
Ca(OH)2 → Ca2+ + 2OH-
NH4OH → NH4+ +
OH-
แบบฝึกหัด
1. Summarize the three main acid-base theories in the
table below. (จงเติมสมบัติของกรด-เบสอย่างย่อ ๆ
ของแต่ละ
ทฤษฎีลงในตาราง)
|
|
ACID
|
BASE
|
|
Arrhenius
|
H+ or H3O+ producer
in aqueous solution
|
OH – producer in aqueous
solution
|
|
Brønsted-Lowry
|
proton (H+) donor
|
proton (H+) acceptor
|
|
Lewis
|
electron-pair acceptor
|
electron-pair donor
|
Use the
following chemical equations to answer question 2. (ใช้สมการเคมีนี้ตอบคำถามข้อ 2 )
HCl + H2O → H3O+ + Cl
–
NH3 + H2O ↔ NH4+ + OH –
2. According to Arrhenius, HCl would be
classified as a(n) acid
and NH3 would be classified as
a(n) base . Explain why. (ตามทฤษฎีของอาร์รีเนียสแล้ว HCl
NH3
เป็นกรดหรือเบส จงอธิบาย)
HCl produces hydronium
ions (H3O+) in water.
NH3 produces hydroxide ions (OH –) in water.
For problems
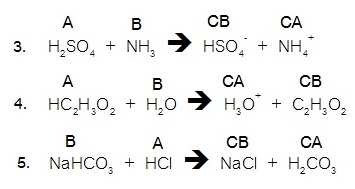
3 – 5, label the acid (A), base (B), conjugate acid (CA), and conjugate base
(CB) in each of the following reactions.
Show the transfer of the proton (H+) by drawing an arrow. (จากคำถามข้อ 3-5
ให้สังเกตทิศทางของลูกศรซึ่งเป็นทิศทางของการถ่ายเทโปรตอน จงแสดงความเป็นคู่กรด-เบส ระหว่างกรด
(A) และเบส (B) ว่าเป็นคู่กับ CA และ
CB อย่างไร
For problems
6 – 9, give the conjugate base for each Brønsted-Lowry acid.
(สำหรับคำถามข้อ 6-9
จงแสดงคู่เบสของกรดแต่ละชนิดตามทฤษฎีของ
Brønsted-Lowry )
6. HI
8.
NH4+
7. H2CO3
9.
HNO3
For problems
10 – 13, give the conjugate acid for each Brønsted-Lowry base.
(สำหรับคำถามข้อ 10-13
จงแสดงคู่กรดของเบสแต่ละชนิดตามทฤษฎีของ
Brønsted-Lowry )
10. CN –
11.
O2–
12.
CH3COO
–
13.
NH3
Use the following
diagram to answer question 14. (จงใช้แผนภาพต่อไปนี้ตอบคำถามข้อ 14)
14. The Lewis acid in the above equation is(สารที่เป็นกรดตามทฤษฎีของลิงอิสคือ) .
The Lewis base is(สารที่เป็นเบสตามทฤษฎีของลิวอิสคือ) .
Explain why.
(จงอธิบายด้วยว่าเป็นเพราะเหตุใด)
15. Classify
these as an Arrhenius acid or Arrhenius base.
(จงจำแนกว่าสารที่กำหนดให้ต่อไปนี้เป็นกรดหรือเบสตามทฤษฎีของอาร์รีเนียส)
- Ca(OH)2 _______________________
- HNO3
_______________________
- HC2H3O2
_____________________
- H2SO4
_______________________
- KOH
_______________________
- HCl
_____________________
16. Complete the
equations for the Ionization of these Arrhenius acids or bases in water:
(จงทำสมการแสดงการละลายน้ำของกรดหรือเบสของอาร์รีเนียสให้สมบูรณ์๗
ex:
HBr + H2O → H3O+ + Br-
ex: KOH → K+
+ OH-
- HNO3 + H2O →
- NaOH →
- HCl + H2O ↔
- Ca(OH)2 →
17.Identify the Bronsted-Lowry acid (loses
an H+ ion), base (gains an H+ ion), conjugate
acid, and the
conjugate base in each of the following.
(จงระบุอนุภาคที่เป็นคู่กรด-เบสของกันและกัน ตามทฤษฎีของบรอนส
เต็ตและเลาว์รี ในแต่ละปฏิกิริยาต่อไปนี้)
a. HNO3 + H2O ↔ H3O+ + NO3-
b. NH3 + H2O
↔ NH4+ + OH-
c. H2SO4 + OH-↔ HSO4- + H2O
d. C2H3O2– + H2O ↔ OH- + HC2H3O2
e. H2PO4-
OH-↔ HPO4-2 + H2O
f. H2PO4-
+ H3O+ ↔ H3PO4 + H2O
g. HCO3– +
H2O ↔ H3O+ + CO32-
h. HCO3– + H2O ↔ H2CO3 + OH-
18 .What is the conjugate acid of the
following: (particle made by adding an H+ ion)
(คู่กรดของสารที่กำหนดในแต่ละข้อคือสารใด)
a.
C2H3O2-_________
b. CO32-
_________
c. Cl- _________
d. HCO3-
_________
e. H2PO4-
_________
19. What is the
conjugate base of the following: (particle made by removing an H+
ion)
(คู่เบสของสารที่กำหนดในแต่ละข้อคือสารใด)
a. NH4+ _________
b. H2CO3
_________
c. H2O _________
d. HCO3-
_________
e. H2PO4-
_________
20.Using your knowledge of the Brønsted-Lowry
theory of acids and bases, write equations for the following
acid-base reactions and indicate each conjugate acid-base pair:
(จงเขียนสมการแสดงปฏิกิริยาระหว่างกรด-เบสต่อไปนี้ให้สมบูรณ์ ตามทฤษฎีของบรอนสเต็ตและเลาว์รี และระบุด้วย
ว่าอนุภาคใดเป็นคู่กรด-เบสซึ่งกันและกัน)
a. HNO3 + OH- ↔
b. CH3NH2 + H2O ↔
c. OH- + HPO42- ↔
21. In the following reactions,
identify the Lewis acid and the Lewis base.
(จากปฏิกิริยาต่อไปนี้จงระบุว่าอนุภาคใดเป็นกรดและเบส ตามทฤษฎีของลิวอิส)
a.
Ag+ + 2NH3 ↔
Ag(NH3)2+
b. B(OH)3
+ H2O ↔ B(OH)4
+ H+
22. How
do Lewis acids and bases compare to the Arrhenius and Bronsted-Lowry
definitions of an acid and a
base? (นิยามของกรด เบส ตามทฤษฎีของลิวอิส
เมื่อเปรียบเทียบกับของอาร์รีเนียสและของบรอนสเต็ต-เลาว์รีแล้ว
เป็นอย่างไร)
23. The
compound NaOH is a base by all three of the theories we discussed in
class. However, each of the
three theories describes what a base is in different
terms. Use your knowledge of these three
theories to
describe NaOH as an Arrhenius base, a Brønsted-Lowry
base, and a Lewis base.
( NaOH มีสมบัติเป็นเบสตามทฤษฎีกรด
เบส ทั้ง
3 ทฤษฎี ทั้งที่แต่ละทฤษฎีมีนิยามของคำว่าเบสต่างกัน จง
อธิบายว่า NaOH เป็นเบสตามแต่ละทฤษฎีด้วยเหตุผลใด)
24. Write the names for the
following acids and bases:
a) KOH
_______________________________________
b) H2Se
_______________________________________
c) HC2H3O2
(vinegar)_______________________________
d) Fe(OH)2
____________________________________
e) HCN ____________________________________
f) HCO3
_____________________________________
g)
LiOH
______________________________________
h)
RbOH
___________________________________
i)
HClO3
______________________________________
25. Write the formulas for
the following chemical compounds.
a) calcium hydroxide
__________________________________
b) hydrofluoric acid
___________________________________
c) hydroiodic acid
____________________________________
d) phosphoric acid
___________________________________
e) barium hydroxide
__________________________________
f) sodium
hydroxide __________________________________
g)
sodium hypochlorite (bleach)
_________________________
h)
perchloric acid
____________________________________
Content's Picture

Size : 9.50 KBs
Upload : 2013-07-28 07:18:14
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|