ไอออนที่เกิดขึ้นจากการถ่ายเทอิเล็กตรอนกันนี้ ในที่สุดจะรวมตัวกันเป็นสารประกอบไอออนิก เช่น Na+ กับ Cl- รวมตัวกันเป็น NaCl
หรือ Ca2+ กับ 2Cl- รวมตัวกันเป็น CaCl2 หรือ Na+ กับ F- รวมตัวกันเป็น NaF ประจุของไอออนจะหักล้างกันหมดพอดี แต่ในบางกรณีอาจมีประจุเหลืออยู่ก็ได้
(คลิ้ก ชมการถ่ายเทอิเล็กตรอนระหว่าง Na กับ F)
ถ้าเราทราบว่าอะตอมมีการถ่ายเทอิเล็กตรอนกันกี่ตัว เราจะบอกได้ว่าเลขออกซิเดชันเปลี่ยนแปลงไปเท่าไรได้โดยตรง แต่ถ้าเราไม่ทราบจำนวนอิเล็กตรอนที่ถ่ายเทกัน
การหาเลขออกซิเดชันที่เปลี่ยนแปลงจะยากขึ้น แต่มีวิธีหาได้ คือธาตุอยู่จำนวนหนึ่งที่มีเลขออกซิเดชันคงที่
หมายความว่าไม่ว่าจะเกิดปฏิกิริยากับธาตุใด หรืออยู่ในสารประกอบใด ก็จะมีเลขออกซิเดชันเท่าเดิมทุกครั้ง (fix oxidation state) จึงมีสมบัติเสมือนหนึ่งเป็นค่าคงที่ (constant)
ในขณะเดียวกันก็จะมีธาตุอีกกลุ่มหนึ่งที่มีเลขออกซิเดชันไม่คงที่ (variable oxidation state) จึงมีสมบัติเสมือนหนึ่งเป็นตัวแปร (variable)
ธาตุประเภทนี้จะมีเลขออกซิเดชันได้หลายค่า เกิดสารประกอบได้หลายชนิด ส่วนใหญ่จะเป็นโลหะแทรนซิชัน หรืออโลหะจำพวก C N
S P Cl Br I แต่ในที่สุดแล้วทั้งธาตุที่มีเลขออกซิเดชันคงที่และธาตุที่มีเลขออกซิเดชันไม่คงที่ ก็จะรวมอยู่ในสารประกอบเดียวกัน
เราจึงหาเลขออกซิเดชันของธาตุที่ไม่คงที่โดยอาศัยเลขออกซิเดชันของธาตุซึ่งคงที่ด้วยวิธีทางสมการได้ ทำนองเดียวกับสมการในคณิตศาสตร์
*** สารประกอบบางชนิดธาตุ เดียวกันที่อยู่ในสารปะกอบนั้น ๆ อาจมีเลขออกซิเดชันมากกว่า 1 ค่า เช่น Fe3O4
(คลิ้ก ชมธาตุโลหะที่มี Oxidation state คงที่และไม่คงที่)
หลักการหาเลขออกซิเดชัน
1. ธาตุอิสระหรือธาตุบริสุทธิ์ทั้งในรูปอะตอมและโมเลกุลมีเลขออกซิเดชันเท่ากับ 0 เช่น Na , Cl ,O2 , O3 , P4 , S8 , C60 F2
Cl2 Br2 I2 (คำว่าธาตุอิสระหรือธาตุบริสุทธิ์คือธาตุที่ยังไม่ทำปฏิกิริยากับธาตุอื่น )
2. โลหะแอลคาไล (alkali metal = หมู่ IA) และโลหะแอลคาไลน์เอิร์ท ( alkali earth = หมู่ IIA) เมื่ออยู่ในสารประกอบ ต่างๆ
มีเลขออกซิเดชันเป็น +1 และ +2 ตามลำดับ
3. H เมื่ออยู่ในสารประกอบของอโลหะมีเลขออกซิเดชัน +1 เมื่ออยู่ในสารประกอบของโลหะ (ไอไดรของโลหะ ) เช่น NaH CaH2 ธาตุ H
มีเลขออกซิเดชัน -1
** ไฮโดรเจน มีเลขออกซิเดชันได้ทั้ง 3 แบบ คือ เป็นลบ เป็นศูนย์ และเป็นบวก (-1 , 0 , +1)
4. O เมื่ออยู่ในสารประกอบปกติมีเลขออกซิเดชัน -2 เช่น ใน H2O K2O
* เมื่อในสารประกอบเปอร์ออกไซด์ (peroxide) คือมีออกซิเจนเป็น 2 เท่าของออกไซด์ปกติ มีเลข
ออกซิเดชัน -1 เช่น H2O2 K2O2
* เมื่ออยู่ในสารประกอบซุเปอร์ออกไซด์ (superoxide) คือมีออกซิเจนเป็น 4 เท่าของออกไซด์ปกติ เช่น KO2
หรือ K2O4 มีเลขออกซิเดชัน -1/2
* เมื่ออยู่ใน OF2 เลขออกซิเดชันของ O = +2 (สารเดียวเท่านั้น)
** ออกซิเจน มีเลขออกซิเดชันได้ทั้ง 3 แบบ คือ เป็นลบ เป็นศูนย์ และเป็นบวก
5. ธาตุฮาโลเจนหรือธาตุหมู่ 7A( F Cl Br I ) เมื่ออยู่ในสารประกอบธาตุคู่ จะมีเลขออกซิเดชัน -1
เช่น HF HCl HBr HI NaF NaCl NaBr NaI แต่ถ้าอยู่ในสารประกอบที่มีมากกว่า 2 ธาตุ เลขออกซิเดชันไม่
แน่นอน เช่น HClO HClO2 HClO3 HClO4 เลขออกซิเดชันของ Cl เท่ากับ +1 +3 +5 และ +7
ตามลำดับ
6. F ไม่ว่าจะอยู่ในสารประกอบใด ๆ มีเลขออกซิเดชันเพียงค่าเดียวคือ -1
7. เลขออกซิเดชันของไอออนอะตอมเดี่ยวมีค่าเท่ากับประจุของไอออนนั้น เช่น
Na+ มีเลขออกซิเดชันเท่ากับ +1
Ca2+ มีเลขออกซิเดชันเท่ากับ +2
Cl- มีเลขออกซิเดชันเท่ากับ -1
O2- มีเลขออกซิเดชันเท่ากับ -2
** กำหนดให้เขียนแสดงไอออนกับเลขออกซิเดชันต่างกัน คือ ไอออน ให้เขียนตัวเลขไว้หน้าเครื่องหมาย + หรือ –
เช่น 2+ หรือ 2- เลขออกซิเดชันให้เขียนเครื่องหมายไว้หน้าตัวเลข เช่น +2 หรือ -2
สำหรับไอออนที่เป็นกลุ่มอะตอม จะมีผลรวมของเลขออกซิเดชันของทุกธาตุในไอออนนั้น เท่ากับประจุของไอออน เช่น SO42- ผลรวมของเลขออกซิเดชันของ S จำนวน
และ O เท่ากับ -2 (อะตอมของธาตุ S มี 1 อะตอม อะตอมของ O มี 4 อะตอม )
เขียนสมการว่า S + 4O = -2
8. สมการแสดงผลรวมของเลขออกซิเดชันของสารหรืออนุภาคใดๆ จะอยู่ในรูปแบบดังนี้
ผลรวมของเลขออกซิเดชันของทุกอะตอมในอนุภาค = ประจุไฟฟ้าของอนุภาค
ตัวอย่าง อนุภาคที่เป็นกลาง เช่น KNO3 KMnO4 KCrO4 K2Cr2O7 K2[Fe(CN)6] รูปสมการจะเป็นดังนี้
KNO3 ; รูปสมการ
; K +N +3O = 0
KMnO4 ; รูปสมการ
; K + Mn + 4O = 0
KCrO4 ; รูปสมการ
; K+ Cr + 4O = 0
K2Cr2O7 ; รูปสมการ
; 2K + 2Cr +7O = 0
K2[Fe(CN)6] ; รูปสมการ
; 2K + Fe + 6CN- = 0
หรือ 2K + 6C + 6N- = 0
ตัวอย่าง
อนุภาคที่เป็นไอออนลบ เช่น CN- SO42- CO32- PO43- รูปสมการจะเป็นดังนี้
CN- ; รูปสมการ ; C + N = -1
SO42- ; รูปสมการ ; S + 4O = -2
CO32- ; รูปสมการ ; C + 3O = -2
PO43- ; รูปสมการ ; P + 4O = -3
ตัวอย่าง
อนุภาคที่เป็นไปออนบวก เช่น NH4+ รูปสมการจะเป็นดังนี้
NH4+ ; รูปสมการ ; N + 4H = +1
ตัวอย่าง จงหาเลขออกซิเดชันของอะตอมที่ขีดเส้นใต้ KMnO4 K2Cr2O7 MnO4-
วิธีทำ KMnO4 สมการเป็นดังนี้ K + Mn + 4O = 0
+1 + Mn + 4 (-2) = 0
+1 + Mn -8 = 0
Mn = +7 ตอบ
K2Cr2O7 สมการเป็นดังนี้ 2K + 2Cr +7O = 0
2 (+1) +2Cr + 7 (-2) = 0
+2 + 2Cr -14 = 0
2Cr = +12
Cr = +6 ตอบ
MnO4- สมการเป็นดังนี้ ; Mn + 4O = -1
Mn + 4(-2) = -1
Mn - 8 = -1
Mn = +7 ตอบ
(คลิ้ก ศึกษาเพิ่มเติมเรื่องเลขออกซิเดชัน)
ตารางแสดงเลขออกซิเดชันของธาตุต่าง ๆ เมื่ออยู่ในสารประกอบ
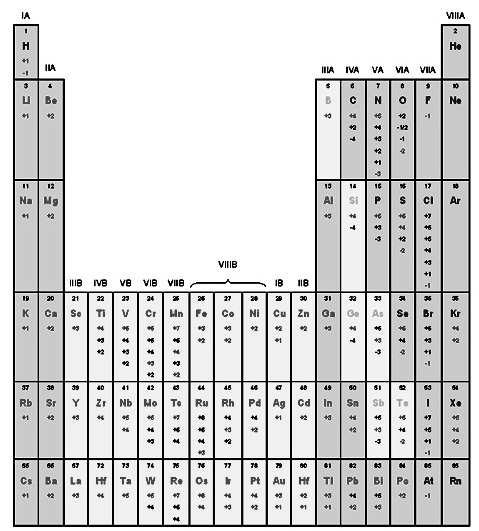
** สังเกต
ธาตุแทรนซิชันส่วนมากมีเลขออกซิเดชันหลายค่า แต่ธาตุแทรนซิชันบางธาตุมีเลขออกซิเดชันค่าเดียว ได้แก่
ธาตุแทรนซิชันหมู่ 3B มีเลขออกซิเดชัน +3 ค่าเดียว ; Ag = +1 ; Ni =+2 ; Zn = +2 ; Cd = +2
การหาเลขออกซิเดชันโดยสังเกตไอออนที่เป็นกลุ่มอะตอม
ถ้าสารประกอบมีไอออนที่เป็นกลุ่มอะตอม (polyatomicion) เป็นส่วนประกอบ ถ้าเราทราบประจุของไอออนจะช่วยให้หาเลขออกซิเดชันได้ง่ายขึ้น เช่น
ต้องการหาเลขออกซิเดชันของ Cr ใน Cr(NH3)4SO4
วิธีเดิม Cr(NH3)4SO4
Cr+ 4N +12H + S + 4O = 0
Cr + 4(-3) + 12(+1) + 6 + 4(-2) = 0
Cr -12 + 12 +6 -8 = 0
Cr = +2
วิธีใช้กลุ่มไอออน
Cr(NH3)4SO4
Cr + 4(NH3)+ (SO42-) = 0
Cr + 4(0) + (-2) = 0
Cr - 2 = 0
Cr = +2
ไอออนชนิดกลุ่มอะตอมที่ควรทราบ
|
ไอออนที่เป็นกลุ่มอะตอม
|
ชื่อ
|
ไอออนที่เป็นกลุ่มอะตอม
|
ชื่อ
|
|
NH4+
|
แอมโมเนียมไอออน
|
MnO4-
|
เปอร์แมงกาเนตไอออน
|
|
CN-
|
ไซยาไนด์ไอออน
|
Cr2O72-
|
ไดโครเมตไอออน
|
|
NO2-
|
ไนไตรต์ไอออน
|
CrO42-
|
โครเมตไอออน
|
|
NO3-
|
ไนเตรตไอออน
|
[Fe(CN)6]3-
|
เฮกสะไซยาโนเฟอร์เรต(III)ไอออน
|
|
HSO4-
|
ไฮโดรเจนซัลเฟตไอออน
|
AsO43-
|
อาร์ซิเนตไอออน
|
|
SO42-
|
ซัลเฟตไอออน
|
BO33-
|
โบเรต
|
|
SO32-
|
ซัลไฟต์ไอออน
|
B2O54−
|
ไดโบเรต
|
|
S2O32-
|
ไทโอซัลเฟตไอออน
|
ClO-
|
ไฮโปคลอไรต์ไอออน
|
|
H2PO4-
|
ไดไฮโดรเจนฟอสเฟตไอออน
|
ClO2-
|
คลอไรต์ไอออน
|
|
HPO42-
|
ไฮโดรเจนฟอสเฟตไอออน
|
ClO3-
|
คลอเรตไอออน
|
|
PO43-
|
ฟอสเฟตไอออน
|
ClO4-
|
เปอร์คลอเรตไอออน
|
|
HCO3-
|
ไฮโดรเจนคาร์บอเนตไอออน
|
OH-
|
ไฮดรอกไซดด์ไอออน
|
|
CO32-
|
คาร์บอเนตไอออน
|
|
|
แบบฝึกหัด
1. (Ent.42มี.ค.)เลขออกซิเดชันของโลหะแทรนซิชันในสารประกอบต่อไปนี้
[Cr(NH3)4SO4] [Fe(H2O)5(OH)]Cl2 และ K2[PtCl4] เป็นดังข้อใดตามลำดับ
1. 2 2 3 2. 2 3 2 3. 3 3 2 4. 3 3 3
2. (Ent.42 ต.ค.) ถ้าเลขอะตอมของ X และ Y เท่ากับ 31 และ 38 ตามลำดับ เลขออกซิเดชันของธาตุทั้งสองควรเป็นเท่าใดในสารประกอบ และสารประกอบระหว่าง X
และ Y ควรมีสูตรเป็นอย่างไร
1.+3 +2 ไม่เกิด 2. -5 +2 Y5X2 3. -3 +2 Y3X2 4. +3 -2 X2Y3
3. (Ent.43 มี.ค.)เลขออกซิเดชันของโลหะอะตอมกลางในข้อใด ต่อไปนี้ มีค่าสูงกว่า +2
1. [Cu(CN)4]2- 2. [CrCl6]4- 3. [Ni(NH3)4]2+ 4. [Fe(CN)6]3-
4. (Ent.43 มี.ค.) โลหะแทรนซิชันในสารประกอบใดที่เรียงลำดับเลขออกซิเดชันจากมากไปน้อย
1. ZnO Cr2O3 WO3 2. MoO3 TiO2 Mn2O7
3.MnO2 Fe2O3 Cu2O 4. K3Fe(CN)6 K2Cr2O7 KMnO4
5. (Ent.43 มี.ค.) พิจารณาค่าพลังงานไอออไนเซชันของอลูมิเนียมดังต่อไปนี้
Al(g) → Al+(g) + → IE1 = 0.584 MJ/mol
Al+(g) → Al2+(g) + e- IE2 = 1.823 MJ/mol
Al2+(g) → Al3+(g) IE3 = 2.751 MJ/mol
Al3+(g) → Al4+(g) IE4= 11.584 MJ/mol
ข้อสรุปใดผิด
- การที่ค่า IEของอลูมิเนียมเพิ่มจาก IE1-IE4แสดงว่าอิเล็กตรอนตัวที่ 1 อยู่ใกล้กับนิวเคลียสมากกว่าตัวที่ 2 3 4 ตามลำดับ
- การที่ค่า IE3 และIE4แตกต่างกันมากแสดงว่าอิเล็กตรอนที่หลุดออกไปเป็นอิเล็กตรอนต่างกลุ่มกัน
- ขนาดของไอออนจะเล็กลงตามลำดับ Al+ >Al2+ >Al3+ > Al4+
- อลูมิเนียมควรมีเลขออกซิเดชันเท่ากับ +3 เมื่ออยู่ในสารประกอบ
6. (Ent.43ต.ค.) กำหนดสูตรเคมีต่อไปนี้ CaF2 . 3Ca3(PO4)2 Sb2S3.3H2O Na2ZrSiO5 ถ้าเลขออกซิเดชันของ Si = +4 พิจารณาเลขออกซิเดชันในข้อต่อไปนี้
ก. เลขออกซิเดชันของ Pสูงกว่า +3 และของ Sb ต่ำกว่า +5
ข. เลขออกซิเดชันของ Sb สูงกว่า +2 และของ Zr ต่ำกว่า +1
ค. เลขออกซิเดชันของ Zr สูงกว่า +1 และของ P เท่ากับ+5
ง. เลขออกซิเดชันของ Zr เท่ากับ 0 และของ Sb สูงกว่า +3
ข้อใดผิด
1. ก ข 2. ก ค 3. ข ง 4. ค ง
7.(Ent.44 มี.ค.) ผลรวมของเลขออกซิเดชันของอะตอมกลางในข้อใดที่มีค่ารวมกันน้อยที่สุด
1. K4[Fe(CN)6] K3[Fe(CN)6] [Ag(NH3)2)Cl
2. [Ag(NH3)2]Cl K2[Ni(CN)4] [Cr(H2O)6]SO4
3. [Fe(H2O)6]Cl2 [Ag(NH3)2]Cl K2Cr2O7
4. K3[Fe(CN)6] K2[Ni(CN)4] K4[Fe(CN)6]
8. (Ent.45 ต.ค.) เลขออกซิเดชันของ P S และ Zr ในสารประกอบ 3 ชนิดต่อไปนี้เป็นเท่าใดตามลำดับ
NaNH4HPO4.4H2O Na2S2O3.5H2O ZrCl2O.8H2O
9. (A-net. 48) ข้อใดเรียงลำดับเลขออกซิเดชันของโลหะแทรนซิชันในสารประกอบจากมากไปน้อยได้ถูกต้อง
1. [Co(NH3)4Cl2]Cl K2Cr2O7 Na2[Ni(CN)4]
2. K3[Fe(CN)6] Na[Au(CN)2] [Co(NH3)4Cl2]Cl
3. Na[Au(CN)2] K2Cr2O7 K3[Fe(CN)6]
4. [Co(NH3)4Cl2]Cl K2[Ni(CN)4] Na[Au(CN)2]
10. (คัดเลือกเคมีโอลิมปิค 44) ธาตุแทรนซิชันในข้อใดมีเลขออกซิเดชันเท่ากับ +3
1. [Pd(NH3)4Cl2] 2. (PH4)2[Fe(H2O)Cl5]
3. Cu2CO3(OH)2 4. K[Au(CN)2]
11. (คัดเลือกเคมีโอลิมปิค 43) ข้อใดถูกต้องในการเรียงลำดับเลขออกซิเดชันของอะตอมที่ขีดเส้นใต้ในโมเลกุลหรือ
ไอออน จากค่าสูงสุดไปหาค่าต่ำสุด
1. NaCl NaClO NaClO2 2. SO42- SO2 S8
3. (NH4)2Cr2O7 Cr2O3 CrO42- 4. MnO2 Mn2O3 MnO4-
13. (คัดเลือกเคมีโอลิมปิค 45)สารประกอบในข้อใดมีธาตุที่แสดงเลขออกซิเดชันสูงกว่าธาตุในข้ออื่น ๆ
1. VF5 2. K3[Mn(CN)6] 3. Na2SO4 4. [NH4][PF6]
14. (คัดเลือกเคมีโอลิมปิค 46) ไอออนหรือสารประกอบใดต่อไปนี้ที่เฮโลเจนมีเลขออกซิเดชันเป็น+5
1. ICl4- 2. ClF3 3. IO3- 4. HIO2
15. (คัดเลือกเคมีโอลิมปิค 46) สารประกอบเชิงซ้อนในข้อต่อใดไปนี้ โลหะแทรนซิชันในสารประกอบทุกชนิดมีเลขออกซิเดชันเท่ากัน
1. [Cr(H2O)5Cl]SO4 , [Co(NH3)4SO4]NO3 , K4[Fe(CN)6]
2. [Ni(CN)4]2- , [Co(H2O)2(NH3)4]2+ , [Cr(NH3)4(Cl)2]
3. Na[Au(CN)2] , [Ti(H2O)6]3+ , [Cr(NH3)4(Cl)2]+
4. [Cr(H2O)4Br2]+ , [Co(NH3)6]SO4 , [AuCl2]-
16. (PAT.2 ต.ค.52) ธาตุคาร์บอนคู่ที่มีค่าเลขออกซิเดชันแตกต่างกันน้อยที่สุดเป็นของโมเลกุลในข้อใด
1. CH3CH2Br 2. CH3CHO 3. CH3CN 4. CH3CH2Cl
17. (PAT.2 ก.ค.53) ผลรวมของเลขออกซิเดชันของธาตุแทรนซิชันคู่ใดมีค่าต่ำสุด
1. [FeSCN]2+ กับ [Ni(NH3)6]Br2 2. [Fe(CN)6]3- กับ [Cu(NH3)4]SO4
3. K4[Ni(CN)4] กับ K3[Fe(CN)6] 4. K4[Fe(CN)6] กับ [CoCl(NH3)5]2+
Appeddix
1. Which element will never have a positiveoxidation number? (ธาตุใดไม่มีเลขออกซิเดชันที่มีค่าเป็นบวก)
a. fluorine b.oxygen c.sodium d.iodine.
2. Give theoxidation numbers of all the elements in the following molecules and ions: (จงบอกเลขออกซิเดชันของแต่ละธาตุในโมเลกุลหรือไอออนต่อไปนี้)
a. SO , SO2 , SO3 , SO32-, SO42- b. ClO2 , ClO -, ClO2-, ClO3- , ClO4-
c. N2O , NO , NO2 , N2O4, N2O5 , NO2- , NO3-
3. Determine the oxidation number of the sulfuratom: (จงบอกเลขออกซิเดชันของซัลเฟอร์ในสารเหล่านี้)
a. H2S b. S c.H2SO4 d. S2- e. HS-
f.SO2 g. SO3
4. Indicate the oxidation number of phosphorusin each of the following compounds: (จงหาเลข ออกซิเดชันของฟอสฟอรัสในสารประกอบต่อไปนี้)
a.HPO3 b. H3PO4 c.H3PO2 d. H4P2O7 e. H3PO3 f. H5P3O10
5. Give oxidation numbers for the underlined atoms in these molecules and ions: (จงหาเลขออกซิเดชันของอะตอมที่ขีดเส้นใต้ในโมเลกุลหรือไอออนต่อไปนี้)
a.Cs2O b.PtCl62- c.CaI2 d.SnF2 e.Al2O3
f.ClF3 g.H3AsO3 h.SbF6 i.TiO2 j.P4
k.MoO42- l.MnO4- m.PtCl42- n. O2 o. O3
6. Assign oxidation numbers to each atom in NiCl2 , Mg2TiO4, K2Cr2O7 , SO32-. (จงบอกเลขออกซิเดชันของแต่ละธาตุในสารต่อไปนี้)
7. Assign oxidation numbers to the underlinedatoms. (a) ClO4- , (b) CrCl3 , (c) SnS2 , (d) Au(NO3)3.
(จงหาเลขออกซิเดชันของอะตอมที่ขีดเส้นใต้ในโมเลกุลหรือไอออนต่อไปนี้)
8.Assign oxidation numbers to the elements in the following: (a) Ca(VO3)2 , (b) SnCl4 , (c) MnO4- , (d) MnO2. (จงหาเลขออกซิเดชันของแต่ละธาตุในสารต่อไปนี้)
9. Molybdenum disulphide,MoS2, has a structure that allows it to behave as a dry lubricant,much like graphite. What are theoxidation numbers of the atoms in MoS2?
(โมลิบดินัมไดซัลไฟด์,MoS2 มีโครงสร้างพิเศษใช้ทำสารหล่อลื่นชนิดแห้งได้เช่นเดียวกับแกรไฟต์ จงหาเลขออกซิเดชันของ Mo ในสารดังกล่าวนี้)
10.Supply the oxidation number of the underlined element in the following formulas; (จงหาเลขออกซิเดชันของธาตุที่ขีดเส้นใต้ในสารประกอบต่อไปนี้)
a) Zn3(PO4)2 b) NaNO2 c) SnBr2 d) HSbO2,
e) Mg(MnO4)2 f) NH4NO3
11. Assign oxidation numbers to each of the atomsin the following compounds: (จงบอกเลขออกซิเดชันของแต่ละธาตุในสารประกอบต่าง ๆ ต่อไปนี้)
Na2CrO4 Na= O = Cr =
K2Cr2O7 K = O = Cr =
CO2 O = C =
CH4 H = C =
HClO4 O = H = Cl =
MnO2 O = Mn =
SO32- O = S =
SF4 F = S =