พันธะเคมี ตอนที่ 6 เรโซแนนซ์และประจุฟอร์มัล
เรโซแนนซ์ (resonance)
หมายถึงการสลับตำแหน่งของพันธะต่างชนิดที่เกิดขึ้นในโมเลกุลเดียวกัน โดยอะตอมของทุกธาตุในโมเลกุลอยู่ในตำแหน่งเดิม ทำให้เขียนสูตรโครงสร้างของสารชนิดเดียวกันได้หลายแบบ เช่น
SO2 SO3 HCO2- NO2- , NO3-
CO32- C6H6 (benzene) O3 แต่ละชนิดจะมีโครงสร้างโมเลกุลจากการเกิดเรโซแนนซ์
(resonance
structures) ได้หลายแบบ ดังนี้
SO2 เกิดเรโซแนนซ์ได้ 2 แบบ( 2 resonance structures) ดังนี้
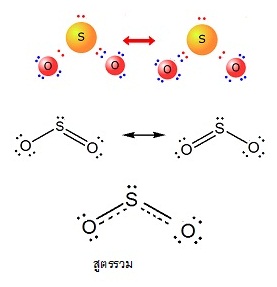
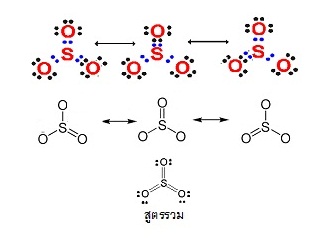
SO3 เกิดเรโซแนนซ์ได้
3 แบบ( 3 resonance structures) ดังนี้
HCO2- เกิดเรโซแนนซ์ได้ 2 แบบ ( 2 resonance structures)
ดังนี้
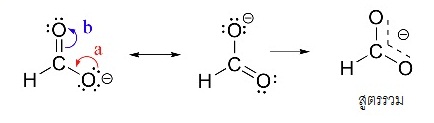
NO2- เกิดเรโซแนนซ์ได้ 2 แบบ ( 2 resonance structures) ดังนี้
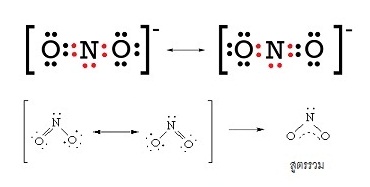
NO3- เกิดเรโซแนนซ์ได้ 3 แบบ ( 3 resonance structures) ดังนี้
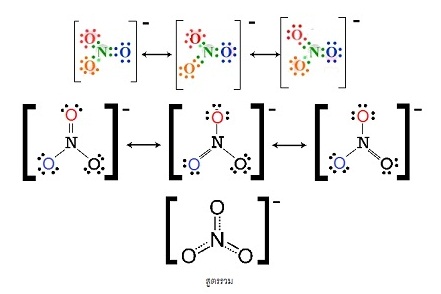
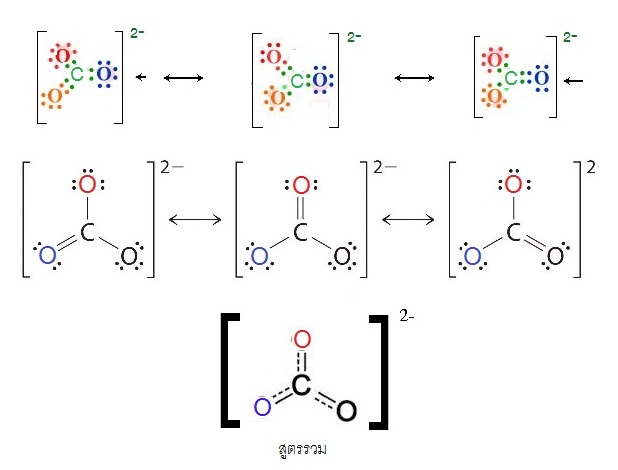
CO32- เกิดเรโซแนนซ์ได้ 3 แบบ ( 3 resonance structures) ดังนี้
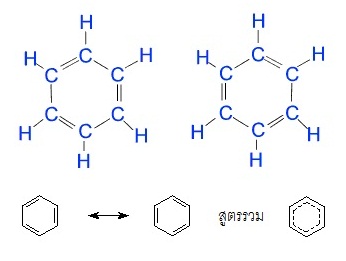
C6H6 (benzene) เกิดเรโซแนนซ์ได้ 2
แบบ ( 2 resonance structures) ดังนี้
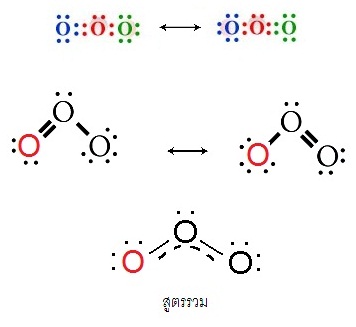
O3 (Ozone )
เกิดเรโซแนนซ์ได้ 2 แบบ ( 2 resonance structures) ดังนี้
แม้ว่าเราจะเขียนสูตรโครงสร้างของสารเดียวกันจากการเกิดเรโซแนนซ์ได้หลายแบบ แต่ไม่ได้หมายความว่าในธรรมชาติจะมีโมเลกุลของสารนั้น
ๆ ทุกแบบอยู่พร้อมกัน เพราะไม่ว่าเราจะเขียนสูตรโครงสร้างได้กี่แบบก็ตาม แต่ความจริงก็จะมีโมเลกุลของสารเหล่านั้นอยู่เพียงชนิดเดียวเท่านั้น เพราะการเกิดเรโซแนนซ์เป็นการสลับตำแหน่งของพันธะที่เกิดขึ้นอยู่ตลอดเวลาในโมเลกุลเดียวกัน
ฉะนั้นความจริงจึงมีโมเลกุลของสารนั้น ๆ
เพียงชนิดเดียว
แต่มีลักษณะผสมผสานของทุกเรโซแนนซ์รวมกัน
เช่น ใน C6H6 (Benzene) โครงสร้างโมเลกุลมีลักษณะเป็นวงหรือเรียกว่าโซ่ปิด
(closed chain) ประกอบด้วย
C จำนวน 6
อะตอมสร้างพันธะต่อเนื่องกัน คล้ายรูปหกเหลี่ยม โดยระหว่างอะตอมของ C กับ C
จะเป็นพันธะเดี่ยวกับพันธะคู่สลับกัน แต่ไม่ได้อยู่ประจำที่ เกิดเรโซแนนซ์สลับตำแหน่งกันอยู่ตลอดเวลา ดังรูป
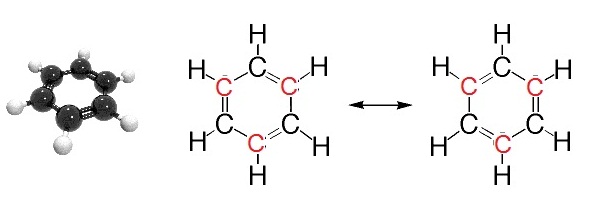
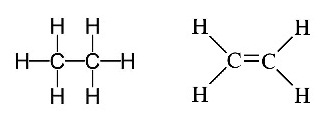
เมื่อเปรียบเทียบกับพันธะระหว่าง C กับ
C ใน C2H6 และใน
C2H4
ซึ่งเป็นพันธะเดี่ยวและพันธะคู่อย่างถาวร
ดังรูป
ประจุฟอร์มัล (Formal charge , FC)
เป็นประจุไฟฟ้าสมมติที่กำหนดขึ้นเพื่อใช้ทำนายว่าโครงสร้างโมเลกุลแบบใดมีความเป็นไปได้มากกว่ากัน
สืบเนื่องจากการเขียนสูตรโครงสร้างแสดงการเกิดเรโซแนนซ์ของสารบางชนิดดังที่ผ่านมาในตอนที่แล้ว ทำให้สารชนิดเดียวกันมีโครงสร้างโมเลกุลหลายแบบ โครงสร้างแต่ละแบบอาจมีความเป็นไปได้ไม่เท่ากัน แบบใดจะเป็นไปได้มากกว่ากันดูได้จากประจุฟอร์มัล หลักการพิจารณามีดังนี้
1. โครงสร้างที่เป็นไปตามกฎออกเตตมากที่สุด มีความเป็นไปได้มากที่สุด
2. สำหรับโมเลกุลที่เป็นกลาง โครงสร้างที่มีประจุฟอร์มัลรวมตํ่าที่สุด
(ใกล้ศูนย์) หรือเป็นศูนย์ มีความเป็นไปได้มากที่สุด
3. อนุภาคที่มีประจุไฟฟ้า โครงสร้างที่มีประจุฟอร์มัลรวมเท่ากับประจุของอนุภาค เป็นโครงสร้างที่เป็นไปได้มากที่สุด
4. อะตอมของธาตุชนิดเดียวกันที่อยู่ในโมเลกุลเดียวกัน ถ้ามีประจุฟอร์มัลตรงข้ามกัน เป็นโครงสร้างที่เป็นไป
ได้น้อย
5. อะตอมที่มีค่า EN สูงมีประจุฟอร์มัลเป็นลบ
เป็นโครงสร้างที่เป็นไปได้มากกว่า
การหาประจุฟอร์มัล
การหาประจุฟอร์มัลเพื่อทำนายว่าโครงสร้างโมเลกุลเป็นไปได้มากหรือน้อย
ขั้นแรกต้องหาประจุฟอร์มัลของแต่ละอะตอมในโมเลกุลเสียก่อน ประจุฟอร์มัลของแต่ละอะตอมอาจมีค่าเป็นลบ เป็นศูนย์หรือเป็นบวกก็ได้ จากนั้นจึงนำประจุฟอร์มัลของทุกอะตอมมารวมกันอีกครั้งหนึ่ง
ประจุฟอร์มัลของอะตอม =
จำนวนเวเลนซ์อิเล็กตรอนของอะตอมอิสระ –
จำนวนเวเลนซ์อิเล็กตรอนที่ไม่สร้าง
พันธะ - ครึ่งหนึ่งของอิเล็กตรอนที่สร้างพันธะอยู่รอบอะตอมนั้น
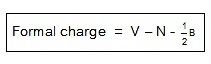
V = จำนวนเวเลนซ์อิเล็กตรอนขณะเป็นอะตอมอิสระ
N
= จำนวนเวเลนซ์อิเล็กตรอนที่ไม่สร้างพันธะ
B = จำนวนอิเล็กตรอนที่สร้างพันธะอยู่รอบอะตอมนั้น
ตัวอย่าง จงหาประจุฟอร์มัลของแต่ละอะตอมใน [ ClO3 ]
– และหาประจุฟอร์มัลรวม

ตัวอย่าง จงพิจารณาว่าโครงสร้างเรโซแนนซ์ของ CO2 แบบใดเป็นไปได้มากกว่ากัน

วิธีทำ หาประจุฟอร์มัลของแต่ละอะตอม แล้วรวมกันเป็นประจุฟอร์มัลของโมเลกุล ดังนี้

** แบบแรกเป็นไปได้มากกว่าแบบที่ 2 เพราะ CO2 เป็นโมเลกุลซึ่งไม่มีประจุไฟฟ้า
หรือมีประจุ = 0 โครงสร้างแบบแรกมีประจุฟอร์มัลรวม = 0 เช่นกัน นอกจากนั้นยังพบว่าอะตอมของ O ทั้ง 2
อะตอมมีประจุฟอร์มัลเท่ากัน
สำหรับโครงสร้างแบบที่ 2 เป็นไปได้น้อยกว่าเพราะประจุฟอร์มัลรวม = +1 ซึ่งไม่เท่ากับประจุของ CO2 นอกจากนั้น O ทั้ง
2
อะตอมซึ่งอยู่ในโมเลกุลเดียวกันยังมีประจุฟอร์มัลตรงข้ามกันอีกด้วย
แบบฝึกหัด
1. Draw all
of the possible resonance structures for the following ions or molecules: (จงเขียนสูตรแสดงเร
โซแนนของอนุภาคต่อไปนี้)
1.1)
nitrate ion: NO3-
1.2) formate ion (CHO2 - -)
1.3)
cyclobutadiene (C4H4)
1.4)
ozone (O3):
2. Draw all
of the possible Lewis structures of the following molecules. Show the formal
charges on each of
the atoms and select the most likely Lewis structure for
the molecule. (จงเขียนสูตรลิวอิสของอนุภาคต่อไปนี้
และหาประจุฟอร์มัลของแต่ละอะตอม พร้อมพิจารณาว่าโครงสร้างใดเป็นไปได้มากที่สุด)
2.1
Formaldehyde (CH2O)
2.2 HCO2-
2.3 CH2NO2-
2.4 CH2N2
2.5 OCN-
3. Draw Lewis
Structures for the following and assign formal charges as appropriate (which
means, if the
formal charge is not zero
for an atom, show it!): (จงเขียนสูตรลิวอิสของสารต่อไปนี้ และหาประจุฟอร์มาลด้วย
ถ้าอะตอมใดมีประจุฟอร์มัลไม่เท่ากับศูนย์จะหมายความว่าอะไร))
a. CBr4 b. O22-
c. NH3 d. NO+ e. IO3-
4. Write Lewis structures for the
following showing all resonance structures. Assign formal charges as
appropriate. (จงเขียนสูตรลิวอิสแสดงเรโซแนนซ์ของสารต่อไปนี้ พร้อมหาประจุฟอร์มัลด้วย)
a. N2O (N is the central
atom) ; (ให้ N เป็นอะตอมกลาง)
b. SO2
5. Based on the formal charges assigned in the
previous problem, decide which resonance
structure is
preferred (if any). (จากประจุฟอร์มัลข้อ 4
จงพิจารณาว่าเรโซแนนซ์ใดเป็นไปได้มากกว่ากัน)
6. Draw all of the possible resonance structures
for the following ions or molecules:
(จงเขียนแสดงโครงสร้างเรโซแนนซ์ที่เป็นปได้ของสารต่อไปนี้)
6.1 cyclobutadiene (C4H4)
6.2 ozone (O3)
7. Draw all
of the possible Lewis structures of the following molecules. Show the formal
charges on each of
the atoms and select the most likely Lewis structure for the
molecule. (จงเขียนสูตรโครงสร้างลิวอิสที่เป็นไป
ได้ทั้งหมดของสารต่อไปนี้ พร้อมทั้งหาประจุฟอร์มัลของแต่ละอะตอม และพิจารณาว่าแบบใดเป็นไปได้มากที่สุด)
7.1 Formaldehyde (CH2O)
7.2 CH2NO2-
7.3 CH2N2
7.4 OCN-
7.5 cyclobutadiene (C4H4)
8. Formic acid has a formula of CH2O2. Two possible Lewis structures are
shown below.
Calculate the formal charges on all atoms in the two structures, and
predict which
Lewis structure better reflects the structure of formic acid.
(สูตรโมเลกุลของกรดฟอร์มิกคือ
CH2O2 เขียนโครงสร้าลิวอิสได้ 2 แบบ
จงหาประจุฟอร์มัลของแต่ละอะตอมใน
โครงสร้างแต่ละแบบ และพิจารณาว่าโครงสร้างแบบใดดีกว่ากัน)

9. Formic acid can lose the H+ bound to the oxygen
atom to give the conjugate base,formate
(CHO2- ). Draw the resulting ion, and
calculate the formal charges of each atom.
(เมื่อกรดฟอร์มิกเสีย H+ ไป
ส่วนที่เหลือจะเป็นฟอร์เมตไอออน (CHO2- )
จงเขียนสูตรลิวอิสและหาประจุฟอร์มัลของ
แต่ละอะตอม)
10. There is a second resonance form of formate, in which the
other oxygen atom has the negative charge.
Draw the other resonance
form, based on your answer to question 9.
(จากข้อ 9
จงเขียนแสดงเรโซแนนซ์ที่เกิดขึ้น)
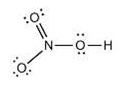
11. One resonance structure of nitric acid is shown below. Draw
the other resonance structure.
(ถ้าเรโซแนนซ์หนึ่งของกรดไนตริกเป็นดังรูป
จงเขียนแสดงอีกเรโซแนนซ์หนึ่งให้ดู)
12. The proton of nitric acid can be removed to give the
nitrate anion, NO3-. Draw the Lewis structures of all
the resonance forms of
nitrate.
(เมื่อกรดไนตริกเสียโปรตอนไปจะกลายเป็นไนเตรตไอออน , NO3- จงเขียนสูตรลิวอิสแสดงเรโซแนนซ์ของมัน)
13. For the
following Lewis structures, determine the formal charge of each atom and determine the sum of
the formal charges.
(จงหาประจุฟอร์มัลของแต่ละอะตอมจากสูตรลิวอิสต่อไปนี้ และหาประจุฟอร์มัลรวมของแต่ละอนุภาคด้วย)
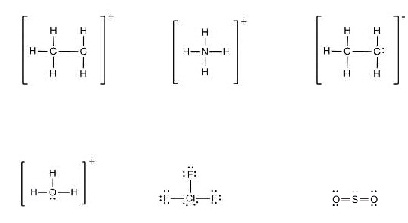
14. Calculate the formal charge on each atom in the proposed structures for CO2 and hence explain
which is most likely.
(จงหาประจุฟอร์มัลของแต่ละอะตอม
จากโครงสร้างแบบต่าง ๆ ของ
CO2
ที่ทดลองเขียนขึ้นมา พร้อมอธิบาย
ด้วยว่าแบบใดจะเป็นไปได้มากที่สุด)
15. Draw the Lewis Structure for
the carbonate ion (CO32-). Show the
three resonance forms. Calculate the
formal charge on each atom
in the polyatomic ion. Discuss the
stability of the carbonate ion and the
meaning of the formal
charges.
(จงเขียนโครงสร้างลิวอิสของ CO32- โดยแสดงเรโซแนนซ์ทั้ง 3
แบบ
จากนั้นคำนวณหาประจุฟอร์มัลของแต่ละ
โครงสร้าง
และอภิปรายในประเด็นที่ว่ามีความเสถียรอย่างไร พร้อมบอกความหมายของประจุฟอร์มัลด้วย)
16. Draw the Lewis Structure for the carbon monoxide
molecule. Calculate the formal charge on
each atom in the molecule. Discuss the
stability of CO.
(จงเขียนสูตรลิวอิสของคาร์บอนมอนอกไซด์
จากนั้นคำนวณหาประจุฟอร์มัลของแต่ละอะตอมและอธิปรายในประเด็นที่ว่าโครงสร้างโมเลกุลของ CO มีความเสถียรหรือไม่)
17. Draw the Lewis Structure for the
ammonium ion (NH4+).
Calculate the formal charge on each atom in the molecule. How does the formal charge on nitrogen
compare with the formal charge on nitrogen in the nitrate ion.
(จงเขียนสูตรโครงสร้างลิวอิสชองแอมโมเนียมไอออน
(NH4+)
จากนั้นคำนวณหาประจุฟอร์มัลของแต่ละอะตอมในโครงสร้าง และเปรียบเทียบประจุฟอร์มัลของ N ในโครงสร้างนี้กับ N ในไนเตรต
ไอออน)
18. Draw the Lewis Structure for the acetate ion
(CH3COO-). Show
the two resonance forms. . Calculate the formal charge on each atom in
the molecule.
(จงเขียนสูตรลิวอิสของอะซิเตตไอออน ,(CH3COO-) ทั้ง 2
เรโซแนนซ์
และคำนวณหาประจุฟอร์มัลของแต่ละอะตอมในแต่ละโครงสร้าง)
Content's Picture

Size : 20.45 KBs
Upload : 2014-08-09 05:15:14
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|