พันธะเคมี ตอนที่ 4 การละลายและการตกตะกอนของสารไอออนิก
สมบัติของสารประกอบไอออนิก
สารไอออนิกเกิดจากไอออนบวกและไอออนลบเรียงตัวสลับที่ล้อมรอบซึ่งกันและกัน โดยแต่ละไอออนของสารไอออนิกแต่ละชนิด จะมีตำแหน่งประจำที่อยู่ ณ จุดใดจุดหนึ่งของผลึก ทำให้เกิดรูปผลึกเฉพาะตัว การทุบหรือบีบอัดอย่างแรงจะทำให้ไอออนเกิดการเคลื่อนที่ หรือเลื่อนตำแหน่งไปจากเดิม ถ้าไอออนที่มีประจุเดียวกันเลื่อนไปอยู่ตรงกันก็จะเกิดแรงผลักอย่างรุนแรง ทำให้สารไอออนิกแตกออกจากกัน สารไอออนิกที่เป็นของแข็งจึงเปราะและแตกหักง่าย
สารไอออนิกขณะเป็นของแข็งจะไม่นำไฟฟ้าเนื่องจากไอออนไม่มีการเคลื่อนที่ แต่เมื่อหลอมเหลวหรืออยู่ในรูปของสารละลายจะนำไฟฟ้าได้เพราะไอออนเคลื่อนที่ได้
สารไอออนิกจะมีจุดหลอมเหลวและจุดเดือดสูง เนื่องจากแรงยึดเหนี่ยวระหว่างไอออนบวกกับไอออนลบมีกำลังมาก จึงต้องใช้ความร้อนมากในการทำให้ไอออนแยกออกจากกัน
การละลายของสารไอออนิก
สารไอออนิกเกิดจากการรวมตัวกันระหว่างไอออนบวกกับไอออนลบ ซึ่งโดยทั่วไปแล้วไอออนทั้งสองจะมีแรงดึงดูดกันมาก(พันธะไอออนิก) การละลายเป็นการทำให้ไอออนแยกตัวออกจากกัน จึงต้องใช้พลังงานจำนวนมากเช่นกันไอออนจึงจะแยกตัวออกจากกันได้ ขณะที่ไอออนเข้ามารวมตัวกันป็นสารไอออนิกนั้น จะมีการคายพลังงานออกมาจำนวนหนึ่งที่เรียกว่าพลังงานโครงร่างผลึก (lattce energy) สารไอออนิกชนิดใดคายพลังงานโครงร่างผลึกออกมามาก พันธะไอออนิกก็จะมีความแข็งแรงมาก ถ้าจะทำให้ไอออนแยกออกจากกันก็จะต้องใช้พลังงานมากด้วย พลังงานดังกล่าวนี้มีผลต่อการละลายของสารไอออนิก การที่สารไอออนิกแต่ละชนิดมีสภาพการละลาย (solubility) แตกต่างกันก็ขึ้นอยู่กับพลังงานส่วนนี้ การละลายของสารไอออนิกจะเกิดขึ้นได้ก็ต่อเมื่อต้องให้พลังงานจำนวนเท่ากับพลังงานโครงร่างผลึกกลับเข้าไป ไอออนจึงจะแยกตัวออกจากกัน แต่เรามักจะเรียกสั้น ๆ ว่าพลังงานโครงร่างผลึก ดังสมการ
Na+(g) + Cl-(g) → NaCl(s)
; ΔH5 =
-787 kJ/mol
หมายความว่าแรงดึงดูดระหว่าง Na+ กับ
Cl- ที่รวมตัวกันอยู่ใน
NaCl เมื่อคิดเป็นพลังงานจะมีค่าเท่ากับ
787 kJ/mol ฉะนั้นถ้าจะทำให้ผลึก NaCl จำนวน 1 โมล แยกตัวออกไปเป็น Na+ และ Cl- ในสภาวะก๊าซอย่างเดิมจึงต้องดูดพลังงาน 787 kJ/mol
กลับเข้าไป ดังสมการ
NaCl(s) → Na+(g) + Cl-(g) ; ΔH5 = +787 kJ/mol
พลังงานนี้ถ้าจะเรียกชื่อให้ถูกจะต้องเรียกว่า พลังงานเท่าพลังงานโครงร่างผลึก แต่มักจะเรียกสั้น ๆ ว่าพลังงานโครงร่างผลึกดังกล่าวมาแล้ว พลังงานนี้จะเป็นตัวบ่งชี้ว่าสารไอออนิกละลายง่ายหรือยาก คือถ้ามีพลังงานโครงร่างผลึกมาก สารไอออนิกก็จะละลายยากจนอาจถึงขั้นที่ไม่ละลายก็ได้
(คำว่าไม่ละลายหมายความว่า ละลายได้น้อยกว่า 0.10
กรัม/น้ำ 100 กรัม)
การละลายของสารไอออนิกจะเกี่ยวข้องกับพลังงาน 2 ขั้น คือ
ขั้นที่ 1 ดูดพลังงานเท่าพลังงานโครงร่างผลึก เพื่อทำให้ไอออนบวกกับไอออนลบในผลึกแยกออกจากกัน เขียนสมการแสดงดังนี้
NaCl(s) + 787
kJ/mol → Na+(g) + Cl-(g)
แสดงด้วยสัญลักษณ์ ΔH
จะใช้เครื่องหมายบวก ดังสมการ
NaCl(s)
→
Na+(g) + Cl-(g) ; ΔH1 =
+787 kJ/mol
ΔH
ในกรณีนี้ใช้เครื่องหมายบวกเนื่องจากเป็นการดูดพลังงาน มีผลให้ NaCl(s) แยกออกจากกันกลายเป็น Na+ กับ Cl- อยู่ในภาวะแก๊ส (g) แต่ไม่ได้หมายความว่ากลายเป็นไอแล้วฟุ้งกระจายอยู่ในอากาศ แต่หมายความว่าไอออนทั้งสองแยกตัวออกจากกันเป็นอิสระ เคลื่อนที่ไปมาได้ด้วยตัวเองเพราะมีพลังงานสูงทำนองเดียวกับโมเลกุลของก๊าซต่าง ๆ
แต่ภาวะดังกล่าวนี้จะเกิดขึ้นในช่วงเวลาที่สั้นมากแล้วผ่านไปสู่ขั้นตอนต่อไปทันที่
พลังงานที่ใช้ในขั้นนี้ดูดเข้าไปจากสิ่งแวดล้อมที่อยู่ใกล้ที่สุด ได้แก่ความร้อนที่มีอยู่ในตัวทำละลาย จึงมีผลให้อุณหภูมิของระบบลดลง
ขั้นที่ 2 คายพลังงานเมื่อโมเลกุลของตัวทำละลายเข้าล้อมรอบไอออน ถ้าตัวทำละลายคือน้ำ จะเรียกว่าพลังงานไฮเดรชัน (Hydration) ซึ่งสารไอออนิกส่วนมากก็จะละลายในน้ำ
ถ้าตัวทำละลายเป็นสารอื่นจะเรียกพลังงานในขั้นนี้ว่า พลังงานโซลเวชัน (solvation) สารไอออนิกจะละลายในตัวทำละลายที่โมเลกุลมีขั้วไฟฟ้า
เรียกกันว่าตัวทำละลายมีขั้ว (pola solvent) เช่น โมเลกุลของน้ำเป็นโมเลกุลที่มีขั้วไฟฟ้า ดังรูป
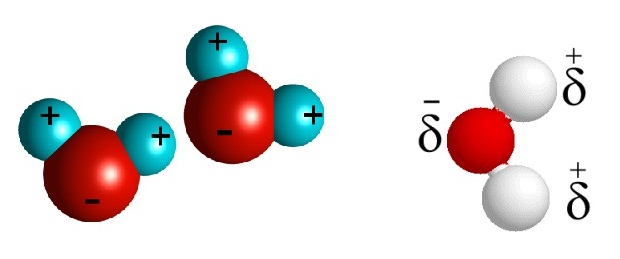
จากรูปแสดงว่าโมเลกุลของน้ำทางด้านอะตอมของ O มีขั้วไฟฟ้าเป็นขั้วลบ ส่วนทางด้านอะตอมของ H มีขั้วไฟฟ้าเป็นขั้วบวก ฉะนั้น Na+ เมื่ออยู่ในน้ำก็จะถูกล้อมรอบด้วยโมเลกุลของน้ำ โดยหันทางด้านอะตอมของ O เข้าหา ส่วน Cl- ก็จะถูกล้อมรอบด้วยโมเลกุลของน้ำโดยหันด้านอะตอมของ H เข้าหา (น้ำมีชื่อเดิมในภาษาละตินว่า aqua หรือ aqueous )
ฉะนั้นจึงใช้อักษรย่อ
(aq) แสดงการละลายที่มีน้ำเป็นตัวทำละลาย เช่น สารละลายของโซเดียมคลอไรด์ในน้ำเขียนดังนี้ NaCl(aq)
หรือ Na+(aq)
+ Cl-(aq)
โมเลกุลของน้ำซึ่งล้อมรอบ
Na+ และ Cl- เกิดขึ้นทั้ง 3
มิติ ไม่มีจำนวนที่แน่นอนว่าแต่ละไอออนจะถูกล้อมรอบด้วยโมเลกุลของน้ำจำนวนเท่าใด ดังรูป
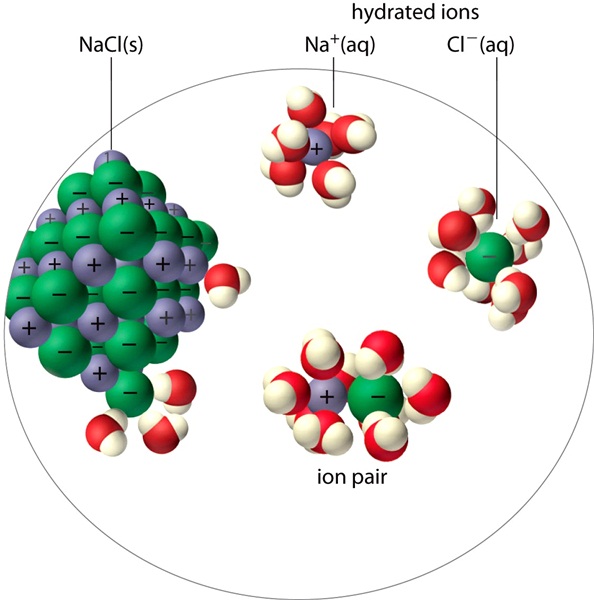
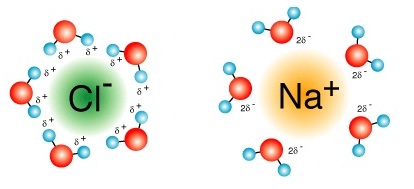
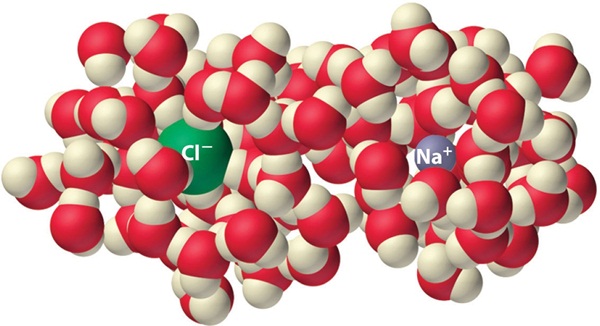
(คลิ้ก ชมการละลายน้ำของ NaCl)
(คลิ้ก ชมโมเลกุลของน้ำซึ่งล้อมรอบไอออนบวกและไอออนลบ)
(คลิ้ก ชมการละลายน้ำของ NaCl)
ขณะที่โมเลกุลของน้ำเข้ามาล้อมรอบไอออนนั้น จะต้องมีการคายพลังงานออกมาจำนวนหนึ่ง เรียกพลังงานที่คายออกมานี้ว่าพลังงานไฮเดรชัน (Hydration) ดังสมการ
Na+(g) + Cl-(g) → Na+(aq) + Cl-(aq) + 769
kJ/mol
แสดงด้วยสัญลักษณ์ ΔH2 จะใช้เครื่องหมายลบ ดังสมการ
Na+(g) + Cl-(g) → Na+(aq) + Cl-(aq) ; ΔH2 =
-769 kJ/mol
เมื่อนำพลังงานทั้ง 2 ขั้นตอนมารวมกัน (นำเครื่องหมายมาด้วย) ค่าที่ได้ เรียกว่าพลังงานของการละลาย (Heat of solution ; ΔHsol ) ดังนี้
ขั้นที่ 1
NaCl(s) →
Na+(g) + Cl-(g)
; ΔH1 = +
787 kJ/mol
ขั้นที่ 2 Na+(g) + Cl-(g) → Na+(aq)
+ Cl-(aq) ; ΔH2 =
-769 kJ/mol
ΔHsol = ΔH1 + ΔH2
= +787 +(-769)
= + 18
kJ/mol
สมการรวม Na(s) + Cl2(g) →
NaCl(s) ; ΔHsol =
+ 18 kJ/mol
จากตัวอย่างจะเห็นได้ว่า ΔH1 มีค่ามากกว่า ΔH2 ทำให้ค่า ΔHsol ของ NaCl = +18
kJ/mol หมายความว่าเมื่อมีการละลายของ
NaCl จำนวน 1 โมล จะดูดพลังงานจากสิ่งแวดล้อมเข้าไป 18
kJ พลังงานดังกล่าวนี้จะดูดจากตัวทำละลายเพราะอยู่ใกล้ที่สุด ทำให้ขณะละลายอุณหภูมิจะลดลง พลังงานจำนวนนี้ถือว่าน้อยฉะนั้นจะพบว่าเมื่อ NaCl
ละลายน้ำอุณหภูมิจะลดลงเพียงเล็กน้อยเท่านั้น
การละลายของสารไอออนิกจะเป็นชนิดดูดความร้อนหรือคายความร้อน ขึ้นอยู่กับพลังงานโครงร่างผลึกกับพลังงานไฮเดรชัน ว่าพลังงานใดจะมากกว่ากัน
ถ้าพลังงานงานโครงร่างผลึกมากกว่าพลังงานไฮเดรชัน การละลายจะเป็นชนิดดูดความร้อน ขณะละลายอุณหภูมิจะลดลง ถ้าต้องการให้ละลายได้เร็วต้องให้ความร้อน
ถ้าพลังงานไฮเดรชันมากกว่าพลังงานโครงร่างผลึก การละลายจะเป็นชนิดคายความร้อน ขณะละลายอุณหภูมิจะสูงขึ้น
ถ้าต้องการให้ละลายเร็วต้องช่วยระยายความร้อนออกไป แต่ไม่ได้หมายความว่าต้องแช่ในน้ำแข็งหรือทำให้เย็นจัด เพราะถ้าเย็นมากก็จะไม่ละลาย
จึงควรใช้วิธีรักษาอุณหภูมิขณะละลายเอาไว้ไม่ให้สูงมาก
** การละลายของสารไอออนิกเป็นสมบัติเฉพาะตัว บางชนิดละลายได้มาก บางชนิดละลายได้น้อย
จำแนกการละลายเป็น 3
ระดับ
เปรียบเทียบกันที่ใช้น้ำ 100 กรัม
เท่ากัน ณ อุณหภูมิ 25 oC ถ้าละลายได้มากกว่า 1.00 กรัมขึ้นไป
จัดว่าละลายได้ดี ถ้าอยู่ระหว่า 0.1 -
1.0 กรัม
จัดว่าละลายได้เล็กน้อย
แต่ถ้าละลายได้น้อยกว่า 0.1 กรัม
จัดว่าไม่ละลาย แต่ความจริงละลาย)
เอนทัลปี (enthalpy) คือ ปริมาณความร้อนที่ถ่ายเทเข้าหรือออกระหว่างระบบกับสิ่งแวดล้อม ในกระบวนการเปลี่ยนแปลงต่าง ๆ ได้แก่การเปลี่ยนสถานะ การละลายและการเกิดปฏิกิริยาเคมี เขียนแทนด้วยสัญลักษณ์ H ถ้าเราเปรียบเทียบปริมาณความร้อนระหว่างก่อนการเปลี่ยนแปลง กับปริมาณความร้อนหลังการเปลี่ยนแปลงใด ๆ จะพบว่ามีปริมาณความร้อนเปลี่ยนแปลงไป เรียกปริมาณความร้อนส่วนที่เปลี่ยนแปลงว่า การเปลี่ยนแปลงเอนทัลปี ใช้สัญลักษณ์ว่า ΔH อาจแสดงในรูปสมการได้ว่า ;
ΔH =
ΔH1 + ΔH2 ; (ΔH1 ใช้เครื่องหมายบวก ΔH2 ใช้เครื่องหมายลบ)
ถ้า ΔH1 มากกว่า ΔH2 ปฏิกิริยาจะเป็นแบบดูดความร้อน (endothermic
reaction) ค่า ΔH จะใช้เครื่องหมาย+
ถ้า ΔH2 มากกว่า ΔH1 ปฏิกิริยาจะเป็นแบบคายความร้อน (exothermic reaction) ค่า ΔH จะใช้เครื่องหมาย -
(คลิ้ก ชมปฏิกิริยาดูดความร้อน คายความร้อนและค่าΔH )
กระบวนการเปลี่ยนแปลงมีทั้งการเปลี่ยนสถานะ การละลายและการเกิดปฏิกิริยาเคมี การแสดงค่า
เอนทัลปี หรือ DH จึงใช้ตัวอักษรย่อกำกับไว้ด้วย เพื่อให้ทราบว่าเป็น DH ของกระบวนการใด
เช่น
ΔHf = enthalpy of formation คือเอนทัลปีของการปฏิกิริยาเคมีของเกิดสารเคมีชนิดนั้น
ΔHfus = enthalpy
of fusion คือเอนทัลปีของการหลอมเหลว
DHsub = enthalpy of sublimation
คือเอนทัลปีของการระเหิด
ΔHvap
= enthalpy of vaporization คือเอนทัลปีของการกลายเป็นไอ
ΔHsoln
= enthalpy of solution คือ เอนทัลปีของการละลาย
ถ้าการเปลี่ยนแปลงเกิดขึ้นในภาวะมาตรฐาน คือ อุณหภูมิ
25 oC
ความดัน 1 atm จะเรียกว่าเอนทัลปีมาตรฐาน ใช้สัญสักษณ์ว่า ΔH0
(คลิกชม
การทดลองเสมือนจริงแสดงการละลายของสารไอออนิก)
สภาพการละลาย (solubility)
สารแต่ละชนิดมีสภาพการละลายแตกต่างกัน
(ในยุคหนึ่งเคยเรียกว่าความสามารถในการละลาย)
ในการเปรียบเทียบว่าสารแต่ละชนิดมีสภาพการละลายอย่างไร จะใช้น้ำ
100 กรัม อุณหภูมิ
25 oC
เป็นตัวทำละลายแล้วทดสอบว่า สารแต่ละชนิดละลายได้กี่กรัม จำแนกออกเป็น
3 ระดับ คือ
1. ถ้าละลายได้น้อยกว่า 0.10
กรัม จัดว่าไม่ละลาย
2. ถ้าละลายได้ระหว่าง 0.10 ถึง 1.0
กรัม จัดว่าละลายได้เล็กน้อย
3. ถ้าละลายได้มากกว่า 1.0 กรัม
จัดว่าละลายได้ดี
เมื่อมีการละลายย่อมมีการเปลี่ยนแปลงพลังงาน
ดังที่ทราบในตอนต้นมาแล้วว่าเกี่ยวข้องกับพลังงานโครงร่างผลึกกับพลังงานไฮเดรชัน
ทำให้การละลายเป็นแบบดูดความร้อนหรือคายความร้อนอย่างใดอย่างหนึ่ง จากกราฟแสดงสภาพการละลาย (solubility) ของสารต่าง ๆ
ต่อไปนี้จะเห็นว่าสารส่วนใหญ่ละลายได้มากขึ้นเมื่ออุณหภูมิสูงขึ้น เป็นลักษณะของการละลายแบบดูดความร้อน เกิดจากพลังงานโครงร่างผลึกมากกว่าพลังงานไฮเดรชัน
มีอยู่ชนิดเดียวที่ละลายได้น้อยลงเมื่ออุณหภูมิเพิ่มขึ้น ได้แก่
Ce2(SO4)3 ; เซอร์เรียม (III)
ซัลเฟต Ce เป็นโลหะแทรนซิชัน มีเลขเชิงอะตอม 58
การละลายลักษณะนี้เป็นการละลายแบบคายความร้อน เป็นเพราะพลังงานไฮเดรชันมากกว่าพลังงานโครงร่างผลึก
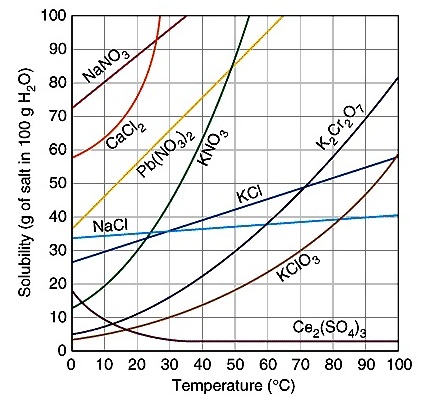
ให้ทำความเข้าใจว่าทุกจุดบนเส้นกราฟที่แสดงสภาพการละลายของสารแต่ละชนิด สารละลาย ณ จุดนั้น ๆ จะเป็นสารละลายอิ่มตัว ณ อุณหภูมินั้น ๆ ดูตัวอย่างเส้นกราฟของ K2Cr2O7 จะพบว่าอุณหภูมิกับปริมาณของ K2Cr2O7 ที่ละลายได้จะเป็นดังนี้
|
อุณหภูมิ (oC)
|
มวลของ K2Cr2O7 ที่ละลายได้
(g)
|
|
50
|
30
|
|
90
|
70
|
|
100
|
>80
|
ณ
อุณหภูมิและปริมาณสารที่ละลายได้ดังที่แสดงอยู่นี้ สารละลายในแต่ละอุณหภูมิล้วนเป็นสารละลายอิ่มตัวทั้งสิ้น ถ้าควบคุมอุณหภูมิให้คงที่ ณ
อุณหภูมิใดก็ตาม ปริมาณของ K2Cr2O7 ที่ละลายได้ก็จะคงที่ เช่น ที่อุณหภูมิ 50 oC K2Cr2O7 ละลายได้ 30
กรัม แต่เมื่อเพิ่มอุณหภูมิเป็น 90
oC ทำให้ K2Cr2O7 ละลายได้เพื่อมขึ้นอีก 40
กรัมเป็น 70 กรัม แต่ถ้าลดอุณหภูมิให้กลับไปอยู่ที่ 50
oC ตามเดิม K2Cr2O7 ก็จะตกผลึกแยกตัวออกมา 40
กรัม เช่นกัน
เราสามารถคิดคำนวณได้ว่าการละลายของสารไอออนิกชนิดต่าง ๆ
เมื่อละลายแล้วจะทำให้อุณหภูมิเพิ่มขึ้นหรือลดลงเท่าไร ถ้าเราทราบข้อมูลต่อไปนี้
- ทราบพลังงานการละลาย
(ΔHsol) ของสารนั้น ๆ
- ทราบมวลของตัวละลาย(ตัวถูกละลาย)
- ทราบมวลของตัวทำละลายและความร้อนจำเพาะ
( c
หรือ s )
กำหนดให้
Q = ปริมาณความร้อน (จูล หรือแคลอรี โดย
1 แคลอรี = 4.2 จูล)
m
= น้ำหนักของตัวทำละลาย (กรัม)
c หรือ s = ความจุความร้อนของตัวทำละลาย ( ถ้าตัวทำละลายคือน้ำ c หรือ s
= 1 แคลอรี/กรัม หรือ 4.2 จูล/กรัม องศาเซลเซียส)
Δt
= อุนหภูมิที่เปลี่ยนแปลง
(องศาเซลเซียส)
สมการ
ตัวอย่าง ถ้าทำให้โซเดียมคลอไรด์จำนวน 1 โมล ละลายในน้ำ 1 ลิตร ( 1,000 กรัม) อุณหภูมิจะเปลี่ยนแปลงอย่างไร ถ้าความร้อนจำเพาะของน้ำคือ 1 cal/g หรือ 4.2 J/g
และพลังงานของการละลายเป็นดังสมการ
NaCl(s) → Na+(aq) + Cl-(aq) ; ΔHsol = +
18 kJ/mol
วิธีทำ Q
(ปริมาณความร้อน)
= 18 kJ
= 18 x 1,000 J
=
18,000
J หรือ = 4,285.71 แคลอรี
m (น้ำหนักของน้ำ) = 1,000 กรัม
c หรือ s (ความจุความร้อนของน้ำ) = 1 แคลอรี/กรัม หรือ 4.2 จูล/กรัม
สมการ Q
=
mcΔt หรือ = ms Δt
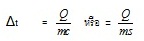
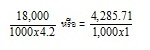
= 4.28 0C
สังเกตที่พลังงานการละลายที่กำหนดให้คือ ΔHsol= + 18 kJ/mol เป็นการละลายแบบดูดความร้อน ฉะนั้น Δt ที่คำนวณได้จึงเป็นอุณหภูมิที่ลดลง การละลายดังกล่าวจึงมีผลให้อุณหภูมิลดลง 4.28 oC
สารไอออนิกมีทั้งชนิดที่ละลายน้ำและไม่ละลายน้ำ
มีข้อสังเกตว่าสารไอออนิกที่มีพลังงานโครงร่างผลึก (ΔH1) สูง จะละลายยากกว่าชนิดที่มีพลังงานโครงร่างผลึกต่ำ และถ้ามีพลังงานโครงร่างผลึกสูงมากไปถึงระดับหนึ่งก็จะกลายเป็นสารที่ไม่ละลายน้ำ (ความจริงคือละลายได้น้อยกว่า
0.1 กรัม ในน้ำ 100 กรัม) ส่วนพลังงานไฮเดรชัน (ΔH2)
นั้น ใช้ในการเปรียบเทียบกับพลังงานโครงร่างผลึกว่า การละลายจะเป็นแบบดูดหรือคายความร้อน
- ถ้า ΔH1 มากกว่า ΔH2 การละลายจะเป็นแบบดูดความร้อน ขณะละลายอุณหภูมิจะลดลง
- ถ้า ΔH2 มากกว่า ΔH1 การละลายจะเป็นแบบคายความร้อน ขณะละลายอุณหภูมิจะเพิ่มขึ้น
ข้อสังเกตเกี่ยวกับการละลายหรือไม่ละลายของสารไอออนิกในน้ำ
หลักการพิจารณาว่าสารไอออนิกชนิดใดจะละลายน้ำหรือไม่ละลายมีดังนี้
1. สารประกอบที่มีธาตุหมู่
1A NH4+ และ NO3- เป็นองค์ประกอบ ละลายน้ำได้ทุกชนิด
2. สารประกอบของธาตุหมู่ 2A
ให้พิจารณาดังนี้
2.1 สารประกอบของ Be
ไม่ละลายน้ำ เช่น BeCl2
2.2 สารประกอบของ Mg
Ca Sr Ba
Ra ถ้ารวมตัวอยู่กับไอออนลบที่มีประจุ
1- จะละลายน้ำได้
เช่น CaCl2 Mg(NO3)2 Ba(OH)2 …
2.3 สารประกอบของ Mg Ca
Sr Ba Ra ถ้ารวมตัวอยู่กับไอออนลบที่มีประจุ 2- ขึ้นไป จะไม่
ละลายน้ำ เช่น CaCO3 Ca3(PO4)2 BaSO4 MgCO3…
***ยกเว้น CaSO4 ละลายได้เล็กน้อย MgSO4 ละลายได้ดี
3. สารประกอบของ Ag ส่วนใหญ่ไม่ละลายน้ำ ยกเว้น AgNO3 ละลายได้ดี AgSO4 ละลายได้เล็กน้อย
4. สารประกอบของ Pb
ที่ละลายน้ำได้คือ Pb(NO3)2 นอกนั้นไม่ละลายน้ำ
5. สารประกอบของโลหะแทรนซิชันส่วนใหญ่ไม่ละลายน้ำ ( Fe2+ ละลายน้ำ Fe3+ ไม่ละลายน้ำ)
Solubility Rules (กฎของการละลาย)
Review/memorize
these rules. They can be split into four
groups: (ละลายหรือไม่ละลายแบ่งได้เป็น 4
ประเภท)
ALWAYS SOLUBLE: (ประเภทที่ละลายได้เสมอ คือประเภทที่มีไอออนเหล่านี้เป็นองค์ประกอบ)
alkali
metal ions (Li+, Na+, K+, Rb+, Cs+),
NH4+, NO3-, C2H3O2-,
ClO3-, ClO4-
USUALLY SOLUBLE:
(ประเภทที่ละลายได้เป็นส่วนใหญ่แต่มีข้อยกเว้นบ้าง)
-
chlorides, bromides, iodides (Cl-,
Br-, I-) except “AP/H” (Ag+, Pb2+,
Hg22+)
(สารที่มี Cl-,
Br-, I- เป็นองค์ประกอบ ยกเว้น
ถ้ารวมตัวกับ Ag+, Pb2+, Hg22+
จะไม่ละลาย)
-
sulfates (SO42-)
except “CBS/PBS” (Ca2+, Ba2+, Sr2+, Pb2+)
(สารที่มี SO42-
เป็นองค์ประกอบ
ยกเว้น ถ้ารวมตัวกับ Ca2+,
Ba2+, Sr2+, Pb2+จะไม่ละลายหรือละลายเล็กน้อย)
-
fluorides (F-) except
“CBS/PM” (Ca2+, Ba2+, Sr2+, Pb2+,
Mg2+)
(สารที่มี F- เป็นองค์ประกอบ ยกเว้นถ้ารวมตัวกับ Ca2+, Ba2+,
Sr2+, Pb2+, Mg2+ จะไม่ละลายหรือละลายเล็กน้อย)
USUALLY
INSOLUBLE: (ประเภทที่ไม่ละลาย)
oxides/hydroxides (O2-,
OH-) except “CBS” (Ca2+,
Ba2+, Sr2+)
(สารประกอบออกไซด์และไดรอกไซด์ คือมี
O2-,
OH- เป็นองค์ประกอบ
ยกเว้นถ้ารวมตัวกับ Ca2+,
Ba2+, Sr2+ จะ
ละลายได้)
NEVER SOLUBLE: (ประเภทที่ไม่ละลายแน่ ๆ)
CO32-,
PO43-, S2-, SO32-, CrO42-,
C2O42- except alkali metals & NH4+
(สารที่มี CO32-,
PO43-, S2-, SO32-, CrO42-,
C2O42-
เป็นองค์ประกอบ
ยกเว้นถ้ารวมตัวกับโลหะอัลคาไลและ NH4+ ละลายได้)
NOTE: some of these insoluble
compounds WILL dissolve in acid solutions because of gas formation... useful
idea!
(พวกสารที่ไม่ละลายเหล่านี้ จะละลายในกรด
โดยทำปฏิกิริยากับกรดแล้วมีก๊าซเกิดขึ้น)
การตกตะกอนเมื่อผสมสารละลายของสารไอออนิกเข้าด้วยกัน
สารไอออนิกมีทั้งชนิดที่ละลายน้ำและไม่ละลายน้ำ
สารไอออนิกที่ละลายน้ำจะแตกตัวเป็นไอออนบวกกับไอออนลบแล้วรวมเป็นเนื้อเดียวกับน้ำ แต่เมื่อนำสารละลายของสารไอออนิกตั้งแต่ 2 ชนิดขึ้นไปมาผสมกัน มีผลให้ไอออนที่มีอยู่ในสารละลายต่างชนิดมารวมอยู่ในระบบเดียวกัน ถ้ามีไอออนคู่ใดที่รวมตัวกันแล้วกลายเป็นสารไอออนิกที่ไม่ละลายน้ำ ก็จะตกตะกอนทันที ฉะนั้นถ้าผสมสารละลายของสารไอออนิกแล้วมีการตกตะกอน ก็หมายความว่ามีสารไอออนิกที่ไม่ละลายน้ำเกิดขึ้น เช่น ถ้าเราทราบว่า PbI2 (เกิดจาก Pb2+
+ 2I - ) เป็นสารไอออนิกที่ไม่ละลายน้ำ สารนี้มีสีเหลือง ฉะนั้นถ้าอยู่ในน้ำก็ย่อมตกตะกอนสีเหลือง ถ้าเรานำสารละลายของสารไอออนิกมา 2 ชนิด คือ Pb(NO3)2 ( เมื่อละลายจะแตกตัวออกเป็น Pb2+ + 2NO3- ) กับสารละลาย KI (เมื่อละลายจะแตกตัวออกเป็น K+ + I-
) เมื่อนำมาผสมกัน ไอออนทั้ง
4
ชนิดก็จะรวมอยู่ในระบบเดียวกัน
คือ Pb2+
+ 2NO3- + K+ + I-
ทันทีที่ผสมสารละลาย Pb2+ กับ I- จะรวมตัวกันเป็น PbI2 แล้วตกตะกอนสีเหลือง ส่วน
K+ กับ NO3- จะยังคงละลายอยู่ต่อไปเนื่องจาก KNO3 เป็นสารไอออนิกที่ละลายน้ำได้ ดังรูป
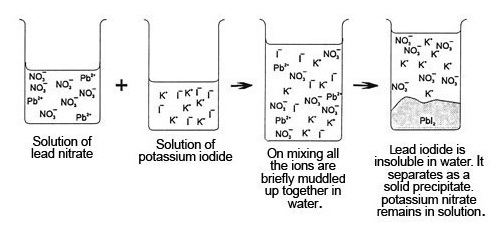
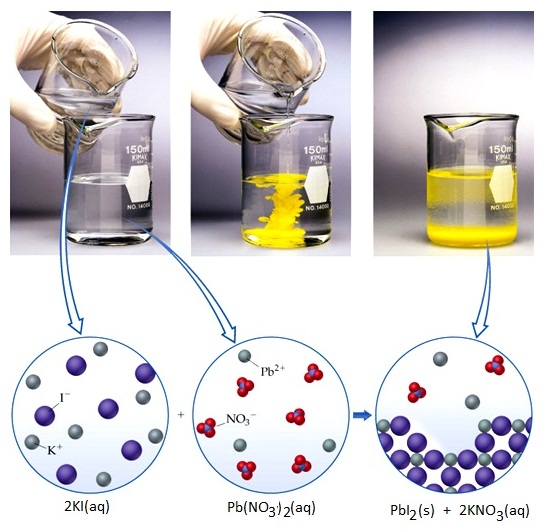
(คลิ้ก ชมการทดลองผสมสารละลาย Pb(NO3)2 + KI)
สมการไอออนิก (ionic equation)
เมื่อผสมสารละลายของสารไอออนิกแล้วมีตะกอนเกิดขึ้น
แสดงว่ามีไอออนรวมตัวกันกลายเป็นสารไอออนิกที่ไม่ละลายน้ำเกิดขึ้น เขียนสมการแสดงการตกตะกอนได้ 3 แบบ
คือ
1. สมการโมเลกุล (molecular equation) เป็นการเขียน แสดงสารทุกชนิดในรูปโมเลกุล
(หน่วยสูตร) ไม่ต้องแยกออกเป็นไอออน แต่เป็นที่เข้าใจว่าส่วนใดเป็นไอออนบวก ส่วนใดเป็นไอออนลบ และส่วนใดคือส่วนที่ตกตะกอน
เช่น
Pb(NO3)(aq) +
2KI(aq) → PbI2(s) + 2KNO3(aq)
สารที่มี (aq) อยู่ข้าง ๆ หมายถึงเป็นสารที่แตกตัวเป็นไอออน ซึ่งก็คือสารที่ละลายน้ำได้
สารที่มี (s) อยู่ข้าง ๆ หมายถึงสารที่ตกตะกอน
2. สมการไอออนิกแบบรวม (over
all Ionic equation) เป็นการเขียนแสดงสารแต่ละชนิดเมื่อแตกตัวเป็นไอออน โดยเขียนครบทุกไอออน เช่น
Pb2+(aq) + 2NO3-(aq)
+ K+(aq) + 2I- (aq) → PbI2(s) + 2NO3-(aq)
+ 2K+(aq)
ให้สังเกตที่ (aq) และ (s) แสดงการละลายได้และการตกตะกอน ตามลำดับ
3. สมการไอออนิกสุทธิ (net-ionic equation) กรณีนี้เขียนเฉพาะไอออนที่รวมตัวกันแล้วตกตะกอนเท่านั้น ได้แก่
Pb2+(aq)
+ 2I- (aq) → PbI2(s)
บางกรณีผสมสารละลายแล้วไม่มีตะกอน
แต่พบว่ามีไอออนรวมตัวกัน
ก็ให้เขียนสมการไอออนิกจากการรวมตัวของไอออนนั้น (คลิ้ก ชมการผสมสารละลายแล้วไม่มีการตกตะกอนแต่มีการรวมตัวของไอออน)
การที่เรามีความรู้เกี่ยวกับการละลายและการตกตะกอน เมื่อนำสารละลายของสารไอออนิกต่างชนิดมาผสมกันนี้ เราสามารถนำไปใช้ในการเตรียมสารเคมีชนิดใหม่ขึ้นมาได้ โดยการผสมสารเคมีชนิดเดิมที่มีอยู่ เพื่อให้ตกตะกอนเป็นสารเคมีที่ต้องการ เช่น ถ้าเราต้องการเตรียม BaSO4 ซึ่งเป็นสารไอออนิกที่ไม่ละลายน้ำ เราสามารถเตรียมสารนี้ได้โดยเลือกสารเคมีที่เหมาะสม 2 ชนิด ที่ละลายน้ำได้ สารหนึ่งให้มี
Ba2+ เป็นส่วนประกอบ เช่น BaCl2 อีกสารหนึ่งให้มี
SO42- เป็นส่วนประกอบ เช่น Na2SO4 เมื่อนำมาผสมกันจะตกตะกอนเป็น BaSO4 ตามต้องการ
ดังรูป
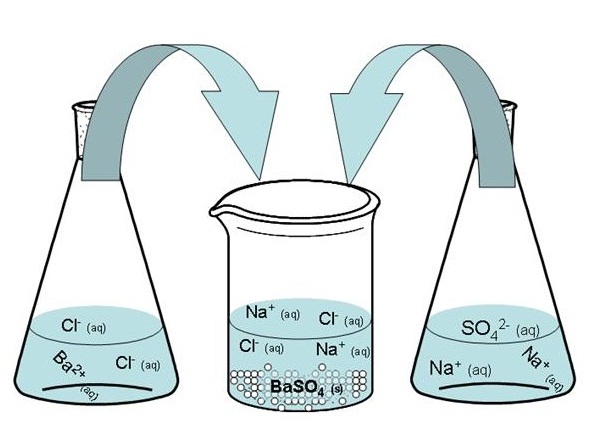
ตะกอนสีขาวที่เกิดขึ้นคือ BaSO4 ที่เราต้องการ สำหรับ Na+ กับ Cl- ยังคงละลายอยู่ในสารละลายตามเดิมเนื่องจากเป็นสารไอออนิกที่ละลายน้ำได้ ถ้าเรากรองแยกเอาตะกอนสีขาวออกมา เราก็จะได้ BaSO4 สำหรับ Na+ กับ Cl- ก็จะไหลผ่านกระดาษกรองไป
เขียนแสดงดังสมการต่อไปนี้
- สมการโมเลกุล ; K2SO4(aq) + BaCl2(aq) → BaSO4(s) + 2KCl(aq)
- สมการไอออนิกรวม ;
2K+(aq) + SO42-(aq) + Ba2+(aq) + 2Cl-(aq) → BaSO4(s) + 2K+(aq) + 2Cl-(aq)
- สมการไอออนิกสุทธิ ; Ba2+(aq) + SO42-(aq) → BaSO4(s)
ความเป็นไอออนิก (ionic character)
แม้จะมีการจำแนกในเบื้องต้นเอาไว้ว่า
เมื่อโลหะสร้างพันธะกับอโลหะจะได้พันธะไอออนิก และถ้าอโลหะสร้างพันธะกับอโลหะจะได้พันธะโคเวเลนต์ แต่มาถึงขั้นนี้ให้เข้าทำความใจเพิ่มเติมว่าความเป็นไอออนิกหรือโคเวเลนต์ไม่ได้แบ่งแยกกันอย่างเด็ดขาด
หมายความว่าพันธะแต่ละพันธะมีทั้งความเป็นไอออนิกและความเป็นโคเวเลนต์อยู่พร้อมกัน
ถ้ามีแนวแนวโน้มว่าเป็นแบบใดมากกว่าจึงจะจัดให้เป็นพันธะชนิดนั้น
สิ่งที่จะใช้ตัดสินว่าเป็นไอออนิกหรือโคเวเลนต์เรียกว่า ”เปอร์เซ็นต์ไอออนิก” (percent ionic character , % ionic character ) ถ้าพิจารณาอย่างง่าย
ๆอาจดูเพียงผลต่างของค่า EN ของธาตุที่สร้างพันธะกัน ถ้าต่างกันมากความเป็นไอออนิกก็มาก พิจารณาค่า EN จากตารางต่อไปนี้
ถ้า Na
สร้างพันธะกับธาตุหมู่
7A
ความแตกต่างของค่า EN จะเป็นดังตาราง
|
พันธะระหว่าง
|
ความแตกต่างของค่า EN
|
|
Na + F → NaF
|
4.0-0.9 = 3.1
|
|
Na + Cl → NaCl
|
3.0-0.9 = 2.1
|
|
Na + Br → NaBr
|
2.8-0.9 = 1.9
|
|
Na + I → NaI
|
2.5-0.9 = 1.6
|
* จากความแตกต่างของค่า
EN ทำให้ลำดับความเป็นไอออนิกของสารประกอบจากมากไปน้อยจะเป็นดังนี้ ;
NaF > NaCl > NaBr > NaI
Linus Pauling กำหนดสมการสำหรับคำนวณความเป็นไอออนิก หรือที่เรียกว่า % ionic character โดยใช้ค่า En ของธาตุที่สร้างพันธะกัน
สมการดังกล่าวเป็นดังนี้
% ionic character =
{1- exp[-(0.25)(Xa - Xb)2]} x 100
* Xa และ Xb
คือค่า En ของธาตุแต่ละธาตุที่สร้างพันธะกัน
ตามนิยามนี้ให้ถือว่าพันธะใดที่มีค่า
% ionic
character น้อยกว่า 50 ให้ถือว่าเป็นพันธะโควาเลนซ์ และพันธะใดที่มีค่า
% ionic
character มากกว่า 50 ให้ถือว่าเป็นพันธะไอออนิก แตในทางปฏิบัติจะใช้เป็นช่วงคือระหว่างร้อยละ 40-60
ถ้าต่ำกว่า 40 เป็นโคเวเลนต์
ถ้าสูงกว่า 60 เป็นไอออนิก
ถ้าอยู่ระหว่าง 40-60 จะเป็นได้ทั้งไอออนิกและโคเวเลนต์
ตัวอย่าง
พันธะระหว่างอะตอม Na (En = 0.93) กับ Cl
(En = 3.16)
%
ionic character = {1- exp[-(0.25)(3.16 - 0.93)2]} x 100 = 71.15%
พันธะระหว่างอะตอม C (En = 2.55) กับ Cl
(En = 3.16)
%
ionic character = {1- exp[-(0.25)(3.16 - 2.55)2]} x 100 = 8.88%
พันธะระหว่างอะตอม Ti (En = 1.54) กับ Cl
(En = 3.16)
%
ionic character = {1- exp[-(0.25)(3.16 - 1.54)2]} x 100 = 48.11%
พันธะระหว่างอะตอม Al (En = 1.61) กับ Cl
(En = 3.16)
%
ionic character = {1- exp[-(0.25)(3.16 - 1.61)2]} x 100 = 54.85%
พันธะระหว่างอะตอม Cu (En = 1.90) กับ Cl
(En = 3.16)
%
ionic character = {1- exp[-(0.25)(3.16 - 1.90)2]} x 100 = 32.76%
จากค่าที่คำนวณได้จะเห็นว่าพันธะระหว่าง Na กับ Cl จะเป็นมีความเป็นพันธะไอออนิกที่โดดเด่น
ในขณะที่พันธะระหว่าง C
กับ Cl จะเป็นพันธะโควาเลนซ์อย่างชัดเจน
พันธะระหว่าง Cu กับ Cl มีความเป็นโควาเลนซ์เช่นกันแต่ไม่ชัดเจนเท่า C กับ
Cl
สำหรับพันธะระหว่าง Ti กับ Cl
(เช่นใน TiCl4) ที่มีค่า % ionic
character 48.11% และพันธะระหว่าง Al กับ Cl
(เช่นใน AlCl3) ที่มีค่า % ionic
character 54.85% นั้นบ่อยครั้งที่เรามองว่าสารประกอบดังกล่าวเป็นสารประกอบโคเวเลนซ์
และก็มีเหมือนกันในบางกรณีที่ต้องมองเป็นสารประกอบไอออนิก
พิจารณาพันธะระหว่าง Si กับ O
และ Al กับ O บ้าง
พันธะระหว่างอะตอม Si (En = 1.90) กับ O
(En = 3.44)
%
ionic character = {1- exp[-(0.25)(3.44 - 1.90)2]} x 100 = 44.73%
พันธะระหว่างอะตอม Al (En = 1.61) กับ O
(En = 3.44)
%
ionic character = {1- exp[-(0.25)(3.44 - 1.61)2]} x 100 = 56.71%
จะเห็นว่าพันธะระหว่าง Si กับ O
นั้นและพันธะระหว่าง Al กับ O
นั้นต่างก็อยู่ในบริเวณที่อาจมองได้ว่าเป็นทั้งโควาเลนซ์และไอออนิก
โดยพันธะระหว่าง Si
กับ O นั้นจะมีความเป็นโควาเลนซ์มากกว่าพันธะระหว่าง
Al กับ O
พิจารณาพันธะระหว่าง H กับ O บ้าง
พันธะระหว่างอะตอม H (En = 2.20) กับ O
(En = 3.44)
%
ionic character = {1- exp[-(0.25)(3.44 - 2.20)2]} x 100 = 31.91%
จะเห็นว่าพันธะระหว่าง H กับ O มีความเป็นไอออนิกต่ำกว่ากว่าพันธะระหว่าง Al กับ O
หรือ Si กับ O
เพื่อให้สังเกตได้ง่าย
จะนำค่าที่เกี่ยวข้องมาแสดงในตารางต่อไปนี้
|
ธาตุที่สร้างพันธะและค่า EN
|
ผลต่างของค่า EN
|
% ionic chalacter
|
|
Na (En = 0.93)
Cl (En = 3.16)
|
2.33
|
71.15
|
|
C (En = 2.55)
Cl (En = 3.16)
|
0.61
|
8.88
|
|
Ti (En = 1.54)
Cl (En = 3.16)
|
1.62
|
48.11
|
|
Al (En = 1.61)
Cl (En = 3.16)
|
1.55
|
43.85
|
|
Cu (En = 1.90)
Cl (En = 3.16)
|
1.26
|
32.76
|
|
Si (En = 1.90)
O
(En = 3.44)
|
1.54
|
31.91
|
|
Al (En = 1.61)
O
(En = 3.44)
|
1.83
|
56.71
|
|
H (En = 2.20)
O
(En = 3.44)
|
1.24
|
31.91
|
ความแตกต่างของค่า EN ระหว่างธาตุที่สร้างพันธะกันกับ % ionic character ของพันธะที่เกิดขึ้นเป็นดังกราฟต่อไปนี้
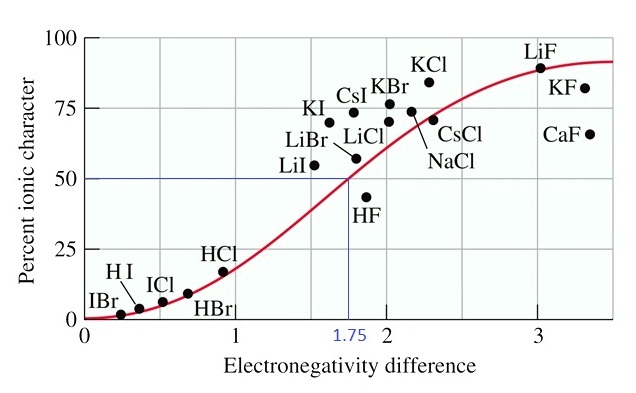
จากกราฟจะเห็นได้ว่าพันธะที่มี percent
ionic charecter = 50
จะมีความแตกต่างของค่า EN ประมาณ 1.75
เมื่อดูตัวอย่างของสารที่แสดงในกราฟจะเห็นว่า พันธะที่มี
percent ionic charecter > 50
จะเป็นพันธะระหว่างโลหะกับอโลหะ
ในทางกลับกันเมื่อความแตกต่างของค่า EN น้อยกว่า
1.75 จะพบว่า percent ionic charecter < 50
พันธะที่ได้จะเป็นพันธะโคเวเลนต์
มีตารางแสดงผลต่างของค่า EN ของธาตุที่สร้างพันธะกันและ % ionic ของพันธะที่เกิดขึ้น ใช้เป็นเกณฑ์ในการพิจารณาว่าพันธะต่าง ๆ มีความเป็นไอออนิกเพียงใด แต่ให้สังเกตว่า % ionic สูงสุดจะไม่ถึง 100
%
|
(EN)
%ionic
|
0.1
0.5
|
0.2
1
|
0.3
2
|
0.4
4
|
0.5
6
|
0.6
9
|
0.7
12
|
0.8
15
|
0.9
19
|
1.0
22
|
1.1
26
|
|
(EN)
%ionic
|
1.2
30
|
1.3
34
|
1.4
39
|
1.5
43
|
1.6
47
|
1.7
51
|
1.8
55
|
1.9
59
|
2.0
63
|
2.1
67
|
2.2
70
|
|
(EN)
%ionic
|
2.3
74
|
2.4
76
|
2.5
79
|
2.6
82
|
2.7
84
|
2.8
86
|
2.9
88
|
3.0
89
|
3.1
91
|
3.2
92
|
|
นอกจากนั้นยังพบว่ามีกี่กำหนดให้ใช้ผลต่างของค่า EN
หรือ (EN) ในการจำแนกชนิดของพันธะแยกย่อยออกไปอีก โดยแบ่งออกเป็น 3
ระดับ คือ
1. ถ้าค่า EN ต่างกันน้อยกว่า 0.5
เป็นพันธะโคเวเลนต์ไม่มีขั้ว
2. ถ้าค่า EN ต่างกันระหว่าง 0.5
ถึง 1.7 เป็นพันธะโคเวเลนต์มีขั้ว
3.
ถ้าค่า EN ต่างกันมากกว่า 1.7
เป็นพันธะไอออนิก
** แต่อย่างไรก็ตามพบว่าเกณฑ์ที่ใช้จำแนกสมบัติของพันธะในลักษณะนี้ มีการกำหนดไม่ตรงกันแต่มีแนวโน้มไป
ในทางเดียวกัน
จึงควรสังเกตเป็รายกรณีด้วยว่าในแต่ละแห่งต้องการใช้เกณฑ์ใด เพื่อปรับเปลี่ยนใช้ให้เหมาะสม
*******************************
Content's Picture

Size : 15.33 KBs
Upload : 2012-11-17 06:59:59
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|