โครงสร้างอะตอม ตอนที่ 6 แบบจำลองอะตอมชนิดกลุ่มหมอกอิเล็กตรอน
แบบจำลองอะตอมชนิดกลุ่มหมอกอิเล็กตรอน (electron cloud
atomic model) หรือแบบจำลอง
อะตอมเชิงควอนตัม (Quantum mechanical model)
แบบจำลองอะตอมของโบห์รใช้ได้ดีกับอะตอมของไฮโดรเจนเท่านั้น เนื่องจากมีอิเล็กตรอนเพียง 1
ตัว แต่เมื่อนำไปใช้กับอะตอมของธาตุอื่น
ๆ ที่มีอิเล็กตรอนหลายตัว ปรากฏว่าไม่สามารถอธิบาย เส้นสเปกตรัมที่เกิดขึ้นได้ ทำให้มีการศึกษา เพิ่มเติมต่อไปอีก พบว่าอิเล็กตรอนไม่ได้เคลื่อนที่เป็นวงกลม ดังที่โบห์รเสนอไว้
เมื่อมีการศึกษาถึงระดับพลังงานย่อย (subshell)
พบว่าการเคลื่อนที่ของ อิเล็กตรอนรอบ
ๆ นิวเคลียสมีหลายแบบ และมีพลังงานต่าง ๆ กัน
บริเวณที่พบอิเล็กตรอนแต่ละกลุ่มอาจเป็นทรงกลมหรือมีรูปทรงอื่น ๆ ซึ่งแล้วแต่ว่าอิเล็กตรอนนั้นจัดอยู่ในระดับพลังงานใด ทำให้แบบ จำลองอะตอมเปลี่ยนแปลงไปอีก
เมื่อใช้เทคนิค x-ray
diffraction (คลิ้กชมได้) นักวิทยาศาสตร์พบว่าอิเล็กตรอนซึ่งโคจรอยู่รอบ
ๆ นิวเคลียสนั้น มีการโคจรไปทั่วอะตอมตลอดเวลาทั้งสามมิติ ทิศทางในการเคลื่อนที่ไม่แน่นอน
(random) ดังนั้นจึงไม่สามารถบอกตำแหน่งที่แท้จริงของอิเล็กตรอนได้ แต่สามารถบอกได้ว่าโอกาสที่จะพบอิเล็กตรอนในบริเวณใกล้
ๆ นิวเคลียส มีมากกว่าในระยะห่างออกไป จากการทดสอบ กับอะตอมของไฮโดรเจนซึ่งมีอิเล็กตรอนเพียง
1 ตัว
ปรากฏว่าสามารถพบอิเล็กตรอนได้ทั่วไปทั้งสามมิติรอบนิวเคลียส ถ้าใช้จุด 1 จุดแทนตำแหน่งที่พบอิเล็กตรอน และมีการตรวจสอบซ้ำ ๆ นับพัน ๆ ครั้ง จะมีจุดแสดง ตำแหน่งของการพบอิเล็กตรอน นับพัน ๆ จุดเช่นกัน จึงดูคล้ายกลุ่มหมอกปกคลุมอยู่รอบนิวเคลียสเป็นทรงกลม
บริเวณใกล้ ๆ
นิวเคลียสกลุ่มหมอกจะหนาแน่นกว่าบริเวณที่อยู่ ห่างจากนิวเคลียสออกไป บริเวณที่มีกลุ่มหมอกหนาแน่นมาก
หมายถึงเป็นบริเวณที่มีโอกาสที่จะพบอิเล็กตรอนมากกว่าบริเวณที่มีกลุ่มหมอกจาง ดังรูป

การค้นพบนี้ทำให้ทราบเกี่ยวกับระดับพลังงานของอิเล็กตรอน
(shell) และระดับพลังงานย่อย
(subshell)
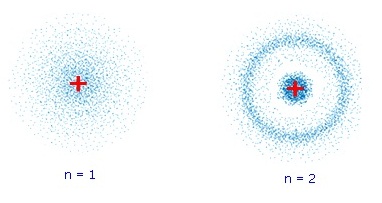
ได้ชัดเจนขึ้น ภาพซ้าย แสดงกลุ่มหมอกของอิเล็กตรอนของไฮโดรเจนขณะที่อะตอมมี พลังงานต่ำ อิเล็กตรอนอยู่ที่ระดับพลังงาน n=1 ภาพขวา เมื่ออะตอมมีพลังงานสูงขึ้น อิเล็กตรอนเลื่อนไปอยู่ที่ระดับพลังงาน n=2
การให้พลังงานเพิ่มขึ้นหรือลดลง
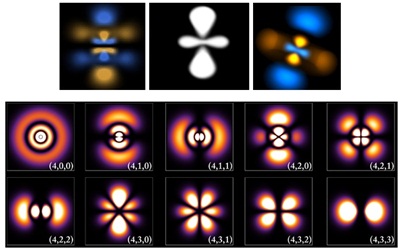
มีผลให้รูปทรงของกลุ่มหมอกอิเล็กตรอนเปลี่ยนแปลงไป
ทำให้ทราบว่าอิเล็กตรอนที่อยู่ในระดับพลังงานต่าง ๆ มีพื้นที่ในการโคจรอยู่บริเวณใด ทำให้ทราบว่ามี ระดับพลังงานย่อย (subshell) และทราบว่าอิเล็กตรอนจะอยู่ร่วมกันเป็นคู่
ๆ เรียกว่า orbital
ดังรูป
(คลิ้ก ชมแบบจำลองชนิดกลุ่มหมอกอิเล็กตรอน)
(คลิ้ก ชมแบบจำลองชนิดกลุ่มหมอกของ He
และเปรียบเทียบขนาดของกลุ่มหมอกกับขนาดของนิวเคลียสของฮีเลียม )
อะตอมที่แท้จริงจะเป็นดังที่นักวิทยาศาสตร์เสนอแบบจำลองเอาไว้หรือไม่นั้น
ยังเป็นสิ่งที่น่าสงสัยและรอคอยการพิสูจน์กันต่อไป
(คลิ้ก ชมวีดีทัศน์ Quantum model of
atom)
Content's Picture

Size : 27.43 KBs
Upload : 2015-04-01 05:05:00
|
|
 
Status : ผู้ใช้ทั่วไป
วิทยาศาสตร์
|
|
|